Download this issue Back to summary
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
Endovenous laser ablation (EVLA) is a less invasive alternative to vein stripping. Wyniki wydają się być równe lub lepsze niż w przypadku usuwania żył, z lepszymi wynikami jakości życia w okresie pooperacyjnym. Wykazano, że EVLA koryguje lub znacząco poprawia zaburzenia hemodynamiczne u pacjentów z przewlekłą niewydolnością żylną (CVI) z powierzchownym refluksem żylnym. Wczesne raporty sugerują , że techniki endovenous ablacji, w przeciwieństwie do chirurgicznego strippingu, są związane z niską częstością występowania neowaskularyzacji.
Różne długości fali są używane by wykonać EVLA. Podczas gdy początkowy chromofor to woda lub hemoglobina, zależnie od stosowanej długości fali, węgiel wydaje się być drugorzędnym, ale kluczowym chromoforem, który prawdopodobnie jest niezależny od długości fali.
Zastosowanie zasad znieczulenia tumescencyjnego do zabiegów żylnych, wraz z rozwojem technik ablacji endowaskularnej, daje możliwość leczenia zdecydowanej większości pacjentów z żylakami w gabinecie, bez znieczulenia ogólnego lub nacięć chirurgicznych, przy jednoczesnej maksymalizacji wyników i minimalizacji nawrotów.
INTRODUCTION
Refluks żyły odpiszczelowej jest podstawową pierwotną nieprawidłowością w większości przypadków powierzchownej niewydolności żylnej. Tak, podejścia do radzenia sobie z saphenofemoral połączenia i saphenous truncal niekompetencji zdominowały myślenie phlebologists. W latach 90-tych XIX wieku Trendelenburg opisał podwiązanie samego połączenia odpiszczelowo-udowego, bez usuwania niewydolnej żyły odpiszczelowej. Zalety samego podwiązania w porównaniu z podwiązaniem i usunięciem żyły, które są nadal wychwalane dzisiaj,1 obejmują zachowanie pnia odpiszczelowego do ewentualnego przyszłego wykorzystania jako bypass2 i uniknięcie uszkodzenia nerwu odpiszczelowego.3 Samo podwiązanie jest mniej inwazyjne, szybsze i prostsze do wykonania i związane z łatwiejszym powrotem do zdrowia w porównaniu z usunięciem żyły. Prawdą jest, że rutynowo „oszczędza” pień odpiszczelowy,4 a użycie chorej żyły odpiszczelowej jako łącznika wiąże się ze zwiększonym ryzykiem niepowodzenia przeszczepu.5 Co najważniejsze, nie ma już wątpliwości, że samo podwiązanie powoduje zwykle utrzymujący się refluks w pniu odpiszczelowym.6,7 Nawroty żylaków są znacznie zmniejszone7-9 , a odsetek reoperacji jest o 60% do 70% mniejszy, jeśli żyła odpiszczelowa jest pozbawiona żyły w porównaniu z samym podwiązaniem.10,11 Również po samym podwiązaniu nawrót lub resztkową komunikację ze zbiegiem w pachwinie stwierdzono u 80% pacjentów, a u 34% wystąpiła również niewydolność perforatora środkowego uda przez nie podwiązaną żyłę odpiszczelową wielką (GSV).12 Jak wynika z wniosków Neglena, podwiązanie żyły odpiszczelowej uda jest niezbędne do zminimalizowania nawrotów spowodowanych ponownym rozwojem niewydolnej komunikacji ze zbiegiem odpiszczelowo-udowym oraz niewydolnością perforatora uda.13 Po prostu, wady samego podwiązania przewyższają jego zalety.
Należy zauważyć, że nawroty są częste nawet po podwiązaniu i usunięciu żyły odpiszczelowej. Podczas gdy nieodpowiednia operacja połączenia odpiszczelowo-udowego i progresja choroby są mechanizmami tłumaczącymi niektóre przypadki nawrotów, innym ważnym mechanizmem jest neowaskularyzacja wokół połączenia po operacji żylnej.11,14 W rzeczywistości neowaskularyzacja została opisana jako główna przyczyna nawrotów,9 przy czym kanały neowaskularne o zmiennej wielkości, liczbie i krętości odpowiadają za refluks do nawracających żylaków w większości przypadków.15 Chociaż niektórzy wyrażają wątpliwości co do prawdziwości prawdziwej neowaskularyzacji, istnieją wyraźne dowody histologiczne na to, że neowaskularyzacja jest przyczyną nawrotów żylaków.16 Wczesne doniesienia sugerują z kolei, że techniki ablacji endowaskularnej wiążą się z bardzo małą częstością występowania neowaskularyzacji. 17 Być może rozwojowi neowaskularyzacji w dużym stopniu zapobiega unikanie rozcięcia pachwiny i zachowanie drenażu żylnego w prawidłowych dopływach łącznotkankowych.18,19
EVLA, podobnie jak ablacja prądem o częstotliwości radiowej i skleroterapia piankowa, jest mniej inwazyjną alternatywą dla usuwania żył. EVLA jest wskazana u pacjentów ambulatoryjnych z refluksem żyły odpiszczelowej wielkiej, małej lub dodatkowej z żylakami powierzchniowymi i/lub objawami lub powikłaniami związanymi z niewydolnością żył powierzchownych. Zabieg EVLA jest rutynowo wykonywany w warunkach gabinetowych z zastosowaniem rozcieńczonego znieczulenia miejscowego, z uzupełniającym doustnym lekiem anksjolitycznym lub bez niego. Czas zabiegu wynosi zazwyczaj 30-60 minut i zależy od długości leczonego odcinka, doświadczenia operatora oraz od tego, czy wykonywane są procedury pomocnicze, takie jak ambulatoryjna flebektomia. Niezależnie od sposobu leczenia niewydolności żyły odpiszczelowej, do leczenia pozostałych żylaków zwykle potrzebne są zabiegi dodatkowe (Rycina 1).
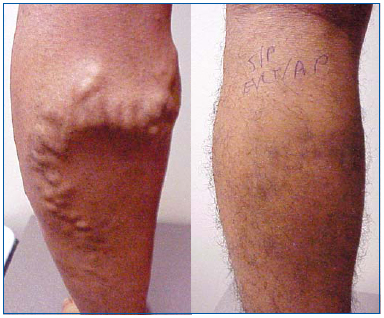
Rycina 1. 26-letni mężczyzna przed i 1 miesiąc po ablacji laserowej żyły odpiszczelowej wielkiej i ambulatoryjnej flebektomii żylakowatych dopływów.
EFEKTYWNOŚĆ
Krótko- i średnioterminowe badania EVLA, bez względu na długość użytej fali, wydają się być niezwykle spójne, zwykle opisując ablację refluksujących żył odpiszczelowych w 90% lub więcej przypadków.18,20-23 Wykazano, że EVLA żyły odpiszczelowej koryguje lub znacząco poprawia zaburzenia hemodynamiczne i objawy kliniczne przewlekłej niewydolności żylnej (CVI) u pacjentów z kliniczną, etiologiczną, anatomiczną i patofizjologiczną (CEAP) klasą kliniczną 3-6 z powierzchownym refluksem żylnym.24,25 Wyniki wydają się takie same lub lepsze niż w przypadku strippingu, z lepszą oceną jakości życia w okresie pooperacyjnym w porównaniu z strippingiem.20,25-27 Odnotowano wysoki wskaźnik zadowolenia pacjentów.18,28,29 Całkowity koszt (koszt zabiegu plus koszt społeczny) zabiegów endowaskularnych jest prawdopodobnie równy lub niższy niż koszt zabiegu chirurgicznego.27
Wczesne dane dotyczące leczenia GSV za pomocą urządzeń 810 nm i 940 nm sugerują, że niepowodzenie leczenia jest rzadkie u pacjentów leczonych > 70 J/cm.30,31 Szybkość wycofywania 2 mm/s przy 14 watach dostarcza 70 J/cm.
MECHANIZM DZIAŁANIA
Następujące długości fali są w bieżącym użyciu dla EVLA: 810, 940, 980, 1064, 1319, 1320 i 2068 nm. Postuluje się, że w uszkodzeniu ściany żyły pośredniczy zarówno efekt bezpośredni, jak i pośredni, poprzez indukowaną laserem parę wodną generowaną przez ogrzewanie niewielkich ilości krwi w żyle.32 Niektórzy sugerują, że wybór długości fali ma duży wpływ na wyniki.23
Głównym chromoforem laserów 1320 i 2078 nm, przynajmniej początkowo, jest woda, podczas gdy inne długości fali używane do EVLA są przede wszystkim ukierunkowane na hemoglobinę. Oczywiście, aby uzyskać skuteczną ablację, konieczne jest odpowiednie termiczne uszkodzenie ściany żyły. Pewne podgrzanie może nastąpić przez bezpośrednią absorpcję energii fotonów (promieniowanie) przez ścianę żyły, jak również przez konwekcję z pęcherzyków pary wodnej i przewodzenie z podgrzanej krwi. Jest jednak mało prawdopodobne, aby te ostatnie mechanizmy odpowiadały za większość oddziaływań na żyłę. Maksymalna temperatura krwi wynosi 100°C. Stwierdzono, że leczenie laserowe powoduje karbonizację ściany żyły.33 Karbonizację końcówki lasera, która występuje w temperaturze około 300°C, odnotowano po EVLA i wydaje się ona występować niezależnie od długości użytej fali.34 Karbonizacja końcówki włókna laserowego tworzy punktowe źródło ciepła i zasadniczo zmniejsza penetrację światła w tkance do zera.34,35 Mordon i wsp. stwierdzili: „Para wodna wytwarzana w wyniku absorpcji energii lasera przez krew stanowi niewielki ułamek energii niezbędnej do uszkodzenia ściany żyły i nie może być głównym mechanizmem uszkodzenia żyły za pomocą lasera endowaskularnego. Zwęglenie i ubytki w ścianach żył widoczne w badaniu histologicznym po zastosowaniu lasera wewnątrzżylnego mogą być jedynie wynikiem bezpośredniego kontaktu końcówki włókna laserowego ze ścianą żyły. „36 Dr Rox Anderson, dyrektor Wellman Center for Photomedicine w Massachusetts General Hospital, stwierdził, że węgiel wydaje się być drugorzędnym, ale kluczowym chromoforem, który jest prawdopodobnie niezależny od długości fali (ryc. 2).34 Należy pamiętać, że końcówka i kształt włókna mogą mieć wpływ na rozwój zwęglenia.37

Rysunek 2. Karbonizacja końcówki 600-mikronowego włókna laserowego wtórna do endowaskularnej ablacji laserowej laserem o długości fali 1320 nm (zdjęcie dzięki uprzejmości Marka Forrestala, MD, FACPh).
ANESTEZJA TUMESCENTOWA
EVLA należy wykonywać w znieczuleniu miejscowym, stosując duże objętości rozcieńczonego roztworu lidokainy i epinefryny (średnia objętość 200-400 mL 0,1% lidokainy z epinefryną 1:1 000 000), który jest buforowany wodorowęglanem sodu. Roztwór ten powinien być podawany ręcznie lub za pomocą pompy infuzyjnej pod kontrolą ultrasonograficzną, tak aby żyła była otoczona płynem znieczulającym na całej długości leczonego odcinka (ryc. 3).
Zalety znieczulenia tumescencyjnego do ablacji wewnątrzżylnej obejmują:
– znieczulenie,
– oddzielenie leczonej żyły od otaczających ją struktur,
– pochłaniacz termiczny, który zmniejsza szczytową temperaturę w tkankach okołonaczyniowych,
– kompresję żyły, która maksymalizuje efekt leczenia na ścianie żyły.
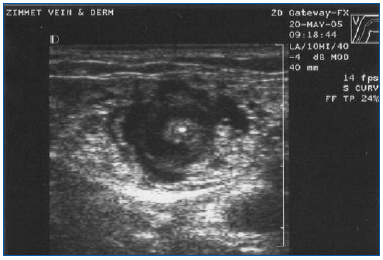
Rycina 3. Poprzeczny obraz ultrasonograficzny tumescencyjnego płynu znieczulającego otaczającego centralnie położoną żyłę odpiszczelową wielką i włókno/płytkę lasera.
Ale maksymalna bezpieczna dawka lidokainy przy zastosowaniu techniki tumescent w procedurach żylnych nie jest dobrze zbadana, dawka 35 mg/kg jest rozsądnym szacunkiem.
Używając tych parametrów, wykazano, że znieczulenie tumescent w kontekście liposukcji jest wyjątkowo bezpieczne. Więcej informacji można znaleźć na stronie http://www.liposuction.com/pharmacology/drug_inter act.php.
Przeciwwskazania do techniki EVLA
Przeciwwskazania do techniki EVLA przedstawiono w tabeli I.

Tabela I. Przeciwwskazania do stosowania lasera endovenous.
ADVERSE SEQUELAE
Krótkotrwały ból i wybroczyny były powszechnie obserwowane po EVLA. W retrospektywnym przeglądzie donoszono, że stosowanie przerywanej pulsacji włókna laserowego powoduje znacznie większy ból i zasinienie pooperacyjne w porównaniu z protokołem ciągłej pulsacji.38 Zastosowanie krótkiego bandaża przez 3 dni po EVLA w trybie przerywanym znacznie zmniejszyło zasinienie i ból zgłaszane przez pacjentów. Zastosowanie ciągłego trybu wycofywania jeszcze bardziej zmniejszyło nasilenie bólu i siniaków, do tego stopnia, że ich poziom był podobny do zgłaszanego przez pacjentów leczonych ablacją prądem o częstotliwości radiowej (tabele II i III). Wstępne doniesienia sugerują, że mogą istnieć pewne różnice w przebiegu pooperacyjnym w zależności od długości fali użytej do wykonania EVLA.22,39 Jest to jednak oparte na nielicznych danych z krótkoterminowej obserwacji.
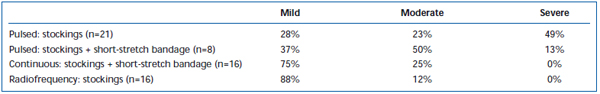
Tabela II. Oceniane przez pacjentów siniaki pooperacyjne 3-7 dni po pulsacyjnej ablacji laserem endovenous (EVLA) z pończochami klasy II, pulsacyjnej EVLA z pończochami i krótkim opatrunkiem elastycznym, EVLA w trybie ciągłym z pończochami i krótkim opatrunkiem elastycznym oraz ablacji prądem o częstotliwości radiowej z pończochami.
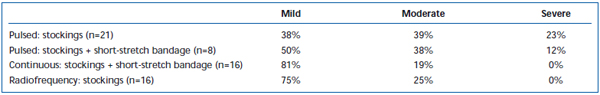
Tabela III. Oceniany przez pacjentów ból pooperacyjny 3-7 dni po pulsacyjnej ablacji laserem endovenous (EVLA) z pończochami klasy II, pulsacyjnej EVLA z pończochami plus bandażem krótkoodcinkowym, EVLA w trybie ciągłym z pończochami i bandażem krótkoodcinkowym oraz ablacji prądem o częstotliwości radiowej z pończochami.
PERIVENOUS THERMAL INJURY
Średnie szczytowe temperatury wewnątrznaczyniowe podczas EVLA (kozia żyła szyjna, 12 watów, impulsy 1-sekundowe, odstępy 1-sekundowe), mierzone równo z końcówką lasera, wynosiły średnio 729°C, podczas gdy temperatury 4 mm od końcówki wynosiły średnio 93°C.40 Ryzyko bocznego uszkodzenia termicznego zależy jednak od okołonaczyniowego ogrzewania tkanek, a nie od temperatury wewnątrznaczyniowej.
Odnotowano, że kolagen kurczy się w temperaturze około 50°C, natomiast martwica występuje w temperaturze od 70°C do 100°C.41 Zakres uszkodzenia termicznego tkanki jest silnie uzależniony od ilości i czasu trwania ciepła, na które narażona jest tkanka. Henriques i Moritz badali reakcję czasowo-temperaturową tkanki wystawionej na działanie temperatury do 70°C.42 Stwierdzili oni, że skóra jest w stanie wytrzymać wzrost temperatury przez bardzo krótki czas ekspozycji, a reakcja wydaje się być logarytmiczna w miarę skracania czasu ekspozycji. Na przykład, wzrost temperatury ciała do 58°C spowoduje zniszczenie komórek, jeśli czas ekspozycji jest dłuższy niż 10 sekund. Tkanki mogą jednak wytrzymać temperaturę do 70°C, jeśli czas ekspozycji jest utrzymywany przez mniej niż 1 sekundę. Li i wsp. stwierdzili, że ogrzewanie komórek śródbłonka do temperatury 48°C przez 10 minut nie spowodowało śmierci komórek.43 Stwierdzili oni również, że osteoblasty po ekspozycji przez 10 minut lub krócej w temperaturze 45°C uległy przejściowym i odwracalnym zmianom. W innym badaniu stwierdzono odwracalne uszkodzenie tkanki w tylnej kończynie myszy po zanurzeniu w łaźni wodnej w temperaturze 44°C.44
W ostatnim badaniu zmierzono szczytową temperaturę na zewnętrznej ścianie żyły podczas EVLA w żyle żywego ucha świni i w odsłoniętych żyłach tylnej kończyny.45 Ustawienia EVLA wahały się od 8 watów (czas trwania impulsu 1-2 sekundy), 10 watów (czas trwania impulsu 1-1,5 sekundy), 12 watów (czas trwania impulsu 0,5-1,5 sekundy) do 15 watów (czas trwania impulsu 0,5-1,0 sekundy), z i bez znieczulenia tumescencyjnego. Wyniki pokazują, że szczytowe temperatury wahały się od 34,6°C do 49,1°C jako funkcja dostarczonych dżuli, z niższymi temperaturami szczytowymi uzyskanymi, gdy obecny był płyn tumescencyjny (Rycina 4).
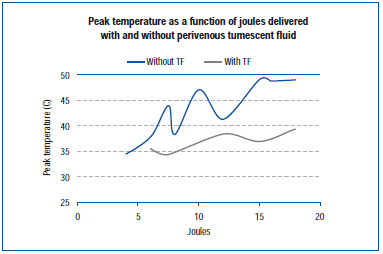
Figura 4. Zaadaptowano z Zimmet SE, Min RJ. Temperature changes in perivenous tissue during endovenous laser treatment in a swine model. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
Szczytowa temperatura mierzona podczas EVLA (63 pacjentów, 980 nm, 15 watów, impulsy 1,5 s) na zewnętrznej ścianie żyły u ludzi, 3 cm poniżej połączenia odpiszczelowo-udowego, wynosiła 40,9°C i 49,8°C, odpowiednio z i bez płynu tumescencyjnego.46 Podobne wyniki uzyskano w innym badaniu z udziałem ludzi podczas EVLA (12 pacjentów, 810 nm, 12 W, impulsy 1 sekunda, odstępy 1 sekundy, technika tumescencyjna), ze szczytowymi temperaturami 43,3°C, 42,0°C i 36,0°C odpowiednio w odległości 3 mm, 5 mm i 10 mm od GSV. 47
Wydaje się, że podczas EVLA występuje bardzo szybki spadek temperatury na krótkich dystansach. Dzieje się tak prawdopodobnie w przeciwieństwie do energii o częstotliwości radiowej, gdzie ogrzewanie mikrofalowe występuje wokół interfejsu tkanka-elektroda. Dane uzyskane na zwierzętach i ludziach sugerują, że szczytowe temperatury okołożylne generowane podczas stosowania lasera wewnątrzżylnego prawdopodobnie nie spowodują trwałego uszkodzenia tkanki okołożylnej w większości sytuacji. Szczytowa temperatura generowana podczas zabiegu jest zmniejszona dzięki zastosowaniu płynu tumescencyjnego. Wyniki te wydają się wyjaśniać bardzo niską zgłaszaną częstość występowania uszkodzeń nerwów i oparzeń skóry po EVLA. W jednym z badań z użyciem lasera Nd: YAG o długości fali 1064 nm odnotowano bardzo wysoką częstość występowania parestezji u 36,5% i oparzeń skóry u 4,8%.48 Należy zauważyć, że ilość dostarczonej energii była około trzykrotnie wyższa niż zazwyczaj stosowana, a zabieg przeprowadzono bez znieczulenia tumescencyjnego. Pomimo niskich temperatur okołożylnych odnotowanych w przypadku EVLA należy zauważyć, że należy zachować szczególną ostrożność przy rozważaniu interwencji endowaskularnej w niektórych przypadkach, takich jak żylaki nerwu kulszowego.49,50
MAŁE POWIKŁANIA
Poważne powikłania po EVLA odnotowywano rzadko. Częstość występowania zakrzepicy żył głębokich (DVT), zebrana z wielu serii, jest znacznie niższa niż 1%.17,18,20,28 W jednej z grup odnotowano częstość występowania rozszerzenia skrzepliny do żyły udowej wynoszącą 7,7%.51 W badaniu tym EVLA wykonywano jednak w znieczuleniu ogólnym lub rdzeniowym. Fakt, że chorzy nie byli w stanie poruszać się bezpośrednio po zabiegu, mógł przyczynić się do częstego występowania poszerzenia skrzepliny. Istnieje jedno doniesienie o przetoce tętniczo-żylnej, która rozwinęła się po EVLA żyły odpiszczelowej krótkiej (SSV).52 U jednego chorego rozwinęło się septyczne zakrzepowo-zarostowe zapalenie żył po EVLA połączonym z otwartym podwiązaniem perforatorów i flebektomią stab.53. U jednego chorego wystąpiło septyczne zapalenie zakrzepowo-zatorowe po EVLA połączonym z otwartym podwiązaniem perforatorów i flebektomią stab.53 Ustępowało ono po zastosowaniu antybiotykoterapii i debridementu.
ATRAKCJE ZASTĘPCZE
EVLA i ablacja prądem o częstotliwości radiowej (RFA)54,55 Obie metody wydają się być skutecznymi metodami leczenia niewydolności odpiszczelowej. Zaletą EVLA w porównaniu z RFA jest krótszy czas zabiegu i niższy koszt pojedynczego zabiegu. Zgłaszane wskaźniki okluzji w przypadku EVLA są na ogół nieco wyższe niż w przypadku RFA.56 Wadą EVLA może być większe zasinienie i dyskomfort we wczesnym okresie pooperacyjnym, chociaż może to być zależne od techniki. Obie techniki są wciąż udoskonalane, co przyczynia się do poprawy wyników. Obie procedury, gdy są wykonywane przy użyciu znieczulenia tumescencyjnego, są związane z niskim wskaźnikiem powikłań.
Innym pojawiającym się sposobem leczenia refluksu odpiszczelowego jest użycie spienionych sklerozantów dostarczanych pod kontrolą ultradźwięków. Gaz, taki jak powietrze lub CO2, może być mieszany z płynnymi detergentowymi sklerozantami w celu wytworzenia piany, która jest około cztery razy silniejsza niż płynna forma tego samego środka. Wczesne wyniki sugerują, że może to być wartościowa metoda, ponieważ jest szybka i niedroga w wykonaniu, a wskaźniki sukcesu krótko- i średnioterminowego wynoszą około 75% do 90%. Istnieje wiele zmiennych dotyczących piany (np. rodzaj i ilość gazu, technika wytwarzania piany, stężenie i rodzaj użytego sklerozantu, wstrzykiwana objętość itp.) Może istnieć większe ryzyko zakrzepicy żył głębokich po skleroterapii piankowej w porównaniu do skleroterapii standardowej. Prawidłowa technika jest ważna, aby zminimalizować ryzyko tego powikłania. Inne efekty uboczne zgłaszane po skleroterapii piankowej to zaburzenia widzenia i neurologiczne. Opublikowano doniesienie o udarze mózgu po skleroterapii piankowej (20 mL pianki polidokanolowej) u pacjenta z 1,8 cm drożnym przewodem owalnym.57 Dalsze doświadczenia i badania nad tą metodą pozwolą lepiej określić jej ryzyko, jak również długoterminową skuteczność.
KONKLUZJA
Obecnie przyjęte zasady leczenia żylaków służą maksymalizacji wyników z hemodynamicznego i pacjenta punktu widzenia, przy jednoczesnej minimalizacji ryzyka nawrotów. Właściwe leczenie żylaków rozpoczyna się od dokładnej oceny patologii żylnej leżącej u podłoża i identyfikacji źródeł nadciśnienia żylnego. Celem leczenia jest eliminacja niewydolnych połączeń między układem głębokim i powierzchownym, a także obliteracja dróg niewydolności żylnej i niewydolnych żylaków. Jest oczywiste, że nawroty są zmniejszone, jeżeli niewydolny segment pnia odpiszczelowego jest ablowany.
Endovenous ablacja laserowa jest mniej inwazyjną alternatywą dla usuwania żył. Wyniki wydają się być równe lub lepsze od tych po strippingu, z lepszymi wynikami jakości życia w okresie pooperacyjnym. Wykazano, że EVLA koryguje lub znacząco poprawia zaburzenia hemodynamiczne u pacjentów z przewlekłą niewydolnością żylną z powierzchownym refluksem żylnym. Wczesne doniesienia sugerują, że techniki ablacji endovenous, w przeciwieństwie do chirurgicznego strippingu, wiążą się z niską częstością występowania neowaskularyzacji.
Zastosowanie zasad znieczulenia tumescencyjnego do zabiegów żylnych, wraz z rozwojem technik ablacji wewnątrzżylnej, stwarza możliwość leczenia zdecydowanej większości pacjentów z powierzchowną niewydolnością żylną w gabinecie, bez znieczulenia ogólnego lub nacięć chirurgicznych, przy jednoczesnej maksymalizacji wyników i minimalizacji nawrotów.
Ta praca była złożona w lipcu 29, 2006.

2. Large J. Surgical treatment of saphenous varices, with preservation of the main great saphenous trunk. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. The anatomic relationship between the long saphenous vein and the saphenous nerve. Znaczenie dla radykalnej operacji żylaków. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. The fate of residual saphenous vein after partial removal or ligation. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Objective assessment of ligation without stripping the long saphenous vein. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Assessment of stripping the long saphenous vein in the treatment of primary varicose veins. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. To strip or not to strip the long saphenous vein? A varicose vein trial. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. Neovascularisation is the principal cause of varicose vein recurrence: results of a randomised trial of stripping the long saphenous vein. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Stripping the long saphenous vein reduces the rate of reoperation for recurrent varicose veins: five-year results of a randomized trial. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Causes of varicose vein recurrence: late results of a randomized controlled trial of stripping the long saphenous vein. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Reasons to strip the long saphenous vein. Phlebologie. 1988;41:766-769.
13. Neglen P. Treatment of varicosities of saphenous origin: comparison of ligation, selective excision, and sclerotherapy. In: Bergan JJ, Goldman MP eds. Varicose Veins and Telangiectasias: Diagnosis and Treatment. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetent saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Endovenous laser treatment of saphenous vein reflux: long-term results. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. The first 1000 cases of Italian endovenous-laser Working Group (IEWG). Rationale, and long-term outcomes for the 1999-2003 period. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Piętnaście lat temu laser miał otwierać tętnice, teraz ma zamykać żyły: jaka rzeczywistość kryje się za tym narzędziem? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (dyskusja 9- 10).
22. Kabnick LS. Outcome of different endovenous laser wavelengths for great saphenous vein ablation. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Intravascular 1320-nm laser laser closure of the great saphenous vein: a 6- to 12-month follow-up study. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenous saphenous ablation corrects the hemodynamic abnormality in patients with CEAP clinical class 3-6 CVI due to superficial reflux. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Comparison of endovenous treatment with an 810 nm laser versus conventional stripping of the great saphenous vein in patients with primary varicose veins. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose veins. Phlebology. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins: early results from a large single-center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Greater energy delivery improves treatment success of endovenous laser treatment of incompetent saphenous veins. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenous laser: mechanism of action. Paper presented at the Annual Meeting of the American Academy of Dermatology; March 3-7, 2006; San Francisco, California, USA.
35. Izzo F. Other thermal ablation techniques: microwave and interstitial laser ablation of liver tumors. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B and Zemmouri J. Mathematical modeling of endovenous laser treatment (ELT). BioMedical Engineering OnLine. 2006;5:26. Dostępne na: http://www.biomedical-engineeringonline. com/content/5/1/26. Accessed July 19, 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Experimental study of diodelaser induced thermocoagulation on hepatic tissue with scanner fiber tip. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Pain, bruising and short-term efficacy after endovenous laser treatment of the greater saphenous vein: the effect of operative technique and postoperative care. Paper presented at the 16th Annual Congress of the American College of Phlebology; Nov 7-10, 2002; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenous treatment of the great saphenous vein using a 1320 nm Nd:YAG laser causes less side effects than using a 940 nm diode laser. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Comparison of endovenous radiofrequency versus 810 nm diode laser occlusion of large veins in an animal model. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Laser incisional surgery. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studies of thermal injury II: the relative importance of time and surface temperature in the causation of cutaneous bums. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Heat shockinduced necrosis and apoptosis in osteoblasts. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Histopathological changes in the skin and subcutaneous tissues of mouse legs after treatment with hyperthermia. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Temperature changes in perivenous tissue during endovenous laser treatment in a swine model. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Thermometric investigations of perivenous temperature during endovenous laser therapy of varicose veins. Paper presented at the 15th World Congress of the Union Internationale de Phlébologie; October 2-7, 2005; Rio de Janeiro, Brazil.
47. Beale RJ, Mavor AID, Gough MJ. Heat dissipation during endovenous laser treatment of varicose veins-is there a risk of nerve injury? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenous laser photocoagulation (EVLP) for varicose veins. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Sciatic nerve varices. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Ultrasound observation of the sciatic nerve and its branches at the popliteal fossa: always visible, never seen. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extension of saphenous thrombus into the femoral vein: a potential complication of new endovenous ablation techniques. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenous fistula after endovenous laser treatment of the short saphenous vein. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuse phlegmonous phlebitis after endovenous laser treatment of the greater saphenous vein. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Endovascular obliteration of saphenous reflux: a multicenter study. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early efficacy and complications. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.
.