US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRACT: Los inhibidores de la bomba de protones (IBP) son una clase de agentes antisecretores utilizados para tratar diversas afecciones gastrointestinales, como la enfermedad por reflujo gastroesofágico, los trastornos relacionados con Helicobacter pylori y las úlceras gástricas y duodenales. Aunque estos agentes son supresores de la acidez eficaces, el uso de los IBP es frecuentemente debatido en base a los informes de nuevos eventos adversos potenciales. La sobreutilización y las interacciones farmacológicas son problemas asociados a los IBP. Además, dado que varios IBP están disponibles sin receta médica, el uso inapropiado de estos agentes es una preocupación importante. Los farmacéuticos de todos los ámbitos pueden tener un profundo impacto en el uso inadecuado de los IBP asegurando el inicio y la continuación del tratamiento, la dosificación y la duración del mismo.
Los inhibidores de la bomba de protones (IBP) son una clase de fármacos comúnmente utilizados para el tratamiento de diversos trastornos gastrointestinales (GI), incluyendo la enfermedad por reflujo gastroesofágico (ERGE), los trastornos relacionados con Helicobacter pylori y las úlceras gástricas y duodenales. Aunque estos agentes antisecretores son el tratamiento preferido para numerosas afecciones, la clase está plagada de sobreutilización y de informes sobre efectos adversos potencialmente graves e interacciones farmacológicas.1 Además, el manejo de los pacientes de las afecciones tratadas con IBP se complica por la disponibilidad de varios de estos agentes sin receta médica. Este artículo pretende destacar el uso adecuado y proporcionar una descripción basada en la evidencia de varios inconvenientes nuevos o muy debatidos de estos agentes.
Disponibilidad de los IBP
Se pueden obtener seis IBP únicos, cinco de los cuales están disponibles de forma genérica, con receta médica (TABLA 1).2-7 Las dosis bajas de omeprazol, lansoprazol y una versión de marca de esomeprazol magnesio están disponibles sin receta médica. El omeprazol también se utiliza en un producto coformulado con bicarbonato sódico. Este artículo se centrará principalmente en los IBP de dosis oral disponibles genéricamente.
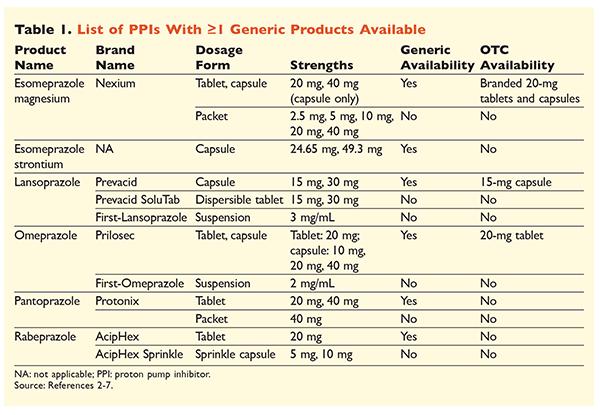
El esomeprazol estroncio fue aprobado por la FDA basándose en su bioequivalencia con el esomeprazol magnesio.3 Aunque el etiquetado del producto para estos dos agentes es muy similar, existen tres diferencias notables. En primer lugar, el esomeprazol estroncio está disponible en cápsulas de 24,65 mg y 49,3 mg, que son equivalentes al esomeprazol magnesio de 20 mg y 40 mg, respectivamente. En segundo lugar, el esomeprazol estroncio no está aprobado por la FDA para su uso en pacientes pediátricos, mientras que el esomeprazol magnesio está aprobado para su uso en personas de 1 mes o más. Por último, debe evitarse el uso de esomeprazol estroncio en caso de insuficiencia renal grave, ya que no se ha estudiado en esta población. No se recomienda ningún ajuste de la dosis de esomeprazol magnesio.3 A efectos de este artículo, se utilizará el término esomeprazol para describir esomeprazol magnesio.
Administración
Todos los IBP disponibles genéricamente, incluidas las cápsulas y los comprimidos, deben tragarse enteros sin partirlos, triturarlos ni masticarlos.2-7 Las cápsulas de omeprazol, lansoprazol y esomeprazol pueden abrirse y espolvorear su contenido en un puré de manzana para los pacientes que no puedan tragar las formas farmacéuticas orales. Además, las cápsulas de lansoprazol pueden rociarse en 2 onzas de zumo de manzana, tomate o naranja. Cualquier mezcla que contenga el contenido de las cápsulas abiertas debe tragarse inmediatamente y no debe almacenarse para su uso futuro.2,4,5
El lansoprazol, el omeprazol y el esomeprazol deben administrarse antes de las comidas, pero las recomendaciones específicas sobre los tiempos de administración varían. El omeprazol debe administrarse entre 30 y 60 minutos antes de la comida, y el esomeprazol al menos 60 minutos antes; no se especifica un plazo para el lansoprazol.2,4,5 El pantoprazol puede administrarse con o sin alimentos.6 El rabeprazol debe tomarse después de una comida para las úlceras duodenales y con una comida para la erradicación del H pylori; para todas las demás indicaciones, el rabeprazol puede tomarse con o sin alimentos.7
Dosificación y duración del tratamiento
Dada la reputación de los IBP de ser muy eficaces y generalmente seguros, la sobreutilización significativa de los IBP es una preocupación importante.1 No sólo se administran a menudo los IBP para indicaciones sin evidencia que apoye su uso, sino que estos medicamentos también se prescriben con frecuencia a dosis más altas de lo necesario para duraciones de tratamiento que se extienden más allá de los marcos de tiempo recomendados.8,9 Las dosis aprobadas de cada IBP y la duración recomendada del tratamiento se dan en las TABLAS 2 y 3. A continuación se exponen las recomendaciones de tratamiento que difieren de las aprobadas por la FDA, así como las perlas clínicas más destacadas relacionadas con el inicio, la dosificación y la duración del tratamiento con IBP.
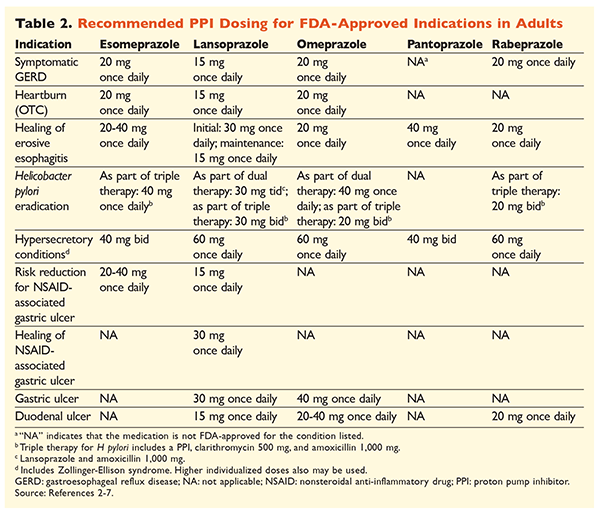
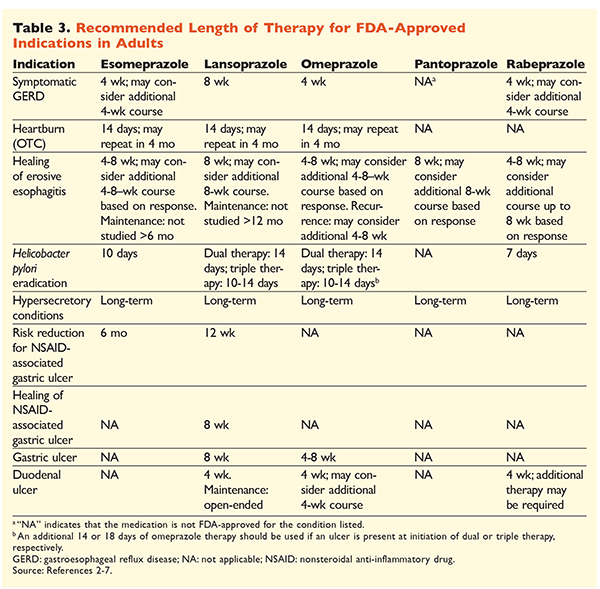
Dolor de estómago: En los pacientes con ERGE, todos los IBP se consideran igualmente eficaces, y se recomienda un tratamiento de 8 semanas con cualquier agente disponible.10 Los pacientes con síntomas refractarios al tratamiento después de 2 ó 3 meses pueden requerir un tratamiento de mantenimiento a largo plazo con dosis de dos días. Sin embargo, debe utilizarse la dosis efectiva más baja, y debe considerarse la posibilidad de utilizar un IBP diferente si el paciente no responde al tratamiento.10 También puede considerarse la posibilidad de utilizar un tratamiento con un IBP según sea necesario o un enfoque descendente hacia un antagonista de los receptores de la histamina 2 (ARH2).10 El tratamiento con un IBP de venta libre debe limitarse a 14 días, y el retratamiento no debe realizarse con más frecuencia que cada 4 meses.11
Ulceras asociadas a H pylori: Dependiendo del IBP que se utilice, los regímenes aprobados por la FDA para la erradicación de H pylori incluyen la terapia dual con amoxicilina o claritromicina y la terapia triple con ambos agentes durante 7 a 14 días.2-5,7 Los regímenes de tratamiento específicos respaldados por las directrices varían en comparación con los aprobados por la FDA, pero la duración recomendada de la terapia es similar, y todos los regímenes tienen un plazo de dosificación de 10 a 14 días.12 Tras la erradicación del H pylori, no es necesario el tratamiento de mantenimiento con IBP.13 Una discusión más detallada de los regímenes específicos está fuera del alcance de este artículo.
Profilaxis y tratamiento de las úlceras inducidas por AINE: Después de que se desarrolle una úlcera asociada a un antiinflamatorio no esteroide (AINE), se debe reevaluar la necesidad del tratamiento con AINE. Si se considera apropiado continuar el tratamiento con AINEs, los pacientes deben ser mantenidos con una terapia de ciclooxigenasa-2 selectiva a la dosis efectiva más baja durante la menor duración posible en combinación con un IBP.13
Para la profilaxis, el inicio de un IBP se recomienda sólo en pacientes con riesgo moderado o alto de toxicidad GI relacionada con AINEs. Los factores de riesgo incluyen la edad >65 años, el tratamiento con dosis altas de AINE, una historia previa de úlcera no complicada y el uso concurrente de aspirina (incluyendo dosis bajas), corticosteroides o anticoagulantes. Se considera que los pacientes con riesgo moderado de toxicidad gastrointestinal inducida por AINEs son los que tienen uno o dos de estos factores de riesgo, mientras que los pacientes con riesgo alto tienen más de dos factores de riesgo o antecedentes de una úlcera péptica previamente complicada, especialmente si era reciente.14 Es razonable continuar con el tratamiento con IBP mientras el paciente de riesgo moderado o alto siga con el tratamiento con AINEs.13
Ulcera idiopática: Las úlceras sin causa claramente identificable son susceptibles de reaparecer en pacientes que no son tratados con terapia supresora de ácidos. Las directrices no recomiendan claramente la duración del tratamiento de mantenimiento de los pacientes, pero sugieren que el tratamiento continuo con IBP reduce el riesgo de formación de úlceras recurrentes.13
Seguridad
Los IBP se consideran generalmente una clase de medicamentos bien tolerados.1 Sin embargo, su reputación se ha visto afectada durante mucho tiempo por varios problemas de seguridad, como el aumento del riesgo de diarrea asociada a Clostridium difficile, la neumonía adquirida en la comunidad y las fracturas óseas.15,16 Más recientemente, se ha planteado la preocupación por la demencia y la enfermedad renal crónica, y han continuado los debates sobre la hipomagnesemia y una teórica interacción farmacológica con el clopidogrel.
Demencia: Dos estudios recientes han sugerido la posibilidad de un aumento del riesgo de demencia con el uso de IBP a largo plazo en los ancianos.17,18 Un mecanismo propuesto detrás de este hallazgo es que los IBP promueven el desarrollo de placas beta-amiloides, una fisiopatología propuesta de la enfermedad de Alzheimer.15 Sin embargo, las limitaciones del estudio no apoyan una relación causal concluyente entre el uso de IBP y una mayor incidencia de demencia.19
Complicaciones renales: Aunque los IBP han sido ampliamente reconocidos como una causa común de nefritis intersticial aguda, los datos más recientes también implican a estos agentes en el desarrollo de otras complicaciones renales.15,20 Tres ensayos recientes han sugerido que los IBP pueden ser responsables de un mayor riesgo de enfermedad renal crónica y de progresión a enfermedad renal terminal.20-22 Sin embargo, estos estudios observacionales deben interpretarse con precaución, ya que la causalidad no puede ser confirmada.23
Hipomagnesemia: En 2011, la FDA emitió una advertencia de que el uso prolongado de IBP durante periodos superiores a 1 año puede dar lugar a hipomagnesemia.24 Desde entonces, varios estudios considerables han apoyado este hallazgo.25-29 Sin embargo, la relación entre los IBP y la hipomagnesemia no es definitiva y se complica por factores de riesgo externos.30-32 Actualmente, la hipomagnesemia clínicamente significativa inducida por los IBP se considera rara y ocurre más comúnmente con el uso concomitante de diuréticos.31,32 Se recomienda la monitorización sólo en pacientes con factores de riesgo adicionales.32
Interacción con Clopidogrel: El clopidogrel desempeña un papel importante en la reducción del riesgo cardiovascular, pero se asocia a hemorragias GI, especialmente en pacientes con mayor riesgo. La protección gastrointestinal con IBP suele aplicarse en pacientes que tienen más probabilidades de sufrir una hemorragia gastrointestinal, incluidos aquellos con una hemorragia gastrointestinal anterior; edad avanzada; uso simultáneo de anticoagulantes, corticosteroides o AINE (incluida la aspirina); y/o infección por H pylori.33
Se cree que los IBP inhiben la enzima CYP2C19, la vía principal por la que se activa el clopidogrel.33 Esta interacción puede teóricamente disminuir los efectos antiplaquetarios de clopidogrel y aumentar el riesgo de resultados cardiovasculares adversos.33 Sin embargo, basándose en resultados inconsistentes tanto de estudios farmacocinéticos como de ensayos de resultados, la importancia clínica de esta interacción es incierta.34
Además, hay una falta de consistencia en la evidencia con respecto al verdadero impacto de los IBP individuales sobre los efectos de clopidogrel.33 Las últimas recomendaciones de la FDA sugieren que el pantoprazol es una opción más segura que otros IBP, mientras que se cree que el omeprazol es el más arriesgado.35 Los datos actuales siguen apoyando esta conclusión, pero son necesarios estudios adicionales para confirmar si existe una diferencia entre los IBP.36
Es importante sopesar los beneficios y los riesgos del tratamiento antiplaquetario solo o en combinación con un IBP cuando se toma la decisión de añadir un tratamiento protector del tracto gastrointestinal. En los pacientes con alto riesgo de complicaciones GI, los efectos beneficiosos del tratamiento con IBP pueden ser mayores que la disminución de la eficacia del tratamiento antiplaquetario, que se demostró de forma inconsistente. Para los pacientes con menor riesgo de complicaciones gastrointestinales, un ARH2 puede ser una opción de tratamiento razonable, aunque esta clase ha demostrado ser menos eficaz que los IBP para esta indicación.33
Conclusión
Los farmacéuticos de todos los ámbitos pueden tener un profundo impacto en el uso inadecuado de los IBP asegurando el inicio y la continuación adecuados de la terapia, la dosificación y la duración del tratamiento. A medida que siguen apareciendo datos contradictorios sobre los perfiles de seguridad de estos medicamentos, el uso a largo plazo de los IBP se vuelve más complicado. Al asegurarse de que se utiliza la dosis más baja y adecuada durante la menor duración necesaria, los farmacéuticos pueden ayudar a prevenir la exposición innecesaria de los pacientes a posibles daños.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Sobreutilización de los inhibidores de la bomba de protones: lo que el clínico necesita saber. Therap Adv Gastroenterol. 2012;5:219-232.
2. Prospecto de Nexium (esomeprazol magnesio). Wilmington, DE: AstraZeneca Pharmaceuticals LP; diciembre de 2016.
3. Prospecto de esomeprazol estroncio. Glasgow, KY: Amneal Pharmaceuticals; diciembre de 2014.
4. Prospecto de Prevacid (lansoprazol). Deerfield, IL: Takeda Pharmaceuticals America, Inc; octubre de 2016.
5. Prospecto de Prilosec (omeprazol). Wilmington, DE: AstraZeneca Pharmaceuticals LP; diciembre de 2016.
6. Prospecto de Protonix (pantoprazol). Filadelfia, PA: Wyeth Pharmaceuticals Inc. Octubre de 2016.
7. Prospecto de AcipHex (rabeprazol). Woodcliff Lake, NJ: Eisai Inc; abril de 2016.
8. Chia CT, Lim WP, Vu CK. Uso inapropiado de los inhibidores de la bomba de protones en un entorno local. Singapore Med J. 2014;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. La prescripción inapropiada de inhibidores de la bomba de protones orales en el ámbito hospitalario: un estudio transversal prospectivo. Dig Dis Sci. 2015;60:2280-2286.
10. Katz PO, Gerson LB, Vela MF. Guías para el diagnóstico y manejo de la enfermedad por reflujo gastroesofágico. Am J Gastroenterol. 2013;108:308-328.
11. Comunicación de seguridad de medicamentos de la FDA: posible aumento del riesgo de fracturas de cadera, muñeca y columna vertebral con el uso de inhibidores de la bomba de protones. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Consultado el 17 de febrero de 2017.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. Guía clínica del ACG: tratamiento de la infección por Helicobacter pylori. Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Manejo de pacientes con hemorragia por úlcera. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Quigley EM. Directrices para la prevención de las complicaciones de las úlceras relacionadas con los AINE. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Proton pump inhibitors: risks of long-term use. J Gastroenterol Hepatol. 2017; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Informe de eventos adversos para la terapia de inhibidores de la bomba de protones: una visión general de las revisiones sistemáticas. Otolaryngol Head Neck Surg. 2016;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Riesgo de demencia en pacientes de edad avanzada con el uso de inhibidores de la bomba de protones. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Asociación de los inhibidores de la bomba de protones con el riesgo de demencia: un análisis de datos de reclamaciones farmacoepidemiológicas. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Los inhibidores de la bomba de protones aumentan el riesgo de demencia? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Los inhibidores de la bomba de protones se asocian a un mayor riesgo de desarrollo de enfermedad renal crónica. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Proton pump inhibitors and risk of incident CKD and progression to ESRD. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. Uso de inhibidores de la bomba de protones y el riesgo de enfermedad renal crónica. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Terapia: riesgos asociados al uso crónico de IBP ¿señal o ruido? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. Comunicación de Seguridad de Medicamentos de la FDA: los niveles bajos de magnesio pueden estar asociados con el uso a largo plazo de medicamentos inhibidores de la bomba de protones (IBP). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Consultado el 17 de febrero de 2017.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Inhibidores de la bomba de protones e hipomagnesemia en la población general: un estudio de cohortes basado en la población. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. La asociación entre el uso de inhibidores de la bomba de protones y el riesgo de hipomagnesemia: una revisión sistemática y meta-análisis. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Hughes JD. Hipomagnesemia asociada a inhibidores de la bomba de protones: ¿qué nos dicen los datos de la FDA? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Inhibidores de la bomba de protones vinculados a la hipomagnesemia: una revisión sistemática y meta-análisis de estudios observacionales. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. La asociación de los inhibidores de la bomba de protones y la hipomagnesemia en el ámbito comunitario. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Cambios en la concentración de magnesio sérico tras el uso de un inhibidor de la bomba de protones en pacientes sometidos a una intervención coronaria percutánea. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. El uso de inhibidores de la bomba de protones se asocia con bajas concentraciones de magnesio en suero. Kidney Int. 2013;83:692-699.
32. Begley J, Smith T, Barnett K, et al. Hipomagnesemia asociada a los inhibidores de la bomba de protones: ¿un motivo de preocupación? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. Documento de consenso de expertos ACCF/ACG/AHA 2010 sobre el uso concomitante de inhibidores de la bomba de protones y tienopiridinas: una actualización enfocada del documento de consenso de expertos ACCF/ACG/AHA 2008 sobre la reducción de los riesgos gastrointestinales de la terapia antiplaquetaria y el uso de AINE. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Resultados contradictorios entre ensayos aleatorios y estudios observacionales sobre el impacto de los inhibidores de la bomba de protones en los eventos cardiovasculares cuando se coadministran con la terapia antiplaquetaria dual: revisión sistemática. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. Recordatorio de la FDA para evitar el uso concomitante de Plavix (clopidogrel) y omeprazol. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Consultado el 17 de febrero de 2017.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. El uso concomitante de clopidogrel e inhibidores de la bomba de protones sigue asociado a un aumento de los resultados cardiovasculares adversos después de la angioplastia coronaria?: una revisión sistemática y un metaanálisis de los estudios publicados recientemente (2012-2016). BMC Cardiovasc Disord. 2017;17:3.