US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRACT: Protonpompremmers (PPI’s) zijn een klasse van antisecretoire middelen die worden gebruikt voor de behandeling van verschillende gastro-intestinale aandoeningen, zoals gastro-oesofageale refluxziekte, Helicobacter pylori-gerelateerde aandoeningen, en maag- en duodenale ulcera. Hoewel deze middelen effectieve zure-onderdrukkers zijn, wordt het gebruik van PPI’s vaak ter discussie gesteld op grond van meldingen van nieuwe potentiële bijwerkingen. Overmatig gebruik en interacties tussen geneesmiddelen zijn problemen die in verband worden gebracht met PPI’s. Aangezien verschillende PPI’s bovendien vrij verkrijgbaar zijn, is ongepast gebruik van deze middelen een belangrijk punt van zorg. Apothekers in alle settings kunnen een grote invloed hebben op het ongepast gebruik van PPI’s door te zorgen voor een juiste start en voortzetting van de therapie, dosering en behandelingsduur.
Protonpompremmers (PPI’s) zijn een klasse geneesmiddelen die vaak worden gebruikt voor de behandeling van verschillende gastro-intestinale (GI) aandoeningen, waaronder gastro-oesofageale refluxziekte (GERD), Helicobacter pylori-gerelateerde aandoeningen, en maag- en duodenale ulcera. Hoewel deze antisecretiemiddelen de voorkeursbehandeling zijn voor een groot aantal aandoeningen, wordt deze klasse geplaagd door overmatig gebruik en meldingen van mogelijk ernstige bijwerkingen en interacties tussen geneesmiddelen.1 Verder wordt de behandeling van patiënten met PPI’s bemoeilijkt doordat een aantal van deze middelen vrij verkrijgbaar is. Dit artikel wil de aandacht vestigen op het juiste gebruik en een op bewijs gebaseerde beschrijving geven van verschillende nieuwe of zwaar bediscussieerde nadelen van deze middelen.
Beschikbaarheid van PPI’s
Zes van de unieke PPI’s, waarvan er vijf generiek verkrijgbaar zijn, zijn op recept verkrijgbaar (TABEL 1).2-7 Lage doses omeprazol, lansoprazol en een merkversie van esomeprazol-magnesium zijn vrij verkrijgbaar. Omeprazol wordt ook gebruikt in een coformuleringsproduct met natriumbicarbonaat. Dit artikel zal zich voornamelijk richten op generiek verkrijgbare, oraal gedoseerde PPI’s.
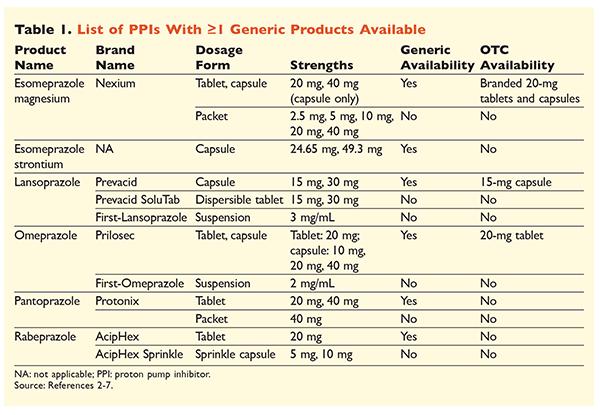
Esomeprazol strontium is door de FDA goedgekeurd op basis van zijn bio-equivalentie met esomeprazol magnesium.3 Hoewel de productetikettering voor deze twee middelen sterk op elkaar lijkt, bestaan er drie opmerkelijke verschillen. Ten eerste is esomeprazol strontium verkrijgbaar in capsules van 24,65 mg en 49,3 mg, die gelijkwaardig zijn aan esomeprazol magnesium van respectievelijk 20 mg en 40 mg. Ten tweede is esomeprazol strontium niet door de FDA goedgekeurd voor gebruik bij pediatrische patiënten, terwijl esomeprazol magnesium is goedgekeurd voor gebruik bij patiënten van 1 maand en ouder. Ten slotte dient het gebruik van esomeprazol strontium te worden vermeden bij ernstige nierinsufficiëntie omdat het niet bij deze populatie is onderzocht. Voor esomeprazol-magnesium wordt geen doseringsaanpassing aanbevolen.3 In dit artikel zal de term esomeprazol worden gebruikt om esomeprazol-magnesium aan te duiden.
Toediening
Alle generiek verkrijgbare PPI’s, met inbegrip van capsules en tabletten, moeten in hun geheel worden doorgeslikt zonder te worden gesplitst, fijngemaakt of gekauwd.2-7 Omeprazol, lansoprazol en esomeprazol capsules kunnen worden geopend en de inhoud kan over appelmoes worden gesprenkeld voor patiënten die niet in staat zijn orale toedieningsvormen door te slikken. Daarnaast mogen lansoprazolcapsules in 2 oz. appel-, tomaten- of sinaasappelsap worden gesprenkeld. Alle mengsels met de inhoud van geopende capsules dienen onmiddellijk te worden doorgeslikt en mogen niet worden bewaard voor toekomstig gebruik.2,4,5
Lansoprazol, omeprazol en esomeprazol dienen voor de maaltijd te worden toegediend, maar specifieke aanbevelingen voor toedieningstijden variëren. Omeprazol moet 30 tot 60 minuten voor de maaltijd worden toegediend en esomeprazol ten minste 60 minuten van tevoren; voor lansoprazol is geen tijdschema gespecificeerd.2,4,5 Pantoprazol kan met of zonder voedsel worden toegediend.6 Rabeprazol moet na de maaltijd worden ingenomen voor duodenale ulcera en met een maaltijd voor H pylori-eradicatie; voor alle andere indicaties kan rabeprazol met of zonder voedsel worden ingenomen.7
Dosering en duur van de therapie
Gezien de reputatie van PPI’s als zeer effectief en over het algemeen veilig, is een aanzienlijk overgebruik van PPI’s een groot probleem.1 Niet alleen worden PPI’s vaak toegediend voor indicaties zonder dat het gebruik ervan is aangetoond, maar deze geneesmiddelen worden ook vaak voorgeschreven in hogere doses dan nodig is voor een behandelingsduur die langer is dan aanbevolen.8,9 De goedgekeurde dosering van elke PPI en de aanbevolen duur van de behandeling staan vermeld in de tabellen 2 en 3. Behandelingsaanbevelingen die afwijken van de door de FDA goedgekeurde aanbevelingen, evenals belangrijke klinische parels met betrekking tot de start, dosering en duur van de behandeling met PPI’s, worden hieronder beschreven.
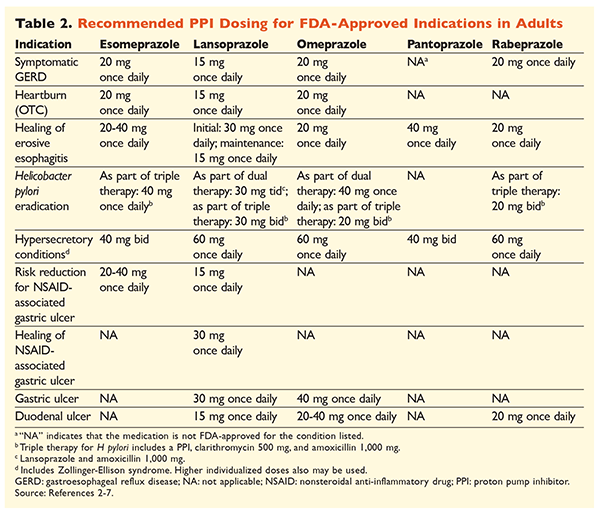
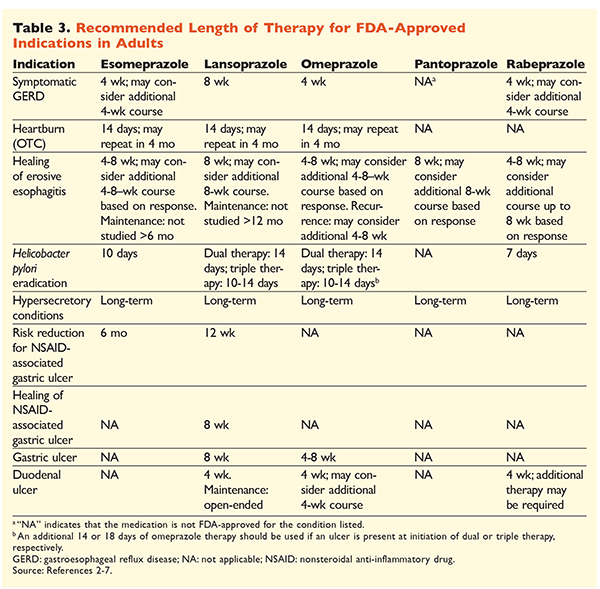
GERD: Bij patiënten met GERD worden alle PPI’s als even effectief beschouwd en wordt een kuur van 8 weken met elk beschikbaar middel aanbevolen.10 Patiënten bij wie de symptomen na 2 tot 3 maanden niet werken, hebben mogelijk een langdurige onderhoudstherapie met tweemaal daagse doses nodig. De laagste effectieve dosis moet echter worden gebruikt, en als de patiënt niet op de therapie reageert, moet een andere PPI worden overwogen.10 Als alternatief kan een zo nodig aangepaste PPI-therapie of een stapsgewijze aanpak met een histamine2-receptorantagonist (H2RA) worden overwogen.10 Behandeling met een OTC-PPI moet beperkt blijven tot 14 dagen, en herbehandeling mag niet vaker dan elke 4 maanden plaatsvinden.11
H pylori-Associatiezweren: Afhankelijk van de PPI die wordt gebruikt, omvatten de door de FDA goedgekeurde behandelingsschema’s voor de uitroeiing van H pylori dubbele therapie met amoxicilline of claritromycine en drievoudige therapie met beide middelen gedurende 7 tot 14 dagen.2-5,7 Specifieke door de richtlijnen ondersteunde behandelingsschema’s variëren in vergelijking met de door de FDA goedgekeurde schema’s, maar de aanbevolen duur van de therapie is vergelijkbaar, waarbij alle schema’s een doseringsduur van 10 tot 14 dagen hebben.12 Na eradicatie van H pylori is onderhoudstherapie met PPI’s niet nodig.13 Een meer gedetailleerde bespreking van specifieke regimes valt buiten het bestek van dit artikel.
Prophylaxis and Treatment of NSAID-Induced Ulcers: Na het ontstaan van een ulcus als gevolg van een niet-steroïdaal anti-inflammatoir geneesmiddel (NSAID), moet de noodzaak van NSAID-therapie opnieuw worden beoordeeld. Als voortzetting van de NSAID-therapie nodig wordt geacht, moeten patiënten selectieve cyclo-oxygenase-2-therapie blijven krijgen in de laagste effectieve dosis en voor de kortst mogelijke duur, in combinatie met een PPI.13
Voor profylaxe wordt het initiëren van een PPI alleen aanbevolen bij patiënten met een matig of hoog risico op NSAID-gerelateerde gastro-intestinale toxiciteit. Risicofactoren zijn leeftijd >65 jaar, NSAID-therapie met hoge doses, een eerdere voorgeschiedenis van een ongecompliceerd ulcus, en gelijktijdig gebruik van aspirine (inclusief lage doses), corticosteroïden, of anticoagulantia. Patiënten met een matig risico op NSAID-geïnduceerde gastro-intestinale toxiciteit zijn patiënten met één of twee van deze risicofactoren, terwijl patiënten met een hoog risico meer dan twee risicofactoren hebben of een voorgeschiedenis van een eerder gecompliceerd peptisch ulcus, vooral als dat recent was.14 Het is redelijk om PPI-therapie voort te zetten zolang de patiënt met een matig of hoog risico NSAID-therapie blijft gebruiken.13
Idiopathisch ulcus: Ulcera zonder duidelijk aanwijsbare oorzaak zullen waarschijnlijk terugkomen bij patiënten die niet behandeld worden met zuuronderdrukkende therapie. De richtlijnen geven geen duidelijke aanbeveling voor de duur van de onderhoudsbehandeling, maar suggereren dat voortdurende PPI-therapie het risico op recidiverende ulcusvorming vermindert.13
Veiligheid
PPI’s worden over het algemeen beschouwd als een goed verdraagbare klasse van geneesmiddelen.1 Hun reputatie wordt echter al lange tijd geplaagd door bezorgdheid over de veiligheid, waaronder een verhoogd risico op Clostridium difficile-geassocieerde diarree, community-acquired pneumonie en botbreuken.15,16 Meer recentelijk is bezorgdheid geuit over dementie en chronische nieraandoeningen, en de discussie over hypomagnesemie en een theoretische geneesmiddel-geneesmiddelinteractie met clopidogrel is voortgezet.
Dementie: Twee recente studies suggereren een mogelijk verhoogd risico op dementie bij langdurig PPI-gebruik bij ouderen.17,18 Een voorgesteld mechanisme achter deze bevinding is dat PPI’s de ontwikkeling van bèta-amyloïde plaques bevorderen, een voorgestelde pathofysiologie van de ziekte van Alzheimer.15 Beperkingen in de studie ondersteunen echter geen sluitend oorzakelijk verband tussen PPI-gebruik en een verhoogde incidentie van dementie.19
Niercomplicaties: Hoewel PPI’s algemeen erkend zijn als een veel voorkomende oorzaak van acute interstitiële nefritis, wijzen nieuwere gegevens ook op de betrokkenheid van deze middelen bij de ontwikkeling van andere niercomplicaties.15,20 Drie recente onderzoeken hebben gesuggereerd dat PPI’s verantwoordelijk kunnen zijn voor een verhoogd risico op chronische nierziekte en progressie naar nierziekte in het eindstadium.20-22 Deze observationele studies moeten echter met voorzichtigheid worden geïnterpreteerd, omdat causaliteit niet kan worden bevestigd.23
Hypomagnesemie: In 2011 heeft de FDA gewaarschuwd dat langdurig gebruik van PPI’s langer dan een jaar kan leiden tot hypomagnesemie.24 Sindsdien hebben diverse omvangrijke studies deze bevinding ondersteund.25-29 De relatie tussen PPI’s en hypomagnesemie is echter niet definitief en wordt bemoeilijkt door externe risicofactoren.30-32 Momenteel wordt klinisch significante, door PPI’s geïnduceerde hypomagnesemie als zeldzaam beschouwd en komt het vaker voor bij gelijktijdig gebruik van diuretica.31,32 Monitoring wordt alleen aanbevolen bij patiënten met bijkomende risicofactoren.32
Gedragsinteractie met Clopidogrel: Clopidogrel speelt een belangrijke rol bij cardiovasculaire risicovermindering, maar wordt geassocieerd met gastro-intestinale bloedingen, vooral bij patiënten met een verhoogd risico. GI-bescherming met PPI’s wordt vaak toegepast bij patiënten bij wie de kans op een GI-bloeding groter is, waaronder patiënten met een eerdere bloeding in het bovenste gedeelte van de GI; gevorderde leeftijd; gelijktijdig gebruik van anticoagulantia, corticosteroïden of NSAID’s (waaronder aspirine); en/of H pylori-infectie.33
Van PPI’s wordt gedacht dat ze het CYP2C19-enzym remmen, de primaire route via welke clopidogrel wordt geactiveerd.33 Deze interactie kan theoretisch de antiplaatjeswerking van clopidogrel verminderen en het risico op ongunstige cardiovasculaire uitkomsten verhogen.33 Op basis van inconsistente resultaten van zowel farmacokinetische studies als uitkomstenonderzoeken is de klinische betekenis van deze interactie echter onzeker.34
Verder is er een gebrek aan consistentie in bewijs met betrekking tot de werkelijke invloed van individuele PPI’s op de effecten van clopidogrel.33 De meest recente aanbevelingen van de FDA suggereren dat pantoprazol een veiligere keuze is dan andere PPI’s, terwijl omeprazol het meest risicovol zou zijn.35 De huidige gegevens blijven deze conclusie ondersteunen, maar aanvullende studies zijn nodig om te bevestigen of er een verschil tussen PPI’s bestaat.36
Het is belangrijk om de voordelen en risico’s van antiplatelettherapie alleen of in combinatie met een PPI tegen elkaar af te wegen wanneer een beslissing wordt genomen over het toevoegen van GI-beschermende therapie. Bij patiënten met een hoog risico op GI-complicaties kunnen de gunstige effecten van PPI-therapie groter zijn dan de verminderde effectiviteit van antiplatelettherapie, wat inconsistent is aangetoond. Voor patiënten met een lager risico op GI-complicaties kan een H2RA een redelijke behandelingsoptie zijn, hoewel is aangetoond dat deze klasse voor deze indicatie minder effectief is dan PPI’s.33
Conclusie
Pharmaceuten in alle settings kunnen een grote invloed hebben op ongepast PPI-gebruik door te zorgen voor een juiste start en voortzetting van de therapie, dosering en behandelingsduur. Aangezien er tegenstrijdige gegevens blijven verschijnen over de veiligheidsprofielen van deze geneesmiddelen, wordt het langdurig gebruik van PPI’s ingewikkelder. Door ervoor te zorgen dat de laagste geschikte dosis wordt gebruikt voor de kortst mogelijke duur die nodig is, kunnen apothekers helpen voorkomen dat patiënten onnodig worden blootgesteld aan potentiële schade.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Overutilization of proton-pump inhibitors: what the clinician needs to know. Therap Adv Gastroenterol. 2012;5:219-232.
2. Nexium (esomeprazol magnesium) bijsluiter. Wilmington, DE: AstraZeneca Pharmaceuticals LP; december 2016.
3. Esomeprazol strontium bijsluiter. Glasgow, KY: Amneal Pharmaceuticals; december 2014.
4. Prevacid (lansoprazol) bijsluiter. Deerfield, IL: Takeda Pharmaceuticals America, Inc; oktober 2016.
5. Prilosec (omeprazol) bijsluiter. Wilmington, DE: AstraZeneca Pharmaceuticals LP; december 2016.
6. Protonix (pantoprazol) bijsluiter. Philadelphia, PA: Wyeth Pharmaceuticals Inc. Oktober 2016.
7. AcipHex (rabeprazol) bijsluiter. Woodcliff Lake, NJ: Eisai Inc; April 2016.
8. Chia CT, Lim WP, Vu CK. Ongepast gebruik van protonpompremmers in een lokale setting. Singapore Med J. 2014;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. Het ongepast voorschrijven van orale protonpompremmers in de ziekenhuissetting: een prospectieve cross-sectionele studie. Dig Dis Sci. 2015;60:2280-2286.
10. Katz PO, Gerson LB, Vela MF. Richtlijnen voor de diagnose en behandeling van gastro-oesofageale refluxziekte. Am J Gastroenterol. 2013;108:308-328.
11. FDA Drug Safety Communication: possible increased risk of fractures of the hip, wrist, and spine with the use of proton pump inhibitors. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Accessed February 17, 2017.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG klinische richtlijn: behandeling van Helicobacter pylori infectie. Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Management van patiënten met ulcusbloedingen. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Quigley EM. Richtlijnen voor preventie van NSAID-gerelateerde ulcuscomplicaties. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Protonpompremmers: risico’s van langdurig gebruik. J Gastroenterol Hepatol. 2017; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Adverse event reporting for proton pump inhibitor therapy: an overview of systematic reviews. Otolaryngol Head Neck Surg. 2016;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Risico op dementie bij oudere patiënten met het gebruik van protonpompremmers. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Associatie van protonpompremmers met risico op dementie: een farmaco-epidemiologische claims data analyse. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Verhogen protonpompremmers het risico op dementie? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Protonpompremmers zijn geassocieerd met verhoogd risico op ontwikkeling van chronische nierziekte. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Protonpompremmers en risico op incident CKD en progressie naar ESRD. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. Protonpompremmergebruik en het risico op chronische nierziekte. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Therapie: risico’s geassocieerd met chronisch PPI-gebruik-signaal of ruis? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. FDA Drug Safety Communication: lage magnesiumspiegels kunnen geassocieerd zijn met langdurig gebruik van protonpompremmers (PPI’s). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Accessed February 17, 2017.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Proton pump inhibitors and hypomagnesemia in the general population: a population-based cohort study. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. De associatie tussen het gebruik van protonpompremmers en het risico op hypomagnesemie: een systematische review en meta-analyse. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Hughes JD. Protonpompremmer-geassocieerde hypomagnesemie: wat vertellen FDA-gegevens ons? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta-analysis of observational studies. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. The association of proton pump inhibitors and hypomagnesemia in the community setting. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Changes in serum magnesium concentration after use of a proton pump inhibitor in patients undergoing percutaneous coronary intervention. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. Protonpompremmergebruik is geassocieerd met lage serum magnesiumconcentraties. Kidney Int. 2013;83:692-699.
32. Begley J, Smith T, Barnett K, et al. Proton pump inhibitor associated hypomagnesaemia-a cause for concern? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Conflicting results between randomized trials and observational studies on the impact of proton pump inhibitors on cardiovascular events when coadministered with dual antiplatelet therapy: systematic review. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. FDA-herinnering om gelijktijdig gebruik van Plavix (clopidogrel) en omeprazol te vermijden. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Accessed February 17, 2017.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. Is het gelijktijdig gebruik van clopidogrel en protonpompremmers nog steeds geassocieerd met verhoogde nadelige cardiovasculaire uitkomsten na coronaire angioplastiek?: een systematische review en meta-analyse van recent gepubliceerde studies (2012-2016). BMC Cardiovasc Disord. 2017;17:3.