Download this issue Back to summary
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
Ablação endovenosa a laser (EVLA) é uma alternativa menos invasiva à remoção de veias. Os resultados parecem ser iguais ou melhores que os obtidos com o stripping, com melhor qualidade de vida no período pós-operatório. A EVLA demonstrou corrigir ou melhorar significativamente a anormalidade hemodinâmica em pacientes com insuficiência venosa crônica (IVC) com refluxo venoso superficial. Relatos iniciais sugerem que as técnicas de ablação endovenosa, ao contrário do stripping cirúrgico, estão associadas a uma baixa incidência de neovascularização.
Uma variedade de comprimentos de onda está sendo usada para realizar a EVLA. Enquanto o cromóforo inicial é água ou hemoglobina, dependendo do comprimento de onda utilizado, o carbono parece ser um cromóforo secundário, mas chave que provavelmente é independente do comprimento de onda.
A aplicação dos princípios da anestesia tumescente aos tratamentos venosos, juntamente com o desenvolvimento de técnicas de ablação endovenosa, oferecem a possibilidade de tratar a grande maioria dos pacientes com varizes no consultório sem anestesia geral ou incisões cirúrgicas, ao mesmo tempo em que maximizam os resultados e minimizam as recidivas.
INTRODUÇÃO
Refluxo da veia safena é a anormalidade primária subjacente na maioria dos casos de insuficiência venosa superficial. Assim, abordagens para lidar com a junção safenofemoral e a incompetência truncal safena têm dominado o pensamento dos flebólogos. Trendelenburg descreveu a ligação da junção safenofemoral sozinha, sem o desnudamento da veia safena incompetente, na década de 1890. As vantagens da ligadura por si só sobre a ligadura e o stripping, que ainda hoje são exaltadas1 , incluem a preservação do tronco de safena para possível utilização futura como enxerto de bypass2 e evitar lesão do nervo safeno.3 A ligadura alta por si só é menos invasiva, mais rápida e mais simples de realizar e associada a uma recuperação mais fácil quando comparada ao stripping de veia. Embora seja verdade que rotineiramente “poupa” o tronco de safena4 , o uso de uma veia safena doente como conduto tem sido associado a um risco maior de falha do enxerto.5 Mais importante, não há mais dúvidas de que a ligadura alta por si só geralmente resulta em refluxo persistente no tronco de safena.6,7 A recorrência da varizes é significativamente reduzida7-9 e a taxa de reoperação é 60% a 70% menor se a veia safena for retirada em comparação com a ligadura por si só.10,11 Também, após a ligadura isolada, foi encontrada recorrência ou comunicação residual com a junção na virilha em 80% dos pacientes, enquanto 34% também apresentavam incompetência de perfurações médias da veia safena magna (VSG).12 Como concluiu Neglen, a remoção do VSG da coxa é essencial para minimizar a recorrência que é causada pelo re-desenvolvimento da comunicação incompetente com a confluência safenafemoral, e devido à incompetência de perfurações da coxa.13 Simplificando, as deficiências da ligadura por si só superam suas vantagens.
É importante notar que a recorrência é comum mesmo após a ligadura e o desnudamento da veia safena. Enquanto a cirurgia inadequada da junção safenafemoral e a progressão da doença são mecanismos que explicam alguns casos de recidiva, outro mecanismo importante é a neovascularização em torno da junção após cirurgia venosa.11,14 De fato, a neovascularização tem sido relatada como a principal causa de recidiva,9 com canais neovasculares de tamanho, número e tortuosidade variáveis responsáveis pelo refluxo para as varizes recorrentes na maioria dos casos.15 Embora alguns tenham expressado dúvidas quanto à veracidade da verdadeira neovascularização, há evidências histológicas claras de que a neovascularização é uma causa de varizes recorrentes.16 Relatos iniciais sugerem, ao contrário, que as técnicas de ablação endovenosa estão associadas a uma incidência muito baixa de neovascularização. Pode ser que o desenvolvimento da neovascularização seja amplamente prevenido evitando a dissecção da virilha e preservando a drenagem venosa em tributários juncionais normais.18,19
EVLA, como a ablação por radiofreqüência e a escleroterapia com espuma, é uma alternativa menos invasiva ao esvaziamento das veias. A EVLA é indicada em um paciente ambulatorial com grande, pequeno ou acessório refluxo de veia safena com varizes superficiais e/ou sintomas ou complicações relacionadas à insuficiência venosa superficial. A EVLA é realizada rotineiramente usando anestesia local diluída, com ou sem ansiolíticos orais suplementares, em um ambiente de consultório. Geralmente levando de 30 a 60 minutos para realizar, o tempo do procedimento depende da extensão do segmento tratado, da experiência do operador e se procedimentos auxiliares, como a flebectomia ambulatorial, são realizados. Independentemente de como a insuficiência safena subjacente é tratada, tratamentos auxiliares são tipicamente necessários para tratar varizes residuais (Figura 1).
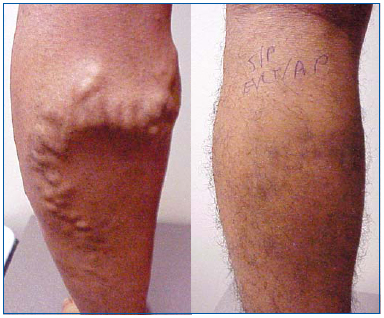
Figure 1. 26 anos antes e 1 mês após a ablação endovenosa a laser da veia safena magna e flebectomia ambulatorial de tributários varicosos.
EFFICACIA
Estudos de HOR e médio prazo de EVLA, independentemente do comprimento de onda utilizado, parecem notavelmente consistentes, tipicamente relatando ablação das veias safenas refluxantes em 90% ou mais dos casos.18,20-23 A EVLA da veia safena mostrou corrigir ou melhorar significativamente a anormalidade hemodinâmica e os sintomas clínicos de insuficiência venosa crônica (IVC) em pacientes de classe clínica, etiológica, anatômica, fisiopatológica (CEAP) 3-6 com refluxo venoso superficial.24,25 Os resultados parecem ser iguais ou melhores que os do stripping, com melhores escores de qualidade de vida no pós-operatório em comparação com o stripping.20,25-27 Foram relatados altos índices de satisfação dos pacientes.18,28,29 O custo total (custo do procedimento mais custo social) dos procedimentos endovenosos é provavelmente igual ou inferior ao da cirurgia.27
Dados precoces sobre o tratamento do GSV com dispositivos de 810 nm e 940 nm sugerem que o fracasso do tratamento é incomum em pacientes tratados com > 70 J/cm.30,31 Uma taxa de retirada de 2 mm/seg a 14 watts fornece 70 J/cm.
MECANISMO DE AÇÃO
Os seguintes comprimentos de onda estão em uso corrente para EVLA: 810, 940, 980, 1064, 1319, 1320, e 2068 nm. Tem sido postulado que a lesão da parede da veia é mediada tanto por efeito direto quanto indiretamente através de vapor induzido por laser gerado pelo aquecimento de pequenas quantidades de sangue dentro da veia.32 Alguns têm sugerido que a escolha do comprimento de onda tem grande impacto nos resultados.23
O cromóforo principal dos lasers de 1320 e 2078 nm, pelo menos inicialmente, é água, enquanto outros comprimentos de onda usados para EVLA são principalmente a hemoglobina alvo. Obviamente é imperativo danificar termicamente a parede da veia de forma adequada para obter uma ablação eficaz. Algum aquecimento pode ocorrer por absorção direta de energia fotônica (radiação) pela parede da veia, bem como por convecção de bolhas de vapor e condução do sangue aquecido. No entanto, é improvável que estes últimos mecanismos representem a maioria do impacto sobre a veia. A temperatura máxima do sangue é de 100°C. O tratamento com laser produz carbonização da parede da veia.33 A carbonização da ponta do laser, que ocorre a cerca de 300°C, é observada após EVLA, e parece ocorrer independentemente do comprimento de onda utilizado.34 A carbonização da ponta da fibra laser cria uma fonte de calor pontual e essencialmente reduz a penetração da luz no tecido a zero.34,35 Mordon et al afirmaram “O vapor produzido pela absorção da energia do laser pelo sangue é uma pequena fração da energia necessária para danificar a parede da veia e não pode ser o mecanismo primário de lesão da veia com laser endovenoso. A carbonização e o trato dentro das paredes venosas vistas pela histologia após o laser endovenoso só pode ser o resultado do contato direto entre a ponta da fibra laser e a parede da veia”.36 A Dra. Rox Anderson, diretora do Wellman Center for Photomedicine do Massachusetts General Hospital, relatou que o carbono parece ser um cromóforo secundário mas chave que provavelmente é independente do comprimento de onda (Figura 2).34 Note que a ponta e a forma da fibra podem impactar o desenvolvimento da carbonização.37

Figure 2. Carbonização da ponta de fibra laser de 600 mícrons secundária à ablação endovenosa por laser de 1320 nm (Foto cortesia de Mark Forrestal, MD, FACPh).
AnESTESIA TUMESCENTAL
EVLA deve ser realizada sob anestesia local usando grandes volumes de solução diluída de lidocaína e epinefrina (volume médio de 200-400 mL de lidocaína 0,1% com 1:1.000.000 epinefrina) que é tamponada com bicarbonato de sódio. Esta solução deve ser fornecida manualmente ou com uma bomba de infusão sob orientação de ultra-som para que a veia seja circundada com o líquido anestésico ao longo de todo o comprimento do segmento a ser tratado (Figura 3).
Os benefícios da anestesia tumescente para ablação endovenosa incluem:
– anestesia,
– separação da veia a ser tratada das estruturas circunvizinhas,
– lavatório térmico, que reduz os picos de temperatura nos tecidos perenes,
– compressão da veia, que maximiza o efeito do tratamento na parede da veia.
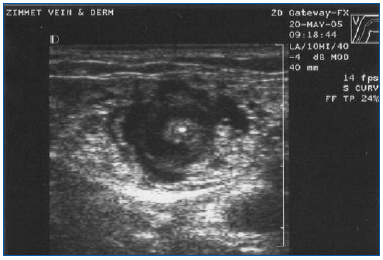
Figure 3. Imagem ultra-sonográfica transversal do líquido anestésico tumescente que envolve a veia safena magna e a fibra/bacia laser.
Embora a dosagem máxima segura de lidocaína utilizando a técnica de lipoaspiração não esteja bem estudada, uma dosagem de 35 mg/kg é uma estimativa razoável.
Usando estes parâmetros, a anestesia tumescente no contexto da lipoaspiração tem se mostrado extraordinariamente segura. Mais informações estão disponíveis em http://www.liposuction.com/pharmacology/drug_inter act.php.
CONTRAINDICATIONS TO EVLA
Contraindicações para a técnica EVLA estão disponíveis na Tabela I.

Tabela I. Contra-indicações para o laser endovenoso.
>
ADVERSE SEQUELAE
Dores e equimoses de termo-pesado têm sido comumente observados após EVLA. A Pullback de fibra laser pulsada intermitente tem sido relatada, em uma revisão retrospectiva, para causar níveis significativamente maiores de dor e equimoses pós-operatórias, em comparação com um protocolo de pullback contínuo.38 A adição de um curativo de curta duração por 3 dias após o modo EVLA intermitente reduziu substancialmente as equimoses e equimoses relatadas pelo paciente. O emprego de pullback de modo contínuo reduziu ainda mais a gravidade da dor e hematomas de tal forma que os níveis foram semelhantes aos relatados pelos pacientes tratados com ablação por radiofrequência (Tabelas II e III). Relatos preliminares sugerem que pode haver algumas diferenças no curso pós-operatório dependendo do comprimento de onda utilizado para realizar EVLA.22,39 Entretanto, isto é baseado em dados escassos com acompanhamento a curto prazo.
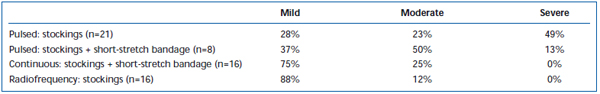
Tabela II. Hematomas pós-cirúrgicos com classificação de pacientes 3-7 dias após a ablação por laser endovenoso pulsado (EVLA) com meias classe II, EVLA pulsado com meias mais atadura de estiramento curto, EVLA modo contínuo com meias e atadura de estiramento curto e ablação por radiofreqüência com meias.
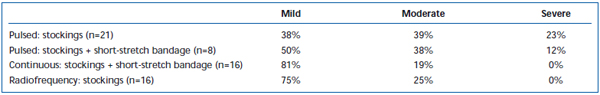
Tabela III. Dor pós-operatória avaliada pelo paciente 3-7 dias após a ablação por laser endovenoso pulsado (EVLA) com meias classe II, EVLA pulsada com meias e atadura de curto-estiramento, EVLA de modo contínuo com meias e atadura de curto-estiramento e ablação por radiofrequência com meias.
PERIVENOUS THERMAL INJURY
Mean pico de temperatura intravascular durante EVLA (veia jugular de cabra, 12 watts, pulsos de 1 segundo, intervalos de 1 segundo), medido à altura da ponta do laser, com média de 729°C, enquanto que aqueles 4 mm distal à ponta tiveram média de 93°C.40 Entretanto, o risco de lesão térmica colateral depende do aquecimento do tecido perivenoso e não da temperatura intravascular.
Colágeno foi observado para se contrair a cerca de 50°C, enquanto necrose ocorre entre 70°C e 100°C.41 A extensão da lesão térmica do tecido é fortemente dependente da quantidade e duração do calor ao qual o tecido é exposto. Henriques e Moritz investigaram a resposta tempo-temperatura para tecidos expostos a até 70°C.42 Eles descobriram que a pele poderia suportar aumentos de temperatura por tempos de exposição muito curtos, e que a resposta parece ser logarítmica à medida que os tempos de exposição se tornam mais curtos. Por exemplo, um aumento da temperatura corporal para 58°C produzirá destruição celular se a exposição for superior a 10 segundos. Os tecidos, contudo, podem suportar temperaturas até 70°C se a duração da exposição for mantida por menos de 1 segundo. Li et al relataram que o aquecimento das células endoteliais a 48°C por 10 minutos não induziu a morte celular.43 Também descobriram que os osteoblastos, após exposição por 10 minutos ou menos a 45°C, sofreram alterações transitórias e reversíveis. Outro estudo encontrou danos reversíveis do tecido no membro posterior de ratos após submersão em um banho de água a 44°C.44
Um estudo recente mediu a temperatura de pico na parede externa da veia durante o EVLA em uma veia orelha de porco viva e em veias expostas do membro posterior.45 As configurações da EVLA variaram de 8 watts (durações de pulso de 1-2 segundos), 10 watts (duração de pulso de 1-1,5 segundos), 12 watts (duração de pulso de 0,5-1,5 segundos) a 15 watts (duração de pulso de 0,5-1,0 segundos), com e sem anestesia tumescente. Os resultados demonstram que as temperaturas de pico variaram de 34,6°C a 49,1°C em função dos joules fornecidos, com temperaturas de pico mais baixas obtidas quando o fluido tumescente estava presente (Figura 4).
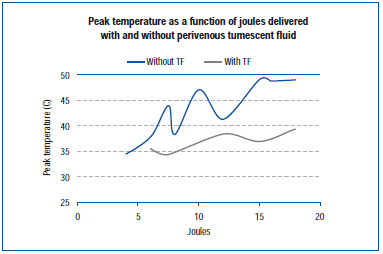
Figure 4. Adaptado de Zimmet SE, Min RJ. Alterações de temperatura no tecido perivenoso durante o tratamento com laser endovenoso em um modelo suíno. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
Temperatura de pico medida durante EVLA (63 pacientes, 980 nm, 15 watts, pulsos de 1,5 s) na parede externa da veia em humanos, 3 cm abaixo da junção safenofemoral, foi de 40,9°C e 49,8°C com e sem líquido tumescente, respectivamente.46 Resultados semelhantes foram relatados em outro estudo humano durante a EVLA (12 pacientes, 810 nm, 12 W, pulsos de 1 segundo, intervalos de 1 segundo, técnica tumescente), com temperaturas de pico de 43,3°C, 42,0°C e 36,0°C a 3 mm, 5 mm e 10 mm do GSV, respectivamente. 47
Parece haver uma queda muito rápida na temperatura em curtas distâncias durante o EVLA. Isto é provavelmente em contraste com a energia de radiofrequência onde o aquecimento por microondas ocorre ao redor da interface tecido-eletrodo. Os dados animais e humanos sugerem que o pico das temperaturas perenes geradas durante o laser endovenoso é pouco provável que cause danos permanentes aos tecidos perenes na maioria das situações. O pico de temperatura gerado é reduzido com o uso de líquido tumescente perivenoso. Estes achados parecem explicar a incidência muito baixa relatada de lesão nervosa e queimaduras cutâneas após a EVLA. Um estudo, usando um laser YAG de 1064 nm Nd: YAG, relatou uma incidência muito alta de parestesias em 36,5% e queimaduras cutâneas em 4,8%.48 Deve-se notar que a quantidade de energia fornecida foi cerca de três vezes maior do que a normalmente usada e que o tratamento foi feito sem anestesia tumescente. Apesar das baixas temperaturas perivenosas relatadas com EVLA, é importante notar que é necessário cuidado especial ao considerar a intervenção endovenosa em certos casos, como as varizes do nervo ciático.49,50
MAJOR COMPLICAÇÕES
Complicações maiores após EVLA têm sido relatadas raramente. Taxas de trombose venosa profunda (TVP), combinadas de múltiplas séries, são muito inferiores a 1%.17,18,20,28 Um grupo relatou uma incidência de extensão do trombo na veia femoral de 7,7%.51 Entretanto, nesse estudo a EVLA foi feita sob anestesia geral ou raquianestesia. O fato de os pacientes não terem sido capazes de ambular imediatamente no pós-operatório pode ter contribuído para a alta incidência de extensão do trombo. Há um único relato de uma fístula arteriovenosa que se desenvolveu após a EVLA da veia safena curta (VSF).52 Um paciente desenvolveu tromboflebite séptica após EVLA combinada com ligadura aberta de perfuradores e flebectomia com facada.53 Isto foi resolvido com tratamento antibiótico e desbridamento.
APPROACHES ALTERNATIVAS
EVLA e ablação por radiofrequência (RFA)54,55 ambos parecem ser tratamentos eficazes para a incompetência safena. As vantagens da EVLA sobre a RFA incluem tempos de procedimento mais curtos e custo mais baixo por tratamento. As taxas de oclusão relatadas de EVLA geralmente são ligeiramente mais altas do que as obtidas com RFA.56 As desvantagens da EVLA podem incluir mais hematomas e desconforto no período pós-operatório precoce, embora isso possa ser dependente da técnica. Ambas as técnicas continuam a ser refinadas, o que irá melhorar os resultados. Ambos os procedimentos, quando realizados com anestesia tumescente, estão associados a baixas taxas de complicações.
Um outro tratamento emergente para o refluxo de safena é o uso de esclerógenos espumosos administrados sob controle de ultra-som. Um gás, como o ar ou CO2, pode ser misturado com esclerosantes líquidos detergentes para criar espuma, estimada em cerca de quatro vezes mais potente do que a forma líquida do mesmo agente. Os primeiros resultados sugerem que esta pode ser uma modalidade valiosa, uma vez que é rápida e barata de executar com taxas de sucesso relatadas a curto e médio prazo de cerca de 75% a 90%. Há muitas variáveis relativas à espuma (por exemplo, tipo e quantidade de gás, técnica usada para criar espuma, concentração e tipo de esclerosante usado, volume injetado, etc.). Pode haver um risco maior de trombose venosa profunda após a escleroterapia com espuma, em comparação com a escleroterapia padrão. Uma técnica adequada é importante para minimizar o risco desta complicação. Outros efeitos secundários relatados após a escleroterapia com espuma incluem eventos visuais e neurológicos. Há um relato publicado de acidente vascular cerebral após escleroterapia com espuma (20 mL de espuma polidocanol) em um paciente com um forame oval patenteado de 1,8 cm.57 Mais experiências e pesquisas com esta modalidade irão delinear melhor seus riscos, assim como a eficácia a longo prazo.
CONCLUSÃO
Princípios atualmente aceitos de tratamento de varizes servem para maximizar os resultados do ponto de vista hemodinâmico e do paciente, enquanto minimiza o risco de recorrência. O tratamento adequado das varizes começa com uma avaliação precisa da patologia venosa subjacente e a identificação das fontes de hipertensão venosa. Os objetivos do tratamento incluem a eliminação das conexões incompetentes entre os sistemas profundo e superficial, bem como a obliteração das vias de incompetência venosa e das veias varicosas incompetentes. É evidente que a recorrência é reduzida se o segmento incompetente do tronco de safena for ablacionado.
Ablação endovenosa a laser é uma alternativa menos invasiva à remoção das veias. Os resultados parecem ser iguais ou melhores do que os do stripping, com melhor qualidade de vida no período pós-operatório. A EVLA demonstrou corrigir ou melhorar significativamente a anormalidade hemodinâmica em pacientes com insuficiência venosa crônica com refluxo venoso superficial. Relatos iniciais sugerem que as técnicas de ablação endovenosa, em contraste com o stripping cirúrgico, estão associadas a uma baixa incidência de neovascularização.
A aplicação dos princípios da anestesia tumescente aos tratamentos venosos, juntamente com o desenvolvimento de técnicas de ablação endovenosa, oferecem a possibilidade de tratar a grande maioria dos pacientes com insuficiência venosa superficial em consultório sem anestesia geral ou incisões cirúrgicas, ao mesmo tempo em que maximizam os resultados e minimizam as recidivas.

2. Tratamento cirúrgico das varizes de safena grande J., com preservação do tronco principal da safena grande. J. Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. A relação anatómica entre a veia safena longa e o nervo safeno. Relevância para a cirurgia radical de varizes. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. O destino da veia safena residual após a remoção parcial ou ligadura. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Avaliação objetiva da ligadura sem desnudamento da veia safena longa. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Avaliação do stripping da veia safena longa no tratamento das varizes primárias. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. Tirar ou não a veia safena longa? Uma prova de varizes. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. A neovascularização é a principal causa de recorrência da varizes: resultados de um ensaio aleatório de desnudamento da veia safena longa. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. A remoção da veia safena longa reduz a taxa de reoperação de veias varicosas recorrentes: resultados de cinco anos de um ensaio randomizado. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Causas da recorrência da varizes: resultados tardios de um ensaio aleatório controlado de remoção da veia safena longa. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Razões para desnudar a veia safena longa. Flebologie. 1988;41:766-769.
13. Neglen P. Tratamento das varicosidades de origem safena: comparação da ligadura, excisão seletiva e escleroterapia. In: Bergan JJ, Goldman MP eds. Varizes e Telangiectasias: Diagnóstico e Tratamento. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous alation of incompetent saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Endovenous laser treatment of saphenous vein reflux: resultados a longo prazo. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Os primeiros 1000 casos de terapia endovenosa italiana (IEWG). Fundamentação, e resultados a longo prazo para o período 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Há quinze anos atrás o laser deveria abrir artérias, agora é suposto fechar veias: qual é a realidade por detrás da ferramenta? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (discussão 9- 10).
22. Kabnick LS. Resultado de diferentes comprimentos de onda de laser endovenoso para ablação da veia safena magna. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Fechamento da veia safena magna com laser de 1320 nm: um estudo de seguimento de 6 a 12 meses. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenous saphenous alation corrige a anormalidade hemodinâmica em pacientes com CEAP classe clínica 3-6 CVI devido ao refluxo superficial. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Comparação do tratamento endovenoso com laser de 810 nm com a remoção convencional da veia safena magna em pacientes com varizes primárias. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. Um estudo controlado não randomizado de terapia laser endovenosa e cirurgia no tratamento de veias varicosas. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous Laser obliteration for the treatment of primary varicose veins. Flebologia. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins: early results from a large single-center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. A não oclusão e reabertura precoce da veia safena magna após o tratamento a laser endovenoso é dependente da fluência. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Uma maior entrega de energia melhora o sucesso do tratamento com laser endovenoso de veias safenas incompetentes. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Lesão térmica da parede interna das veias durante o tratamento com laser endovenoso: papel chave da absorção de energia pelo sangue intravascular. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigação dos efeitos da radiofrequência e do laser (980 nm) após o tratamento endoluminal da insuficiência venosa de safena num modelo ex-vivo. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenous laser: mecanismo de acção. Trabalho apresentado na Reunião Anual da Academia Americana de Dermatologia; 3-7 de março de 2006; São Francisco, Califórnia, EUA.
35. Izzo F. Outras técnicas de ablação térmica: ablação por microondas e laser intersticial de tumores hepáticos. Anais de Oncologia Cirúrgica. 2003;10:491-497.
36. Mordon SR, Wassmer B e Zemmouri J. Modelagem matemática do tratamento endovenoso a laser (ELT). BioMedical Engineering OnLine. 2006;5:26. Disponível em: http://www.biomedical-engineeringonline. com/content/5/1/26. Acesso em: 19 de julho de 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Estudo experimental da termocoagulação induzida pelo diodelaser no tecido hepático com ponta de fibra escaneadora. Mundo J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Dor, hematoma e eficácia a curto prazo após tratamento endovenoso a laser da veia safena magna: o efeito da técnica operatória e cuidados pós-operatórios. Trabalho apresentado no 16º Congresso Anual do American College of Phlebology; 7-10 novembro 2002; Fort Lauderdale, Flórida, EUA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenous treatment of the great saphenous vein using a 1320 nm Nd:YAG laser causes less side effects than using a 940 nm diode laser. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Comparação da radiofrequência endovenosa versus oclusão de grandes veias por laser de diodo de 810 nm em um modelo animal. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Cirurgia incisional a laser. Clínicas em Cirurgia Plástica. 2000;27:213- 220.
42. Moritz AR, Henriques Jr CE. Estudos de lesão térmica II: a importância relativa do tempo e da temperatura superficial na causação de vagabundos cutâneos. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Necrose induzida por choque térmico e apoptose em osteoblastos. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Alterações histopatológicas na pele e tecidos subcutâneos de pernas de rato após tratamento com hipertermia. Prática de Res Resistência ao Caminho. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Alterações de temperatura no tecido perivenoso durante o tratamento com laser endovenoso num modelo suíno. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Investigações termométricas da temperatura perivenosa durante o tratamento com laser endovenoso de veias varicosas. Trabalho apresentado no 15º Congresso Mundial da Union Internationale de Phlébologie; 2-7 de outubro de 2005; Rio de Janeiro, Brasil.
47. Beale RJ, Mavor AID, Gough MJ. A dissipação de calor durante o tratamento endovenoso a laser das varizes – há risco de lesão nervosa? Flebologia. 2006;21:32-35.
48. Chang CJ, Chua JJ. Fotocoagulação endovenosa a laser (EVLP) para veias varicosas. Lasers Surgido Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Varizes do nervo ciático. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Observação ultra-sonográfica do nervo ciático e seus ramos na fossa poplítea: sempre visível, nunca visto. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extensão do trombo de safena na veia femoral: uma complicação potencial de novas técnicas de ablação endovenosa. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenous fistula after endovenous laser treatment of the short saphenous vein. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Flebite difusa flebítica após tratamento a laser endovenoso da veia safena magna. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Estudo prospectivo randomizado da obliteração endovenosa por radiofrequência (procedimento de fechamento) versus ligadura e retirada em uma população selecionada de pacientes (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Endovascular obliteration of saphenous reflux: a multicenter study. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early effectiveness and complications. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke após a escleroterapia por injecção de espuma de varizes. J Vasc Surg. 2006;43: 162-164.