Clasi de solide cristaline
Substanțele cristaline pot fi descrise prin tipurile de particule din ele și prin tipurile de legături chimice care au loc între particule. Există patru tipuri de cristale: (1) ionic, (2) metalic, (3) rețea covalentă și (4) molecular. Proprietățile și câteva exemple ale fiecărui tip sunt enumerate în tabelul următor și sunt descrise în tabelul de mai jos.
| Tip de solid cristalin | Exemple (formule) | Punctul de topire (°C) | Punctul normal de fierbere (°C) |
|---|---|---|---|
| Ionic | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Metalic | \(\ce{Hg}\) | -.39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Rețea covalentă | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (diamant) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molecular | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Cristale ionice – Structura cristalină ionică este formată din cationi alternativ încărcați pozitiv și anioni încărcați negativ (vezi figura de mai jos). Ionii pot fi fie monatomici, fie poliatomici. În general, cristalele ionice se formează dintr-o combinație de metale din grupa 1 sau 2 și nemetale din grupa 16 sau 17 sau din ioni poliautomatici nemetalici. Cristalele ionice sunt dure și fragile și au puncte de topire ridicate. Compușii ionici nu conduc electricitatea în stare solidă, dar conduc electricitatea atunci când sunt în stare topită sau în soluție apoasă.
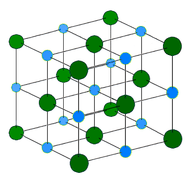
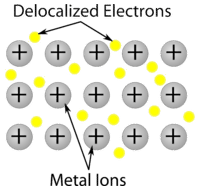
Cristal metalic – Cristalele metalice sunt formate din cationi metalici înconjurați de o „mare” de electroni de valență mobili (vezi figura de mai jos). Acești electroni, numiți și electroni delocalizați, nu aparțin niciunui atom, ci sunt capabili să se deplaseze prin întregul cristal. Ca urmare, metalele sunt buni conductori de electricitate. După cum se vede în tabelul de mai sus, punctele de topire ale cristalelor metalice acoperă o gamă largă.
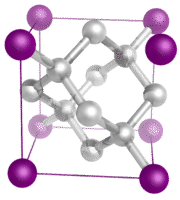
Cristale cu rețea covalentă – Un cristal cu rețea covalentă este format din atomi aflați în punctele de rețea ale cristalului, fiecare atom fiind legat covalent de cei mai apropiați atomi vecini (vezi figura de mai jos). Rețeaua legată covalent este tridimensională și conține un număr foarte mare de atomi. Printre solidele cu rețea se numără diamantul, cuarțul, mulți metaloizi și oxizi de metale de tranziție și metaloizi. Solidele de rețea sunt dure și fragile, cu puncte de topire și de fierbere extrem de ridicate. Fiind compuse din atomi și nu din ioni, ele nu conduc electricitatea în nicio stare.
Cristale moleculare – Cristalele moleculare constau, de obicei, din molecule aflate în punctele de rețea ale cristalului, ținute împreună de forțe intermoleculare relativ slabe (vezi figura de mai jos). Forțele intermoleculare pot fi forțe de dispersie, în cazul cristalelor nepolare, sau forțe dipol-dipolare, în cazul cristalelor polare. Unele cristale moleculare, cum ar fi gheața, au moleculele ținute împreună prin legături de hidrogen. Atunci când unul dintre gazele nobile este răcit și solidificat, punctele de rețea sunt mai degrabă atomi individuali decât molecule. În toate cazurile, forțele intermoleculare care țin particulele împreună sunt mult mai slabe decât legăturile ionice sau covalente. Ca urmare, punctele de topire și de fierbere ale cristalelor moleculare sunt mult mai scăzute. Neavând ioni sau electroni liberi, cristalele moleculare sunt slabi conductori electrici.

Câteva proprietăți generale ale celor patru clase majore de solide sunt rezumate în tabelul \(\PageIndex{2}\).
| Solizi ionici | Solizi moleculari | Solizi covalenți | Solizi metalici |
|---|---|---|---|
| *Există multe excepții. De exemplu, grafitul are o conductivitate electrică relativ ridicată în cadrul planurilor de carbon, iar diamantul are cea mai mare conductivitate termică dintre toate substanțele cunoscute. | |||
| conductori slabi de căldură și electricitate | conductori slabi de căldură și electricitate | conductori slabi de căldură și electricitate* | conductori buni de căldură și electricitate |
| punct de topire relativ ridicat | punct de topire scăzut | punct de topire ridicat | punctele de topire depind foarte mult de configurația electronică |
| duri, dar casante; se sfărâmă sub tensiune | molatic | foarte dur și fragil | se deformează ușor sub tensiune; ductil și maleabil |
| relativ dens | densitate scăzută | densitate scăzută | de obicei densitate mare |
| distinctă surface | dull surface | dull surface | lustrous |
Exemplu \(\PageIndex{1}\)
Clasificați \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\), și \(\ce{Zn}\) ca solide ionice, moleculare, covalente sau metalice și aranjați-le în ordinea creșterii punctelor de topire.
Dat: compuși
Întrebare: clasificarea și ordinea punctelor de topire
Strategie:
- Localizați elementul (elementele) component(e) în tabelul periodic. Pe baza poziției acestora, preziceți dacă fiecare solid este ionic, molecular, covalent sau metalic.
- Aranjați solidele în ordinea creșterii punctelor de topire, pe baza clasificării dumneavoastră, începând cu solidele moleculare.
Soluție:
A. Germaniul se află în blocul p, chiar sub Si, de-a lungul liniei diagonale a elementelor semimetalice, ceea ce sugerează că Ge elementar este probabil să aibă aceeași structură ca Si (structura diamantului). Astfel, Ge este probabil un solid covalent.
RbI conține un metal din grupa 1 și un nemetal din grupa 17, deci este un solid ionic care conține ioni Rb+ și I-.
Compusul \(\ce{C6(CH3)6}\) este o hidrocarbură (hexametilbenzen), care constă din molecule izolate care se suprapun pentru a forma un solid molecular fără legături covalente între ele.
Zn este un element cu bloc d, deci este un solid metalic.
B. Aranjarea acestor substanțe în ordinea creșterii punctelor de topire este simplă, cu o singură excepție. Ne așteptăm ca C6(CH3)6 să aibă cel mai mic punct de topire și Ge să aibă cel mai mare punct de topire, cu RbI undeva între ele. Cu toate acestea, punctele de topire ale metalelor sunt dificil de prezis pe baza modelelor prezentate până acum. Deoarece Zn are un înveliș de valență plin, nu ar trebui să aibă un punct de topire deosebit de ridicat, astfel încât o presupunere rezonabilă este
C6(CH3)6 < Zn ~ RbI < Ge.
Punctele de topire reale sunt: C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; și Ge, 938°C. Acest lucru este în concordanță cu predicția noastră.
Exercițiu \(\PageIndex{1}\)
Clasificați CO2, BaBr2, GaAs, și AgZn ca solide ionice, covalente, moleculare sau metalice și apoi aranjați-le în ordinea creșterii punctelor de topire.
Răspuns
CO2 (molecular) < AgZn (metalic) ~ BaBr2 (ionic) < GaAs (covalent).
Punctele de topire reale sunt:
Punctele de topire reale sunt: CO2, aproximativ -15,6°C; AgZn, aproximativ 700°C; BaBr2, 856°C; și GaAs, 1238°C.
.