Download this issue Back to summary
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
Endovenous laser ablation (EVLA) on vähemmän invasiivinen vaihtoehto suonten poistolle. Tulokset näyttävät olevan yhtä hyvät tai paremmat kuin strippauksessa, ja elämänlaatupisteet ovat paremmat leikkauksen jälkeisenä aikana. EVLA:n on osoitettu korjaavan tai parantavan merkittävästi hemodynaamisia poikkeavuuksia potilailla, joilla on krooninen laskimoiden vajaatoiminta (CVI) ja pinnallinen laskimorefluksi. Varhaiset raportit viittaavat siihen, että endovenoosiseen ablaatiotekniikkaan, toisin kuin kirurgiseen strippaukseen, liittyy alhainen neovaskularisaation esiintyvyys.
EVLA:n suorittamiseen käytetään erilaisia aallonpituuksia. Vaikka alkuperäinen kromofori on vesi tai hemoglobiini käytetystä aallonpituudesta riippuen, hiili näyttää olevan toissijainen mutta keskeinen kromofori, joka on todennäköisesti riippumaton aallonpituudesta.
Tumesenssipuudutuksen periaatteiden soveltaminen laskimohoitoihin sekä endovenoosisen ablaatiotekniikan kehittäminen tarjoavat mahdollisuuden hoitaa valtaosa suonikohjuista kärsivistä suonikohjuista toimistolla ilman yleisanestesiaa tai kirurgisia viiltoja ja samalla maksimoida hoitotulokset ja minimoida uusiutuminen.
TOIMENPITEET
Safenaalinen laskimorefluksi on taustalla oleva ensisijainen poikkeavuus suurimmassa osassa pinnallisen laskimoiden vajaatoiminnan tapauksista. Näin ollen lähestymistavat saphenofemoraalisen liitoksen ja saphenous truncal -epätasapainon hoitoon ovat hallinneet flebologien ajattelua. Trendelenburg kuvasi 1890-luvulla pelkän saphenofemoraalisen liitoksen ligaation ilman epäpätevän vena saphenuksen poistoa. Pelkän ligatoinnin etuihin ligatoinnin ja strippauksen sijaan, joita yhä nykyäänkin ylistetään1 , kuuluu se, että sepelvaltimon runko säilyy mahdollista tulevaa käyttöä varten ohitussiirteenä2 ja se, että sepelvaltimohermon vammat vältetään.3 Korkea ligatoinnilla on vähemmän invasiivisia vaikutuksia, se on nopeampi ja yksinkertaisempi suorittaa, ja siihen liittyy helpompi toipuminen verrattuna laskimon strippaukseen. Vaikka on totta, että se rutiininomaisesti ”säästää” sapenous trunkia,4 sairaan sapenous-laskimon käyttö johtimena on yhdistetty lisääntyneeseen siirteen epäonnistumisriskiin.5 Tärkeintä on, että enää ei ole epäilystäkään siitä, että pelkkä korkea ligatuuri johtaa yleensä pysyvään refluksitautiin sapenous-trunkissa.6,7 Varikoosien uusiutuminen vähenee merkittävästi7-9 ja uusintaleikkausten määrä on 60-70 prosenttia pienempi, jos sapenous-laskimo strippataan pelkkää ligatuuria käytettäessä verrattuna pelkkään ligatuuriin.10,11 Myös pelkän ligatoinnin jälkeen 80 prosentilla potilaista todettiin uusiutuminen tai jäännösyhteys nivusliitoksen kanssa, kun taas 34 prosentilla potilaista oli myös reiden keskellä oleva perforaattorin inkompetenssi strippaamattoman ison vena saphena sapheneuksen (GSV) kautta.12 Kuten Neglen päätteli, reiden GSV:n strippaaminen on olennaisen tärkeää, jotta voidaan minimoida uusiutuminen, joka aiheutuu epäkompetentin kommunikaation uudelleenkehittymisestä saphena sapheneuksen ja femoraalin yhtymäkohdan kanssa ja reiden perforaattorin inkompetenssista johtuen.13 Yksinkertaisesti sanottuna pelkän ligatoinnin puutteet ovat suuremmat kuin sen edut.
On tärkeää huomata, että uusiutuminen on yleistä myös sapenous veinin ligatoinnin ja strippauksen jälkeen. Vaikka saphenofemoraalisen liitoskohdan riittämätön leikkaus ja taudin eteneminen ovat mekanismeja, jotka selittävät joitakin uusiutumistapauksia, toinen tärkeä mekanismi on neovaskularisaatio liitoskohdan ympärillä laskimoleikkauksen jälkeen.11,14 Itse asiassa neovaskularisaatio on raportoitu pääasiallisena uusiutumistapausten syynä,9 ja neovaskulaariset kanavat, joiden koko, lukumäärä ja mutkaisuus vaihtelevat, ovat useimmissa tapauksissa syynä takaisinvirtaukseen, joka johtaa toistuviin suonivarsikohjuihin.15 Vaikka jotkut ovatkin ilmaisseet epäilyksensä todellisen neovaskularisaation todenperäisyydestä, on olemassa selkeää histologista näyttöä siitä, että neovaskularisaatio on uusiutuvien suonikohjujen syy.16 Varhaiset raportit viittaavat sitä vastoin siihen, että endovenoosiseen ablaatiotekniikkaan liittyy hyvin vähän neovaskularisaatiota. 17 Saattaa olla, että neovaskularisaation kehittyminen estetään suurelta osin välttämällä nivusdissektiota ja säilyttämällä laskimotiehyet normaaleissa liitosuomuissa.18,19
EVLA on radiotaajuusablaation ja vaahtoskleroterapian tavoin vähemmän invasiivinen vaihtoehto suonten poistolle. EVLA on tarkoitettu ambulatoriselle potilaalle, jolla on suuri, pieni tai akkommodaarinen vena saphena refluksi, jossa on pintasuonikohjuja ja/tai pinnalliseen laskimoiden vajaatoimintaan liittyviä oireita tai komplikaatioita. EVLA tehdään rutiininomaisesti käyttämällä laimeaa paikallispuudutusta, johon voi liittyä tai olla liittämättä täydentäviä suun kautta otettavia anksiolyyttisiä lääkkeitä, vastaanotolla. Toimenpide kestää yleensä 30-60 minuuttia, mutta sen kesto riippuu hoidettavan segmentin pituudesta, hoitajan kokemuksesta ja siitä, tehdäänkö liitännäistoimenpiteitä, kuten ambulatorinen flebektomia. Riippumatta siitä, miten taustalla oleva sapenosus-inkompetenssi hoidetaan, lisähoitoja tarvitaan yleensä jäljellä olevien suonikohjujen hoitoon (kuva 1).
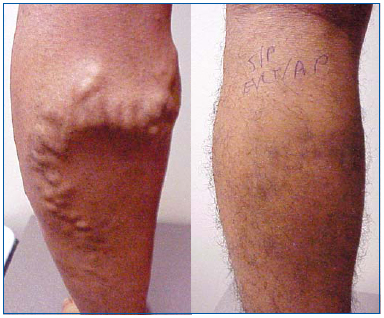
Kuva 1. 26-vuotias mies ennen suuren sapenosus-laserablaatiota ja 1 kuukausi sen jälkeen, kun suuri sapenosus-laserablaatio ja suonikohjujen suonikohjujen ambulatorinen flebektomia tehtiin.
TULOKSELLISUUS
Lyhyt- ja keskipitkän aikavälin tutkimukset EVLA:sta, riippumatta käytetystä aallonpituudesta, näyttävät olevan huomattavan johdonmukaisia, ja niissä raportoidaan tyypillisesti refluksoivien vena sapenous suonien ablaatiosta 90 %:ssa tai useammissa tapauksissa.18,20-23 EVLA:n on osoitettu korjaavan tai parantavan merkittävästi kroonisen laskimoiden vajaatoiminnan (CVI) hemodynaamisia poikkeavuuksia ja kliinisiä oireita kliinisen, etiologisen, anatomisen ja patofysiologisen (CEAP) kliinisen luokan 3-6 potilailla, joilla on pinnallinen laskimorefluksitauti (superficial venous reflux), tai parantavan niitä merkittävästi.24,25 Tulokset näyttävät olevan yhtä hyvät tai paremmat kuin strippauksen tulokset, ja elämänlaadun tulokset ovat paremmat leikkauksen jälkeisellä kaudella strippauksen tuloksiin verrattuna.20,25-27. Potilaiden tyytyväisyys on raportoitu korkeaksi.18,28,29 Endovenoottisten toimenpiteiden kokonaiskustannukset (toimenpidekustannukset ja yhteiskunnalliset kustannukset) ovat todennäköisesti yhtä suuret tai pienemmät kuin leikkauksen kustannukset.27
Varhaiset tiedot GSV:n hoidosta 810 nm:n ja 940 nm:n laitteilla viittaavat siihen, että hoidon epäonnistuminen on harvinaista potilailla, joita on hoidettu > 70 J/cm:n teholla30,31. Nostonopeus 2 mm/s 14 watin teholla tuottaa 70 J/cm.
VAIKUTUSMEKANISMI
EVLA:ssa on nykyisin käytössä seuraavat aallonpituudet: 810, 940, 980, 1064, 1319, 1320 ja 2068 nm. On esitetty, että laskimon seinämävaurio välittyy sekä suoran vaikutuksen kautta että epäsuorasti laserin aiheuttaman höyryn kautta, joka syntyy lämmittämällä pieniä määriä verta laskimossa.32 Jotkut ovat esittäneet, että aallonpituuden valinta vaikuttaa suuresti tuloksiin.23
1320 ja 2078 nm:n lasereiden pääasiallinen kromofori on ainakin aluksi vesi, kun taas muut EVLA:ssa käytettävät aallonpituudet kohdistuvat pääasiassa hemoglobiiniin. On selvää, että on välttämätöntä vaurioittaa laskimon seinämää termisesti riittävästi, jotta saadaan aikaan tehokas ablaatio. Jonkin verran kuumenemista voi tapahtua suonen seinämän suoran fotonienergian (säteilyn) absorboitumisen kautta sekä höyrykuplien konvektiolla ja lämmenneen veren johtumisella. On kuitenkin epätodennäköistä, että nämä jälkimmäiset mekanismit muodostaisivat suurimman osan laskimoon kohdistuvista vaikutuksista. Veren maksimilämpötila on 100 °C. Laserkäsittelyn on todettu aiheuttavan suonen seinämän karbonisoitumista.33 Laserkärjen karbonisoituminen, joka tapahtuu noin 300 °C:n lämpötilassa, on havaittu EVLA:n jälkeen, ja se näyttää tapahtuvan käytetystä aallonpituudesta riippumatta.34 Laserkuidun kärjen karbonisoituminen luo pistemäisen lämmönlähteen ja vähentää valon tunkeutumisen kudokseen olennaisesti nollaan.34,35 Mordon et al. totesivat: ”Laserenergian imeytymisestä vereen syntyvä vesihöyry tuottaa vain pienen murto-osan laskimon seinämän vaurioittamiseen tarvittavasta energiasta, ja se ei siis voi olla ensisijainen mekanismi, jonka avulla laskimolle aiheutuu vaurio endovenoosisella laserauksella. Suonen seinämässä tapahtuva karbonatisoituminen ja tractus, joka on nähtävissä histologisesti endovenoosisen laserin jälkeen, voi olla seurausta vain laserkuidun kärjen ja suonen seinämän välisestä suorasta kosketuksesta. ”36 Tohtori Rox Anderson, Massachusettsin yleissairaalassa sijaitsevan Wellmanin valolääketieteen keskuksen (Wellman Center for Photomedicine at Massachusetts General Hospital) johtaja, raportoi, että hiili näyttää olevan toissijainen, mutta keskeinen kromofori, joka on luultavasti riippumaton aallonpituuksista.34 Huomaa, että kuitukärjen kärki ja sen muoto voivat vaikuttaa karbonatisoitumisen kehittymiseen.37

Kuva 2. Karbonatisoituminen 600 mikronin laserkuidun kärjessä sekundaarisesti endovenoosisen laserablaation jälkeen 1320 nm:n laserilla (Kuva Mark Forrestal, MD, FACPh).
TUMESSAANESTESIA
EVLA on suoritettava paikallispuudutuksessa käyttäen suuria määriä laimeaa lidokaiini- ja adrenaliiniliuosta (keskimääräinen tilavuus 200-400 ml 0,1-prosenttista lidokaiinia ja 1:1 000 000 adrenaliinia), joka on puskuroitu natriumbikarbonaatilla. Tämä liuos on annettava joko manuaalisesti tai infuusiopumpun avulla ultraääniohjauksessa siten, että laskimoa ympäröi puudutusneste koko hoidettavan segmentin pituudelta (kuva 3).
Tumesenssipuudutuksen etuja endovenoosisessa ablaatiossa ovat:
– anestesia,
– hoidettavan laskimon erottaminen ympäröivistä rakenteista,
– lämpönielu, joka vähentää huippulämpötiloja perivenoottisissa kudoksissa,
– laskimokompressio, joka maksimoi hoidon vaikutuksen laskimon seinämään.
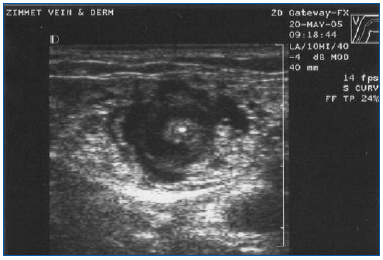
Kuva 3. Hoidon vaikutus laskimon seinämään. Poikittainen ultraäänikuva tumescent-puudutusnesteestä, joka ympäröi keskellä sijaitsevaa isoa laskimoa ja laserkuitua/-suojusta.
Vaikka lidokaiinin suurinta turvallista annostusta tumesenssitekniikkaa käyttäen laskimotoimenpiteissä ei ole tutkittu hyvin, annos 35 mg/kg on kohtuullinen arvio.
Käyttäen näitä parametreja tumesenssipuudutus rasvaimun yhteydessä on osoittautunut poikkeuksellisen turvalliseksi. Lisätietoja on saatavilla osoitteessa http://www.liposuction.com/pharmacology/drug_inter act.php.
EVLA-tekniikan vasta-aiheet
EVLA-tekniikan vasta-aiheet on esitetty kesällä taulukossa I.

Taulukko I. Endovenoottisen laserin vasta-aiheet.
ALIVAIKUTUKSET
Lyhytaikaista kipua ja ekhymoosia on yleisesti havaittu EVLA:n jälkeen. Retrospektiivisessä katsauksessa on raportoitu jaksottaispulssisen laserkuidun takaisinvedon aiheuttavan huomattavasti enemmän leikkauksen jälkeistä kipua ja mustelmia verrattuna jatkuvaan takaisinvetoprotokollaan.38 Lyhyen venytyssiteen lisääminen kolmen päivän ajaksi jaksottaisen EVLA:n jälkeen vähensi huomattavasti potilaiden raportoimia mustelmia ja kipua. Jatkuvatoiminen pullback vähensi kivun ja mustelmien voimakkuutta entisestään niin paljon, että ne olivat samankaltaisia kuin radiotaajuusablaatiolla hoidettujen potilaiden raportoimat tasot (taulukot II ja III). Alustavien raporttien mukaan leikkauksen jälkeisessä kulussa saattaa olla joitakin eroja riippuen EVLA:n suorittamiseen käytetystä aallonpituudesta.22,39 Tämä perustuu kuitenkin harvalukuisiin tietoihin, joissa on lyhytaikainen seuranta.
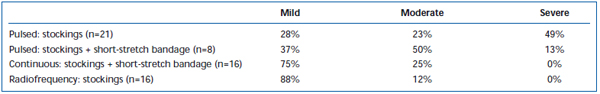
Taulukko II. Potilaan arvioima postoperatiivinen mustelma 3-7 päivän kuluttua pulssitetusta endovenoosisesta laserablaatiosta (EVLA) luokan II sukkien kanssa, pulssitetusta EVLA:sta sukkien ja lyhytvenytyssiteen kanssa, jatkuvatoimisesta EVLA:sta sukkien ja lyhytvenytyssiteen kanssa sekä radiotaajuusablaatiosta sukkien kanssa.
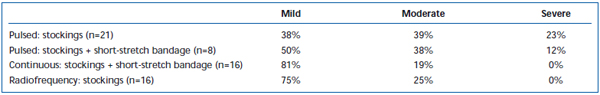
Taulukko III. Potilaan arvioima postoperatiivinen kipu 3-7 päivän kuluttua pulssitetusta endovenoosisesta laserablaatiosta (EVLA) luokan II sukkien kanssa, pulssitetusta EVLA:sta sukkien ja lyhytvenytyssiteen kanssa, jatkuvassa tilassa tapahtuvasta EVLA:sta sukkien ja lyhytvenytyssiteen kanssa sekä radiotaajuusablaatiosta sukkien kanssa.
PERIVASUAARINEN LÄMPÖVAURIO
EVLA:n aikana (vuohen kaulalaskimo, 12 wattia, 1 sekunnin pulssit, 1 sekunnin välein) mitatut keskimääräiset intravaskulaariset huippulämpötilat, jotka mitattiin laserkärjen kanssa samassa tasossa, olivat keskimäärin 729 °C, kun taas ne, jotka mitattiin 4 mm:n etäisyydellä kärjestä, olivat keskimäärin 93 °C.40 Kollateraalisen lämpövaurion riski riippuu kuitenkin perivenoottisesta kudoksen lämpenemisestä, ei verisuonensisäisestä lämpötilasta.
Kollageenin on havaittu supistuvan noin 50 °C:n lämpötilassa, kun taas nekroosi tapahtuu 70 °C:n ja 100 °C:n välillä.41 Kudoksen lämpövaurion laajuus riippuu voimakkaasti siitä, kuinka paljon ja kuinka kauan kudos on alttiina lämmölle. Henriques ja Moritz tutkivat ajan ja lämpötilan välistä vastetta kudoksessa, joka on altistettu enintään 70 °C:n lämpötilalle.42 He havaitsivat, että iho kestää lämpötilan nousua hyvin lyhyiden altistusaikojen ajan ja että vaste näyttää logaritmiselta, kun altistusajat lyhenevät. Esimerkiksi kehon lämpötilan nousu 58 °C:seen johtaa solujen tuhoutumiseen, jos altistus kestää yli 10 sekuntia. Kudokset kestävät kuitenkin jopa 70 °C:n lämpötiloja, jos altistus kestää alle yhden sekunnin. Li ja muut raportoivat, että endoteelisolujen kuumentaminen 48 °C:seen 10 minuutin ajaksi ei aiheuttanut solukuolemaa.43 He havaitsivat myös, että osteoblasteissa tapahtui ohimeneviä ja palautuvia muutoksia sen jälkeen, kun niitä oli altistettu 45 °C:ssa 10 minuuttia tai vähemmän. Toisessa tutkimuksessa havaittiin hiirten takaraajoissa palautuvia kudosvaurioita sen jälkeen, kun ne oli upotettu 44 °C:n vesihauteeseen.44
Uudemmassa tutkimuksessa mitattiin huippulämpötilaa laskimon ulkoseinämässä EVLA:n aikana elävässä sian korvasuoneen laskimossa ja altistetuissa takaraajojen laskimoissa.45 EVLA-asetukset vaihtelivat 8 watista (1-2 sekunnin pulssin kesto), 10 watista (1-1,5 sekunnin pulssin kesto), 12 watista (0,5-1,5 sekunnin pulssin kesto) 15 wattiin (0,5-1,0 sekunnin pulssin kesto), tumescenttianestesian kanssa ja ilman. Tulokset osoittavat, että huippulämpötilat vaihtelivat 34,6 °C:n ja 49,1 °C:n välillä annettujen joulejen funktiona, ja alhaisemmat huippulämpötilat saavutettiin, kun läsnä oli tumescent-nestettä (kuva 4).
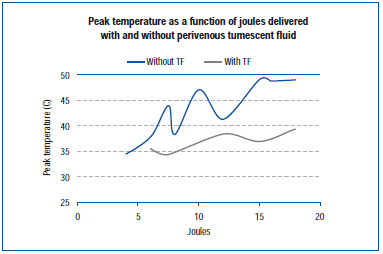
Kuva 4. Mukautettu lähteestä Zimmet SE, Min RJ. Lämpötilan muutokset perivenoottisessa kudoksessa endovenoosisen laserhoidon aikana sian mallissa. J Vasc Interv Radiol. 2003;14:911-915 (viite 45).
EVLA:n (63 potilasta, 980 nm, 15 wattia, 1,5 sekunnin pulssit) aikana mitattu huippulämpötila laskimon ulkoseinämässä ihmisillä, 3 cm saphenofemoraalisen liitoskohdan alapuolella, oli 40,9 °C ja 49,8 °C tumesenttisen nesteen kanssa ja ilman tumesenttista nestettä46. Samankaltaisia tuloksia raportoitiin toisesta ihmistutkimuksesta EVLA:n aikana (12 potilasta, 810 nm, 12 W, 1 sekunnin pulssit, 1 sekunnin välein, tumesenssitekniikka), jolloin huippulämpötilat olivat 43,3 °C, 42,0 °C ja 36,0 °C 3 mm:n, 5 mm:n ja 10 mm:n etäisyydellä GSV:stä. 47
Lämpötila näyttää laskevan hyvin nopeasti lyhyillä etäisyyksillä EVLA:n aikana. Tämä on luultavasti ristiriidassa radiotaajuusenergian kanssa, jossa mikroaaltolämmitys tapahtuu kudoksen ja elektrodin rajapinnan ympärillä. Eläimistä ja ihmisistä saadut tiedot viittaavat siihen, että endovenoosisen laserleikkauksen aikana syntyvät perivenoottiset huippulämpötilat eivät todennäköisesti aiheuta pysyviä vaurioita perivenoottiseen kudokseen useimmissa tilanteissa. Syntyvä huippulämpötila pienenee, kun käytetään perivenoottista tumescent-nestettä. Nämä havainnot näyttäisivät selittävän sen, että hermovammojen ja ihon palovammojen esiintyvyys EVLA:n jälkeen on hyvin pieni. Eräässä tutkimuksessa, jossa käytettiin 1064 nm:n Nd: YAG-laseria, raportoitiin erittäin korkeasta parestesian esiintyvyydestä 36,5 prosentilla ja ihopalovammojen esiintyvyydestä 4,8 prosentilla.48 On huomattava, että annosteltu energiamäärä oli noin kolme kertaa suurempi kuin tavallisesti käytetty energiamäärä ja että hoito tehtiin ilman tumescenttipuudutusta. Huolimatta EVLA:n yhteydessä raportoiduista alhaisista perivenoosilämpötiloista on tärkeää huomata, että erityistä varovaisuutta on noudatettava harkittaessa endovenoosista toimenpidettä tietyissä tapauksissa, kuten iskiashermon suonikohjuissa.49,50
PITKÄT KOMPLIKAATIOT
EVLA:n jälkeisiä vakavia komplikaatioita on raportoitu harvoin. Syvän laskimotromboosin (DVT) osuudet, jotka on yhdistetty useista sarjoista, ovat paljon alle 1 %.17,18,20,28 Eräässä ryhmässä raportoitiin trombin laajenemisen reisilaskimoon esiintyvyydeksi 7,7 %.51 Kyseisessä tutkimuksessa EVLA tehtiin kuitenkin yleis- tai selkäydinpuudutuksessa. Se, että potilaat eivät voineet liikkua välittömästi leikkauksen jälkeen, saattoi vaikuttaa trombin laajenemisen suureen esiintyvyyteen. On olemassa yksi raportti arteriovenoosisesta fistelistä, joka kehittyi lyhyen vena sapenosuksen (SSV) EVLA:n jälkeen.52 Yhdelle potilaalle kehittyi septinen tromboflebiitti EVLA:n jälkeen, johon yhdistettiin perforaattoreiden avoin ligaatio ja stabiili flebektomia.53 Tämä korjaantui antibioottihoidolla ja debridementillä.
ALTERNATIIVISET KÄYTÄNNÖT
EVLA ja radiotaajuusablaatio (RFA)54,55 näyttävät molemmat olevan tehokkaita hoitomuotoja sapenous inkompetenssin hoitoon. EVLA:n etuja RFA:han verrattuna ovat lyhyempi toimenpideaika ja alhaisemmat hoitokohtaiset kustannukset. EVLA:n raportoidut tukkeutumisprosentit ovat yleensä hieman korkeammat kuin RFA:lla saadut prosentit.56 EVLA:n haittoihin voi kuulua enemmän mustelmia ja epämukavuutta varhaisessa postoperatiivisessa vaiheessa, vaikka tämä saattaa riippua tekniikasta. Molempia tekniikoita kehitetään edelleen, mikä parantaa tuloksia. Molempiin toimenpiteisiin liittyy alhainen komplikaatioiden määrä, kun ne tehdään tumescenttipuudutuksessa.
Toinen kehittymässä oleva saphena refluksin hoitomuoto on vaahdotettujen sklerosanttien käyttö ultraääniohjauksessa. Kaasua, kuten ilmaa tai hiilidioksidia, voidaan sekoittaa nestemäisiin detergenttisiin sklerosantteihin vaahdon aikaansaamiseksi, jonka arvioidaan olevan noin neljä kertaa tehokkaampi kuin saman aineen nestemäinen muoto. Varhaiset tulokset viittaavat siihen, että tämä voi olla arvokas menetelmä, sillä se on nopea ja edullinen toteuttaa, ja lyhyen ja keskipitkän aikavälin onnistumisprosentit ovat noin 75-90 prosenttia. Vaahtoon liittyy monia muuttujia (esim. kaasun tyyppi ja määrä, vaahdon tuottamiseen käytetty tekniikka, käytetyn sklerosantin pitoisuus ja tyyppi, ruiskutettu määrä jne.) Vaahtoskleroterapian jälkeen syvän laskimotromboosin riski voi olla suurempi kuin tavanomaisen skleroterapian jälkeen. Oikea tekniikka on tärkeää tämän komplikaation riskin minimoimiseksi. Muita vaahtoskleroterapian jälkeen raportoituja haittavaikutuksia ovat näköhäiriöt ja neurologiset tapahtumat. On julkaistu raportti aivohalvauksesta vaahtoskleroterapian (20 ml polidokanolivaahtoa) jälkeen potilaalla, jolla oli 1,8 cm:n avoin foramen ovale.57 Lisäkokemukset ja -tutkimukset tästä menetelmästä parantavat sen riskien sekä pitkän aikavälin tehokkuuden määrittelyä.
YHTEENVETO
Nykyaikana hyväksyttyjen suonikohjujen hoitoperiaatteiden avulla pyritään maksimoimaan hoitotulokset hemodynaamisesta ja potilaan kannalta ja samalla minimoimaan suonikohjujen uusiutumisen riski. Suonikohjujen asianmukainen hoito alkaa taustalla olevan laskimopatologian tarkalla arvioinnilla ja laskimohypertensioiden lähteiden tunnistamisella. Hoidon tavoitteisiin kuuluu syvän ja pinnallisen järjestelmän epäpätevien yhteyksien poistaminen sekä laskimoiden epäpätevyysreittien ja epäpätevien suonikohjujen hävittäminen. On ilmeistä, että uusiutuminen vähenee, jos epäkompetentti sapenous-rungon segmentti abloituu.
Endovenoosinen laserablaatio on vähemmän invasiivinen vaihtoehto suonen poistolle. Tulokset näyttävät olevan yhtä hyvät tai paremmat kuin strippauksessa, ja elämänlaatu on parempi leikkauksen jälkeisenä aikana. EVLA:n on osoitettu korjaavan tai parantavan merkittävästi hemodynaamisia poikkeavuuksia potilailla, joilla on krooninen laskimoiden vajaatoiminta ja pinnallinen laskimorefluksi. Varhaiset raportit viittaavat siihen, että endovenoosiseen ablaatiotekniikkaan, toisin kuin kirurgiseen strippaukseen, liittyy alhainen neovaskularisaation esiintyvyys.
Tumescent-puudutuksen periaatteiden soveltaminen laskimohoitoihin sekä endovenoosisten ablaatiotekniikoiden kehittäminen tarjoavat mahdollisuuden hoitaa valtaosa potilaista, joilla on pinnallinen laskimoiden vajaatoiminta, vastaanotolla ilman yleisanestesiaa tai kirurgisia leikkausviiltoja ja samalla maksimoida hoitotulokset ja minimoida uusiutuminen.
Tämä artikkeli toimitettiin 29. heinäkuuta 2006.

2. Large J. Sapenous varicesin kirurginen hoito, jossa säilytetään suuri sapenous päärunko. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. Pitkän vena saphenuksen ja vena saphenuksen anatominen suhde. Merkitys radikaalin suonikohjukirurgian kannalta. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. Jäljelle jäävän vena saphenuksen kohtalo osittaisen poiston tai ligaation jälkeen. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Epäilemätön edeltävä sapenous vein disease: uncognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Pitkän vena saphenuksen ligaation objektiivinen arviointi ilman strippausta. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Pitkän vena saphenuksen strippauksen arviointi primaaristen suonikohjujen hoidossa. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. Riisua vai olla riisumatta pitkää vena sapenosaa? Suonikohjututkimus. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. Neovaskularisaatio on suonikohjujen uusiutumisen pääasiallinen syy: tuloksia satunnaistetusta kokeesta, jossa pitkän vena saphenuksen strippaus tehtiin. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Pitkän vena saphenuksen strippaus vähentää uusintaleikkausten määrää toistuvien suonikohjujen vuoksi: satunnaistetun tutkimuksen viisivuotistulokset. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Suonikohjujen uusiutumisen syyt: pitkän vena saphenuksen strippauksen satunnaistetun kontrolloidun kokeen myöhäistulokset. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Syitä pitkän vena saphenuksen strippaukseen. Phlebologie. 1988;41:766-769.
13. Neglen P. Sapenusperäisten suonikohjujen hoito: ligaation, selektiivisen poiston ja skleroterapian vertailu. In: Bergan JJ, Goldman MP eds. Varicose Veins and Telangiectasias: Diagnosis and Treatment. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovaskularisaatio ja toistuvat suonikohjut: lisää histologisia ja ultraäänitodisteita. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetent saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Sepenous vein refluksin endovenoottinen laserhoito: pitkäaikaistulokset. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Italian endovenous-laser-työryhmän (IEWG) ensimmäiset 1000 tapausta. Perusteet ja pitkän aikavälin tulokset vuosina 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Viisitoista vuotta sitten laserin piti avata valtimoita, nyt sen pitäisi sulkea suonia: mikä on todellisuus työkalun takana? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (keskustelu 9- 10).
22. Kabnick LS. Eri endovenoottisten laserien aallonpituuksien tulokset ison vena sapenuksen ablaatiossa. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Intravaskulaarinen 1320 nm:n laserlasersulku suuressa laskimossa: 6-12 kuukauden seurantatutkimus. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenous saphenous ablation corrects the hemodynamic abnormality in patients with CEAP clinical class 3-6 CVI due to superficial reflux. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Endovenoottisen hoidon vertailu 810 nm:n laserilla verrattuna suuren vena saphenuksen perinteiseen strippaukseen potilailla, joilla on primaarisia suonikohjuja. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose veins. Phlebology. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins: early results from a large single center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Suurempi energiantuotto parantaa epäpätevien sapenous suonien endovenoottisen laserhoidon hoitomenestystä. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Tutkimus radiotaajuuden ja laserin (980 nm) vaikutuksista sapenous vein insufficiencen endoluminaalisen hoidon jälkeen ex-vivo-mallissa. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenoosinen laser: toimintamekanismi. Paper presented at the Annual Meeting of the American Academy of Dermatology; March 3-7, 2006; San Francisco, California, USA.
35. Izzo F. Muut lämpöablaatiotekniikat: maksakasvainten mikroaalto- ja interstitiaalinen laserablaatio. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B ja Zemmouri J. Matemaattinen mallinnus endovenous laser treatment (ELT). BioMedical Engineering OnLine. 2006;5:26. Saatavilla osoitteessa: http://www.biomedical-engineeringonline. com/content/5/1/26. Luettu 19. heinäkuuta 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Kokeellinen tutkimus diodelaaseri-indusoidusta termokoagulaatiosta maksakudoksessa skannerikuitukärjellä. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Kipu, mustelmat ja lyhytaikainen teho isomman laskimon endovenoottisen laserhoidon jälkeen: operatiivisen tekniikan ja postoperatiivisen hoidon vaikutus. Paper presented at the 16th Annual Congress of the American College of Phlebology; Nov 7-10, 2002; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Ison laskimon endovenoottinen hoito 1320 nm:n Nd:YAG-laserilla aiheuttaa vähemmän sivuvaikutuksia kuin 940 nm:n diodilaserilla. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Suurten laskimoiden endovenoosisen radiotaajuus- ja 810 nm:n diodilaserokkluusion vertailu eläinmallissa. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Laser-viiltoleikkaus. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Lämpövammatutkimukset II: ajan ja pintalämpötilan suhteellinen merkitys ihopoimujen synnyssä. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Lämpöshokin aiheuttama nekroosi ja apoptoosi osteoblasteissa. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Histopatologiset muutokset hiiren jalkojen ihossa ja ihonalaisissa kudoksissa hypertermiahoidon jälkeen. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Lämpötilamuutokset perivenoottisessa kudoksessa endovenoottisen laserhoidon aikana sian mallissa. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Perivenoosin lämpötilan termometriset tutkimukset suonikohjujen endovenoosisen laserhoidon aikana. Paper presented at the 15th World Congress of the Union Internationale de Phlébologie; October 2-7, 2005; Rio de Janeiro, Brazil.
47. Beale RJ, Mavor AID, Gough MJ. Lämmön haihtuminen suonikohjujen endovenoottisen laserhoidon aikana – onko hermovamman riski olemassa? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenous laser photocoagulation (EVLP) suonikohjujen hoitoon. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Seiskahermon suonikohjut. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Iskiashermon ja sen haarojen ultraäänihavainnointi popliteal fossa: aina näkyvissä, ei koskaan nähty. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Saphenuksen trombin laajentuminen reisilaskimoon: uusien endovenoosisten ablaatiotekniikoiden mahdollinen komplikaatio. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenoottinen fisteli lyhyen vena sapenosuksen endovenoottisen laserhoidon jälkeen. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuusi flegmonaalinen laskimotulehdus isomman laskimon endovenoottisen laserhoidon jälkeen. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospektiivinen satunnaistettu tutkimus endovenous radiofrequency obliteration (sulkemismenetelmä) vs. ligatointi ja strippaus valikoidussa potilaspopulaatiossa (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Endovaskulaarinen saphena refluksin obliterointi: monikeskustutkimus. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early efficacy and complications. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.