Download this issue Back to summary
Steven E. ZIMMET2,3
Austin, USA
ABSTRAKT
Az endovenosus lézerabláció (EVLA) a vénás sztrippelés kevésbé invazív alternatívája. A kimenetel egyenértékűnek vagy jobbnak tűnik, mint a sztrippelésé, a posztoperatív időszakban jobb életminőségi pontszámokkal. Kimutatták, hogy az EVLA korrigálja vagy jelentősen javítja a hemodinamikai rendellenességeket a felületes vénás refluxszal járó krónikus vénás elégtelenségben (CVI) szenvedő betegeknél. A korai jelentések szerint az endovenózus ablációs technikák – a sebészi strippeléssel ellentétben – a neovaszkularizáció alacsony előfordulási gyakoriságával járnak.
Az EVLA elvégzéséhez különböző hullámhosszokat használnak. Míg a kezdeti kromofór az alkalmazott hullámhossztól függően a víz vagy a hemoglobin, a szén másodlagos, de kulcsfontosságú kromofórnak tűnik, amely valószínűleg független a hullámhossztól.
A tumeszenciás érzéstelenítés elveinek alkalmazása a vénás kezelésekre, valamint az endovenózus ablációs technikák kifejlesztése lehetőséget nyújt arra, hogy a visszeres betegek nagy többségét rendelőben, általános érzéstelenítés vagy műtéti bemetszés nélkül kezeljék, miközben maximalizálják az eredményeket és minimalizálják a kiújulást.
BEVEZETÉS
A felületes vénás elégtelenség eseteinek többségében a vénás reflux az alapjául szolgáló elsődleges rendellenesség. Így a saphenofemoralis junction és a saphenosus truncus inkompetencia kezelésének megközelítései uralták a flebológusok gondolkodását. Trendelenburg az 1890-es években csak a saphenofemorális csomópont lekötését írta le, az inkompetens véna saphenosus strippelése nélkül. Az önmagában végzett ligáció előnyei a ligációval és a strippeléssel szemben, amelyeket még ma is dicsérnek,1 többek között a szafénusz törzs megőrzése az esetleges jövőbeli bypass graftként való felhasználás érdekében2 és a szafénusz ideg sérülésének elkerülése.3 A magas ligáció önmagában kevésbé invazív, gyorsabban és egyszerűbben elvégezhető, és a véna strippeléssel összehasonlítva könnyebb felépüléssel jár. Bár igaz, hogy rutinszerűen “megkíméli” a szafénusz törzset,4 a beteg szafénusz véna vezetékként való használata a graft kudarcának fokozott kockázatával jár együtt.5 A legfontosabb, hogy már nem kérdéses, hogy a magas lekötés önmagában általában tartós refluxot eredményez a szafénusz törzsben.6,7 A varikózis kiújulása jelentősen csökken7-9 és az újbóli műtétek aránya 60%-70%-kal kisebb, ha a szafénusz vénát strippelik, mintha csak a lekötést végeznék.10,11 Emellett a betegek 80%-ánál a ligációt követően a betegek 80%-ánál találtak kiújulást vagy reziduális kommunikációt az ágyéki összefolyással, míg 34%-uknál a combközépső perforátor inkompetencia is fennállt a nem strippelt nagy szafenovénán (GSV) keresztül.12 Ahogy Neglen megállapította, a comb GSV-jének strippelése elengedhetetlen a kiújulás minimalizálásához, amelyet a szafenofemorális összefolyással való inkompetens kommunikáció újbóli kialakulása és a combperforátor inkompetencia okoz.13 Egyszerűen fogalmazva, a ligálás hiányosságai önmagukban meghaladják annak előnyeit.
Fontos megjegyezni, hogy a recidíva még a vena saphenosa ligálása és strippelése után is gyakori. Míg a saphenofemorális csomópont nem megfelelő műtéte és a betegség progressziója olyan mechanizmusok, amelyek magyarázzák a kiújulás egyes eseteit, egy másik fontos mechanizmus a vénaműtétet követő neovaszkularizáció a csomópont körül.11,14 Valójában a neovaszkularizációról számoltak be, mint a kiújulás fő okáról,9 a változó méretű, számú és tekervényességű neovaszkuláris csatornák az esetek többségében a kiújuló varikozitásokba való visszaáramlásért felelősek.15 Bár egyesek kétségüket fejezték ki a valódi neovaszkularizáció valódiságát illetően, egyértelmű szövettani bizonyíték van arra, hogy a neovaszkularizáció a visszatérő varikózisok egyik oka.16 A korai jelentések ezzel szemben arra utalnak, hogy az endovenózus ablációs technikák nagyon alacsony neovaszkularizációs incidenciával járnak. 17 Lehetséges, hogy a neovaszkularizáció kialakulását nagymértékben megelőzi az ágyéki disszekció elkerülése és a normális junkcionális mellékágak vénás elvezetésének megőrzése.18,19
Az EVLA, akárcsak a rádiófrekvenciás abláció és a habszkleroterápia, a vénacsíkozás kevésbé invazív alternatívája. Az EVLA javallt ambuláns betegnél, akinek nagy, kis vagy járulékos szafénusz véna refluxa van, felszíni varixokkal és/vagy a felületes vénás elégtelenséggel kapcsolatos tünetekkel vagy szövődményekkel. Az EVLA-t rutinszerűen híg helyi érzéstelenítéssel, kiegészítő orális anxiolitikummal vagy anélkül, rendelői környezetben végzik. Az általában 30-60 percig tartó eljárás időtartama függ a kezelt szegmens hosszától, az operátor tapasztalatától és attól, hogy végeznek-e kiegészítő eljárásokat, például ambuláns flebektómiát. Függetlenül attól, hogy az alapjául szolgáló szafénusz inkompetenciát hogyan kezelik, általában kiegészítő kezelésekre van szükség a visszamaradt varixok kezeléséhez (1. ábra).
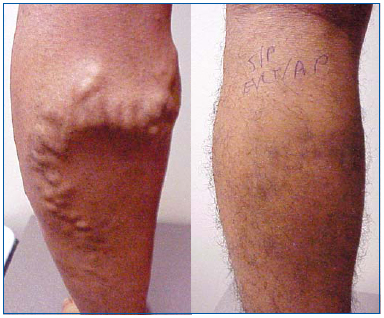
1. ábra. 26 éves férfi a nagy szafénusz véna endovenosus lézeres ablációja és a varikózus mellékvénák ambuláns phlebektomiája előtt és 1 hónappal után.
EREDMÉNYESSÉG
Az EVLA rövid- és középtávú vizsgálatai, függetlenül az alkalmazott hullámhossztól, figyelemre méltóan következetesnek tűnnek, jellemzően a refluxáló szaphénus vénák ablációjáról számolnak be az esetek 90%-ában vagy annál is több esetben.18,20-23 Kimutatták, hogy a véna saphenosa EVLA korrigálja vagy jelentősen javítja a krónikus vénás elégtelenség (CVI) hemodinamikai rendellenességeit és klinikai tüneteit a klinikai, etiológiai, anatómiai és patofiziológiai (CEAP) 3-6. klinikai osztályba sorolt, felületes vénás refluxban szenvedő betegeknél.24,25 A kimenetel egyenértékűnek vagy jobbnak tűnik, mint a strippingé, és a strippinghez képest a posztoperatív időszakban jobb életminőségi pontszámokkal rendelkezik.20,25-27. Magas betegelégedettségi arányról számoltak be.18,28,29 Az endovenosus eljárások összköltsége (az eljárás költsége plusz a társadalmi költségek) valószínűleg megegyezik a műtéttel vagy alacsonyabb annál.27
A GSV 810 nm-es és 940 nm-es készülékekkel történő kezeléséről szóló korai adatok szerint a kezelés kudarca ritka a > 70 J/cm-rel kezelt betegeknél.30,31 A 2 mm/sec elvonási sebesség 14 watt mellett 70 J/cm-t eredményez.
HATÁSMECHANIZMUS
A következő hullámhosszakat használják jelenleg az EVLA esetében: 810, 940, 980, 1064, 1319, 1320 és 2068 nm. Feltételezik, hogy a vénafal sérülését közvetlen hatás és közvetett módon, a vénában lévő kis mennyiségű vér felmelegedésével keletkező lézerindukált gőz közvetíti.32 Egyesek szerint a hullámhossz megválasztása nagyban befolyásolja az eredményeket.23
Az 1320 és 2078 nm-es lézerek fő kromofórja, legalábbis kezdetben, a víz, míg az EVLA-hoz használt többi hullámhossz elsősorban a hemoglobint célozza. Nyilvánvalóan elengedhetetlen a vénafal megfelelő termikus károsítása a hatékony abláció érdekében. Némi felmelegedés történhet a fotonenergia (sugárzás) közvetlen elnyelésével a vénafalon, valamint a gőzbuborékok konvekciója és a felmelegedett vér vezetése révén. Nem valószínű azonban, hogy ezek az utóbbi mechanizmusok teszik ki a vénára gyakorolt hatás többségét. A vér maximális hőmérséklete 100 °C. A lézerkezelésről megállapították, hogy a véna falának elszenesedését okozza.33 A lézerhegy elszenesedését, amely körülbelül 300°C-on következik be, az EVLA-t követően észlelték, és úgy tűnik, hogy az alkalmazott hullámhossztól függetlenül következik be.34 A lézerszál hegyének elszenesedése pontszerű hőforrást hoz létre, és lényegében nullára csökkenti a fény behatolását a szövetbe.34,35 Mordon és munkatársai megállapították: “A lézerenergia vér általi elnyelése által létrehozott gőz a véna falának károsításához szükséges energia parányi része, és nem lehet az endovenózus lézerrel a vénát ért sérülés elsődleges mechanizmusa. A vénafalon belüli karbonizáció és a vénafalon belüli traktus, amelyet az endovenózus lézert követően a szövettanban látunk, csak a lézerszál hegye és a vénafal közötti közvetlen érintkezés eredménye lehet. “36 Dr. Rox Anderson, a Massachusetts General Hospital The Wellman Center for Photomedicine igazgatója arról számolt be, hogy a szén másodlagos, de kulcsfontosságú kromofórnak tűnik, amely valószínűleg független a hullámhossztól (2. ábra).34 Megjegyzendő, hogy a szál hegye és alakja befolyásolhatja a karbonizáció kialakulását.37

2. ábra. A 600 mikronos lézerszálcsúcs karbonizációja 1320 nm-es lézerrel végzett endovenózus lézerabláció következtében (A fényképet Dr. Mark Forrestal, FACPh szíves hozzájárulásával).
TUMUSZENTES ANESZTÉZIA
Az EVLA-t helyi érzéstelenítésben kell végezni, nagy mennyiségű lidokain és adrenalin hígított oldatának (átlagosan 200-400 ml 0,1%-os lidokain 1:1 000 000 adrenalinnal) nagy mennyiségű, nátrium-bikarbonáttal pufferelt oldatával. Ezt az oldatot kézzel vagy infúziós pumpával kell adagolni ultrahangos irányítás mellett, hogy a vénát a kezelendő szegmens teljes hosszában körülvegye az érzéstelenítő folyadék (3. ábra).
A tumeszenciás érzéstelenítés előnyei az endovenózus ablációhoz a következők:
– érzéstelenítés,
– a kezelendő véna elkülönítése a környező struktúráktól,
– hőelnyelés, ami csökkenti a perivenózus szövetek csúcshőmérsékletét,
– vénakompresszió, ami maximalizálja a kezelés hatását a vénafalra.
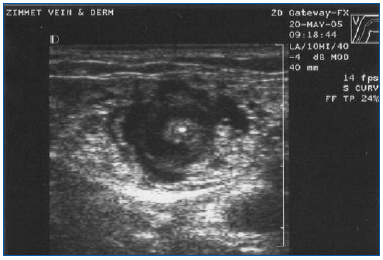
3. ábra. Transzverzális ultrahangkép a centrálisan elhelyezkedő nagy szafénuszvénát és a lézerszálat/szövetet körülvevő tumeszenciás érzéstelenítő folyadékról.
Noha a vénás beavatkozásoknál a tumeszenciás technikát alkalmazó lidokain maximális biztonságos dózisát nem vizsgálták jól, a 35 mg/kg-os dózis ésszerű becslésnek tekinthető.
Az említett paraméterek alkalmazásával a tumeszenciás érzéstelenítés a zsírleszívással összefüggésben rendkívül biztonságosnak bizonyult. További információ a http://www.liposuction.com/pharmacology/drug_inter act.php oldalon található.
AZ EVLA ellenjavallatai
Az EVLA technika ellenjavallatait az I. táblázat nyáriasan tartalmazza.

I. táblázat. Az endovenózus lézer kontraindikációi.
MELLÉKHATÁSOK
Rövid távú fájdalmat és ekchimózist gyakran észleltek az EVLA után. Egy retrospektív áttekintésben arról számoltak be, hogy az intermittáló impulzusú lézer szálak visszahúzása szignifikánsan nagyobb mértékű posztoperatív fájdalmat és véraláfutást okozott, mint a folyamatos visszahúzási protokoll.38 Az intermittáló üzemmódú EVLA-t követő 3 napig tartó rövid feszítőkötés hozzáadása jelentősen csökkentette a betegek által jelentett véraláfutást és fájdalmat. A folyamatos üzemmódú visszahúzás alkalmazása tovább csökkentette a fájdalom és a véraláfutás súlyosságát olyan mértékben, hogy a szintek hasonlóak voltak a rádiófrekvenciás ablációval kezelt betegek által jelentett szintekhez (II. és III. táblázat). Az előzetes jelentések szerint az EVLA elvégzéséhez használt hullámhossz függvényében bizonyos különbségek lehetnek a műtét utáni lefolyásban.22,39 Ez azonban rövid távú nyomon követéssel kapcsolatos gyér adatokon alapul.
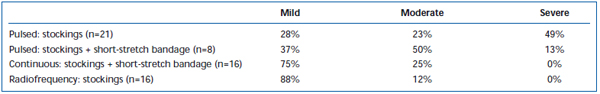
II. táblázat. A beteg által értékelt posztoperatív véraláfutás 3-7 nappal az impulzusos endovenózus lézerablációt (EVLA) követően II. osztályú harisnyával, impulzusos EVLA harisnyával plusz rövidnyújtó kötéssel, folyamatos üzemmódú EVLA harisnyával és rövidnyújtó kötéssel, valamint rádiófrekvenciás abláció harisnyával.
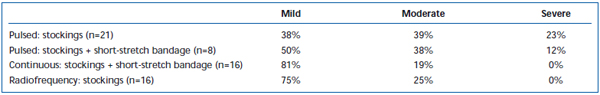
III. táblázat. A betegek által értékelt műtét utáni fájdalom 3-7 nappal az impulzusos endovenózus lézerablációt (EVLA) követően II. osztályú harisnyával, impulzusos EVLA harisnyával plusz rövid-nyújtott kötéssel, folyamatos üzemmódú EVLA harisnyával és rövid-nyújtott kötéssel, valamint rádiófrekvenciás abláció harisnyával.
PERIVENOUS THERMAL INJURY
Az EVLA során (kecske nyaki véna, 12 watt, 1 másodperces impulzusok, 1 másodperces időközök) mért átlagos intravaszkuláris csúcshőmérséklet a lézerheggyel egy vonalban átlagosan 729°C volt, míg a lézerheggyel 4 mm-re távolabb átlagosan 93°C.40 A kollaterális hőkárosodás kockázata azonban nem az intravaszkuláris hőmérséklettől, hanem a perivaszkuláris szövetmelegedéstől függ.
A kollagén körülbelül 50°C-on összehúzódik, míg a nekrózis 70°C és 100°C között következik be.41 A szövetek hőkárosodásának mértéke erősen függ attól, hogy a szövetet milyen mennyiségű és időtartamú hőnek teszik ki. Henriques és Moritz a 70°C-ig terjedő hőmérsékletnek kitett szövetek idő-hőmérséklet válaszát vizsgálta.42 Azt találták, hogy a bőr nagyon rövid expozíciós idő alatt is képes elviselni a hőmérséklet-emelkedést, és hogy a válasz logaritmikusnak tűnik, ahogy az expozíciós idő egyre rövidebb lesz. Például a testhőmérséklet 58°C-ra történő emelkedése a sejtek pusztulásához vezet, ha az expozíció 10 másodpercnél hosszabb ideig tart. A szövetek azonban akár 70°C-os hőmérsékletet is elviselnek, ha az expozíció időtartama 1 másodpercnél rövidebb ideig tart. Li és munkatársai arról számoltak be, hogy az endotélsejtek 10 percig tartó 48°C-ra történő melegítése nem okozott sejthalált.43 Azt is megállapították, hogy az oszteoblasztok 10 perces vagy annál rövidebb 45°C-os expozíciót követően átmeneti és reverzibilis változásokon mentek keresztül. Egy másik tanulmány egerek hátsó végtagjának reverzibilis szövetkárosodását állapította meg 44°C-os vízfürdőbe merítés után.44
Egy nemrégiben végzett vizsgálatban a külső vénafalon mértek csúcshőmérsékletet az EVLA során élő sertésfül vénában és exponált hátsó végtag vénákban.45 Az EVLA beállításai 8 watt (1-2 másodperces impulzusidő), 10 watt (1-1,5 másodperces impulzusidő), 12 watt (0,5-1,5 másodperces impulzusidő) és 15 watt (0,5-1,0 másodperces impulzusidő) között voltak, tumeszenciás érzéstelenítéssel és anélkül. Az eredmények azt mutatják, hogy a csúcshőmérséklet 34,6 °C és 49,1 °C között mozgott a leadott joule függvényében, a tumeszenciás folyadék jelenlétében alacsonyabb csúcshőmérsékleteket értek el (4. ábra).
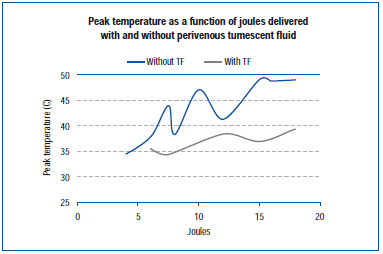
4. ábra. A Zimmet SE, Min RJ adataiból adaptálva. Hőmérsékletváltozások a perivenózus szövetben endovenózus lézeres kezelés során sertésmodellben. J Vasc Interv Radiol. 2003;14:911-915 (45. hivatkozás).
Az EVLA (63 beteg, 980 nm, 15 watt, 1,5 mp-es impulzusok) során mért csúcshőmérséklet a külső vénafalon emberben, 3 cm-rel a saphenofemorális csomópont alatt 40,9 °C, illetve 49,8 °C volt tumescens folyadékkal és anélkül46. Hasonló eredményekről számoltak be egy másik humán vizsgálatból az EVLA során (12 beteg, 810 nm, 12 W, 1 másodperces impulzusok, 1 másodperces időközök, tumeszcens technika), ahol a GSV-től 3 mm-re, 5 mm-re és 10 mm-re 43,3°C, 42,0°C és 36,0°C volt a csúcshőmérséklet. 47
Úgy tűnik, hogy az EVLA során a hőmérséklet rövid távolságokon nagyon gyorsan csökken. Ez valószínűleg ellentétben áll a rádiófrekvenciás energiával, ahol a mikrohullámú fűtés a szövet-elektróda határfelület körül történik. Az állati és humán adatok arra utalnak, hogy az endovenózus lézer során keletkező perivenózus csúcshőmérséklet a legtöbb esetben valószínűleg nem okoz maradandó károsodást a perivenózus szövetben. A keletkező csúcshőmérséklet csökken a perivenózus tumeszcens folyadék alkalmazásával. Úgy tűnik, hogy ezek az eredmények magyarázzák az idegsérülések és bőrégések nagyon alacsony jelentett előfordulását az EVLA-t követően. Egy 1064 nm-es Nd: YAG lézerrel végzett vizsgálatban 36,5%-ban nagyon magas paresztézia és 4,8%-ban bőrégés előfordulását jelentették.48 Meg kell jegyezni, hogy a leadott energia mennyisége körülbelül háromszor nagyobb volt, mint amit általában használnak, és hogy a kezelést tumeszcens érzéstelenítés nélkül végezték. Az EVLA során jelentett alacsony perivenosus hőmérséklet ellenére fontos megjegyezni, hogy különös óvatosságra van szükség, amikor az endovenosus beavatkozást bizonyos esetekben, például az isiászideg varixoknál fontolgatják.49,50
MAGAS KOMPLIKÁCIÓK
Az EVLA-t követő súlyos szövődményekről ritkán számoltak be. A mélyvénás trombózis (DVT) aránya több sorozatból összesítve sokkal alacsonyabb, mint 1%.17,18,20,28 Egy csoport a trombus combvénába való kiterjedésének 7,7%-os előfordulását jelentette.51 Ebben a tanulmányban azonban az EVLA-t általános vagy gerincvelői érzéstelenítésben végezték. Az a tény, hogy a betegek a műtét után nem tudtak azonnal járni, hozzájárulhatott a trombus kiterjedésének magas előfordulási gyakoriságához. Egyetlen esetben számoltak be arteriovenosus fisztuláról, amely a rövid szafénusz véna (SSV) EVLA után alakult ki.52 Egy betegnél szeptikus tromboflebitisz alakult ki a perforátorok nyílt ligációjával és szúróflebektómiával kombinált EVLA-t követően.53 Ez antibiotikumos kezeléssel és debridementtel megszűnt.
ALTERNATÍV MEGKÖZELÍTÉSEK
Az EVLA és a rádiófrekvenciás abláció (RFA)54,55 egyaránt a saphenus inkompetencia hatékony kezelésének tűnik. Az EVLA előnyei az RFA-val szemben a rövidebb eljárási idő és az alacsonyabb kezelési költség. Az EVLA jelentett elzáródási arányai általában valamivel magasabbak, mint az RFA-val elért arányok.56 Az EVLA hátrányai közé tartozhat a több véraláfutás és kellemetlen érzés a korai posztoperatív időszakban, bár ez technikától függhet. Mindkét technikát folyamatosan finomítják, ami javítja az eredményeket. Mindkét eljárás, ha tumeszenciás érzéstelenítésben végzik, alacsony szövődményszámmal jár.
A saphena reflux másik új keletű kezelése az ultrahangos kontroll alatt beadott habosított szklerozánsok alkalmazása. Egy gáz, például levegő vagy CO2 keverhető folyékony mosószeres szklerotizálószerekkel, hogy habot hozzanak létre, amely a becslések szerint körülbelül négyszer hatásosabb, mint ugyanezen szer folyékony formája. A korai eredmények azt sugallják, hogy ez egy értékes módszer lehet, mivel gyorsan és olcsón elvégezhető, és a jelentett rövid és középtávú sikerességi arányok körülbelül 75% és 90% között vannak. A habosítással kapcsolatban számos változó létezik (pl. a gáz típusa és mennyisége, a habosításhoz használt technika, a használt szklerotizálószer koncentrációja és típusa, a beadott mennyiség stb.) A habos szkleroterápiát követően nagyobb lehet a mélyvénás trombózis kockázata a hagyományos szkleroterápiához képest. A megfelelő technika fontos e szövődmény kockázatának minimalizálásához. A habszkleroterápiát követően jelentett egyéb mellékhatások közé tartoznak a vizuális és neurológiai események. Van egy publikált beszámoló a habszkleroterápiát (20 ml polidocanol hab) követő stroke-ról egy 1,8 cm-es nyitott foramen ovale-val rendelkező betegnél.57 Az ezzel a móddal kapcsolatos további tapasztalatok és kutatások jobban meg fogják határozni a kockázatokat, valamint a hosszú távú hatékonyságot.
Összefoglalás
A visszerek kezelésének jelenleg elfogadott elvei a hemodinamikai és a beteg szempontjából a lehető legjobb eredményeket szolgálják, miközben minimalizálják a kiújulás kockázatát. A visszerek megfelelő kezelése a mögöttes vénás patológia pontos felmérésével és a vénás hipertónia forrásainak azonosításával kezdődik. A kezelés céljai közé tartozik a mély és a felszíni rendszer közötti inkompetens kapcsolatok megszüntetése, valamint a vénás inkompetencia útjainak és az inkompetens visszereknek az eltüntetése. Nyilvánvaló, hogy a kiújulás csökken, ha a szafénusz törzs inkompetens szegmensét abláljuk.
A vénás strippelés kevésbé invazív alternatívája az endovenosus lézerabláció. A kimenetel egyenértékűnek vagy jobbnak tűnik, mint a strippelésé, a műtét utáni időszakban jobb életminőségi értékekkel. Kimutatták, hogy az EVLA korrigálja vagy jelentősen javítja a hemodinamikai rendellenességet a felületes vénás refluxszal járó krónikus vénás elégtelenségben szenvedő betegeknél. A korai jelentések szerint az endovenózus ablációs technikák – a sebészi strippeléssel ellentétben – a neovaszkularizáció alacsony előfordulási gyakoriságával járnak.
A tumeszenciás érzéstelenítés elveinek alkalmazása a vénás kezelésekre, valamint az endovenosus ablációs technikák kifejlesztése lehetőséget nyújt arra, hogy a felületes vénás elégtelenségben szenvedő betegek túlnyomó többségét általános érzéstelenítés vagy sebészeti metszés nélkül, a rendelőben kezeljük, ugyanakkor maximalizáljuk az eredményeket és minimalizáljuk a kiújulást.
Ezt a cikket 2006. július 29-én nyújtották be.

2. Large J. A saphena varixok sebészi kezelése, a nagy saphena főtörzs megőrzésével. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. A hosszú véna saphenosus és a nervus saphenosus anatómiai kapcsolata. Jelentősége a radikális varikózsebészet szempontjából. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. A maradék véna saphenosus sorsa részleges eltávolítás vagy ligálás után. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. A hosszú szafénusz véna stripping nélküli ligálás objektív értékelése. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. A hosszú véna saphenosa strippelésének értékelése a primer varikózus vénák kezelésében. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. Lecsupaszítani vagy nem lecsupaszítani a hosszú szafenosus vénát? Egy varikózus vénás vizsgálat. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. A neovaszkularizáció a varikózis kiújulásának fő oka: a hosszú szafénusz véna strippelésének randomizált vizsgálatának eredményei. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. A hosszú véna saphenosus strippelése csökkenti a visszatérő varikózisok miatt végzett újbóli műtétek arányát: egy randomizált vizsgálat ötéves eredményei. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. A varikózis kiújulásának okai: a hosszú szafénusz véna strippelésének randomizált, kontrollált vizsgálatának késői eredményei. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. A hosszú véna saphenosa strippelésének okai. Phlebologie. 1988;41:766-769.
13. Neglen P. A szafenosus eredetű varikozitások kezelése: a ligálás, a szelektív kimetszés és a szkleroterápia összehasonlítása. In: Bergan JJ, Goldman MP eds. Varicose Veins and Telangiectasias: Diagnosis and Treatment. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a vaszkuláris sebészet egy gyakori és összetett problémájának új értékelése. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovaszkularizáció és visszatérő varikózis: újabb szövettani és ultrahangos bizonyítékok. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetens saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. A saphena vena saphena reflux endovenosus lézeres kezelése: hosszú távú eredmények. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenosus terápia-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Az olasz endovenosus-lézeres munkacsoport (IEWG) első 1000 esete. Indoklás, és hosszú távú eredmények az 1999-2003 közötti időszakban. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Tizenöt évvel ezelőtt a lézer állítólag artériákat nyitott, most pedig vénákat zár: mi a valóság az eszköz mögött? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (vita 9- 10).
22. Kabnick LS. A különböző endovenosus lézerhullámhosszúságok eredményei a nagy szafénusz véna ablációjában. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. A nagy véna saphenosus intravaszkuláris 1320 nm-es lézerrel történő lezárása: 6-12 hónapos követéses vizsgálat. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenosus saphenosus abláció korrigálja a hemodinamikai rendellenességet CEAP 3-6 klinikai osztályú CVI-ben szenvedő, felületes reflux miatt kialakult betegeknél. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. A nagy szafénusz véna 810 nm-es lézerrel történő endovenosus kezelés és a hagyományos strippelés összehasonlítása primer varikózisban szenvedő betegeknél. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose veins. Phlebology. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins: early results from a large single-center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. A nagy szafénusz véna nem záródása és korai újranyílása endovenózus lézerkezelést követően fluenciafüggő. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. A nagyobb energiaszállítás javítja az inkompetens szafénusz vénák endovenózus lézerkezelésének kezelési sikerét. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. A belső vénafal hőkárosodása endovenózus lézerkezelés során: az intravascularis vér által történő energiaelnyelés kulcsszerepe. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. A szafénusz véna elégtelenség endoluminális kezelését követő rádiófrekvenciás és lézeres (980 nm) hatások vizsgálata ex-vivo modellben. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenózus lézer: a hatásmechanizmus. Előadás az Amerikai Bőrgyógyászati Akadémia éves ülésén; 2006. március 3-7.; San Francisco, Kalifornia, USA.
35. Izzo F. Egyéb termikus ablációs technikák: a májdaganatok mikrohullámú és interstitiális lézerablációja. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B és Zemmouri J. Az endovenózus lézeres kezelés (ELT) matematikai modellezése. BioMedical Engineering OnLine. 2006;5:26. Elérhető a következő címen: http://www.biomedical-engineeringonline. com/content/5/1/26. Hozzáférés 2006. július 19.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Kísérleti tanulmány a diodelézerrel indukált termokoagulációról a májszöveten szkenner szálheggyel. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Fájdalom, véraláfutás és rövid távú hatékonyság a vena saphena saphena nagyobb endovenosus lézerkezelése után: a műtéti technika és a posztoperatív ellátás hatása. Előadás az American College of Phlebology 16. éves kongresszusán; 2002. november 7-10.; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. A nagy véna saphenosus endovenosus kezelése 1320 nm-es Nd:YAG lézerrel kevesebb mellékhatást okoz, mint 940 nm-es diódalézerrel. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Nagy vénák endovenosus rádiófrekvenciás és 810 nm-es diódalézerrel történő elzárásának összehasonlítása állatmodellben. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Lézeres bemetszéses sebészet. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. A hősérülések tanulmányozása II: az idő és a felületi hőmérséklet relatív jelentősége a hámsérülések okozásában. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Hősokk indukálta nekrózis és apoptózis osteoblastokban. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Egérlábak bőrének és bőr alatti szöveteinek hisztopatológiai változásai hipertermia kezelést követően. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Hőmérsékletváltozások a perivenózus szövetekben endovenózus lézerkezelés során sertésmodellben. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. A perivenózus hőmérséklet termometriai vizsgálata a varikózus vénák endovenózus lézerterápiája során. Előadás az Union Internationale de Phlébologie 15. világkongresszusán; 2005. október 2-7.; Rio de Janeiro, Brazília.
47. Beale RJ, Mavor AID, Gough MJ. Hőelvezetés a varikózus vénák endovenózus lézeres kezelése során – fennáll-e az idegsérülés veszélye? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenózus lézeres fotokoaguláció (EVLP) varikózus vénák kezelésére. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Az ülőideg visszerek. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Az ülőideg és ágainak ultrahangos megfigyelése a fossa poplitealisnál: mindig látható, sosem látható. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. A saphena thrombus kiterjesztése a combvénába: az új endovenosus ablációs technikák lehetséges szövődménye. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenosus fisztula a rövid véna saphenosus endovenosus lézeres kezelése után. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffúz phlegmonosus phlebitis a nagy véna saphenosus endovenosus lézerkezelése után. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. A saphena saphena reflux endovaszkuláris obliterációja: multicentrikus vizsgálat. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenosus lézerterápia és rádiófrekvenciás abláció a nagy szafenosus vénában: a korai hatékonyság és a szövődmények elemzése. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.