Læringsmål
- Beskriv elektronernes opførsel og placering, og hvordan disse faktorer påvirker bindingsdannelsen mellem atomer
Elektronskaller og Bohr-modellen

Figur 1. Bohr-modellen.
Det skal understreges, at der er en sammenhæng mellem antallet af protoner i et grundstof, atomnummeret, der adskiller et grundstof fra et andet, og antallet af elektroner, som det har. I alle elektrisk neutrale atomer er antallet af elektroner det samme som antallet af protoner. Således har hvert grundstof, i det mindste når det er elektrisk neutralt, et karakteristisk antal elektroner svarende til dets atomnummer.
En tidlig model af atomet blev udviklet i 1913 af den danske videnskabsmand Niels Bohr (1885-1962). I denne model findes elektronerne i hovedskaller. En elektron befinder sig normalt i den lavenergiskal, der er tilgængelig, og som er den, der er tættest på kernen. Energi fra en lysfoton kan bringe den op i en højere energiskal, men denne situation er ustabil, og elektronen henfalder hurtigt tilbage til grundtilstanden. I processen frigives en lysfoton.
Den Bohrske model viser atomet som en central kerne, der indeholder protoner og neutroner, med elektronerne i cirkulære orbitaler i bestemte afstande fra kernen, som illustreret i figur 1. Disse baner danner elektronskaller eller energiniveauer, som er en måde at visualisere antallet af elektroner i de yderste skaller på. Disse energiniveauer betegnes med et tal og symbolet “n”. F.eks. repræsenterer 1n det første energiniveau, der er placeret tættest på kernen.
Elektronerne fylder orbitalerne i en konsekvent rækkefølge: de fylder først orbitalerne tættest på kernen, hvorefter de fortsætter med at fylde orbitaler med stigende energi længere væk fra kernen. Hvis der er flere orbitaler med samme energi, vil de blive fyldt med en elektron i hvert energiniveau, før en anden elektron tilføjes. Elektronerne i det yderste energiniveau bestemmer atomets energimæssige stabilitet og dets tendens til at danne kemiske bindinger med andre atomer for at danne molekyler.
Under standardbetingelser fylder atomerne de indre skaller først, hvilket ofte resulterer i et variabelt antal elektroner i den yderste skal. Den inderste skal har højst to elektroner, men de to næste elektronskaller kan hver have højst otte elektroner. Dette er kendt som oktetreglen, som med undtagelse af den inderste skal siger, at at atomer er mere stabile energimæssigt, når de har otte elektroner i deres valensskal, den yderste elektronskal. Eksempler på nogle neutrale atomer og deres elektronkonfigurationer er vist i figur 2. Bemærk, at helium i denne figur har en komplet ydre elektronskal med to elektroner, der udfylder den første og eneste elektronskal. På samme måde har neon en komplet ydre 2n-skal med otte elektroner. I modsætning hertil har klor og natrium henholdsvis syv og én i deres ydre skal, men teoretisk set ville de være mere energimæssigt stabile, hvis de fulgte oktetreglen og havde otte.
Praktikspørgsmål
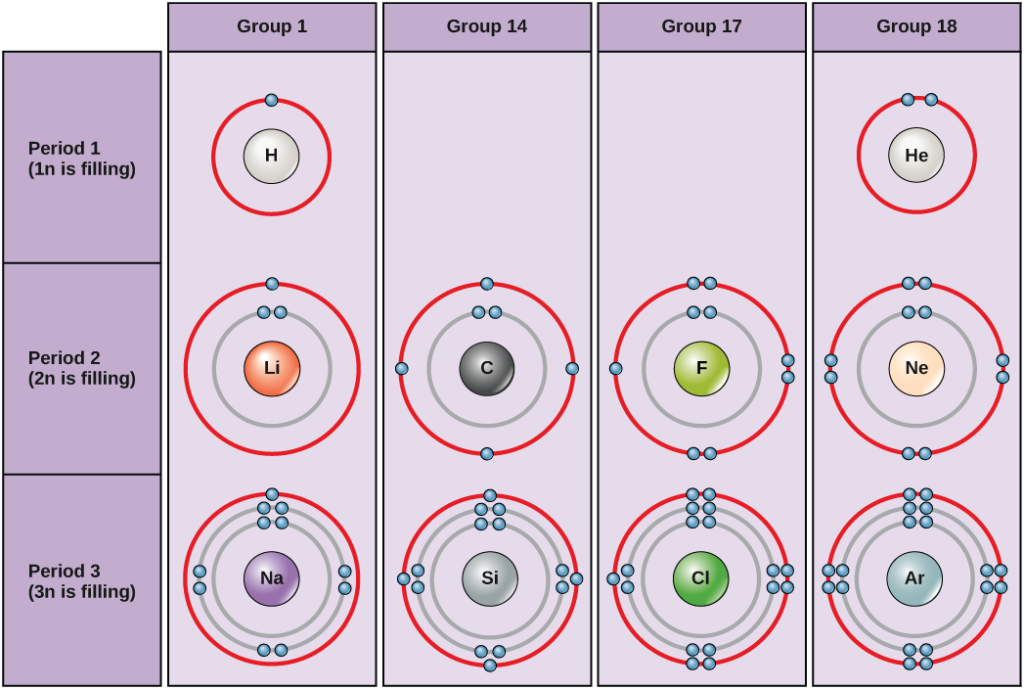
Figur 2. Bohr-diagrammer for brint, helium, lithium, kulstof, fluor, neon, natrium, silicium, klor og argon.
Bohr-diagrammer angiver, hvor mange elektroner der fylder hver hovedskal. Elementer i gruppe 18 (helium, neon og argon er vist i figur 2) har en fuld ydre skal, eller valensskal. En fuld valensskal er den mest stabile elektronkonfiguration. Elementer i andre grupper har delvist fyldte valensskaller og får eller mister elektroner for at opnå en stabil elektronkonfiguration.
Et atom kan give, tage eller dele elektroner med et andet atom for at opnå en fuld valensskal, den mest stabile elektronkonfiguration. Hvis du ser på denne figur, hvor mange elektroner skal grundstofferne i gruppe 1 så miste for at opnå en stabil elektronkonfiguration? Hvor mange elektroner skal grundstofferne i gruppe 14 og 17 have for at opnå en stabil konfiguration?
Den forståelse af, at det periodiske systems opbygning er baseret på det samlede antal protoner (og elektroner), hjælper os med at vide, hvordan elektronerne er fordelt i den ydre skal. Det periodiske system er inddelt i kolonner og rækker baseret på antallet af elektroner, og hvor disse elektroner er placeret. Se nærmere på nogle af grundstofferne i det periodiske systems kolonne yderst til højre i figur 3.

Figur 3. Det periodiske system viser den atomare masse og atomnummeret for hvert grundstof. Atomnummeret står over symbolet for grundstoffet, og den omtrentlige atommasse står under det.
Gruppe 18-atomerne helium (He), neon (Ne) og argon (Ar) har alle fyldte ydre elektronskaller, hvilket gør det unødvendigt for dem at dele elektroner med andre atomer for at opnå stabilitet; de er meget stabile som enkeltstående atomer. Deres manglende reaktivitet har resulteret i, at de er blevet kaldt de inerte gasser (eller ædelgasser). Sammenlign dette med grundstofferne i gruppe 1 i venstre kolonne. Disse grundstoffer, herunder hydrogen (H), lithium (Li) og natrium (Na), har alle én elektron i deres yderste hylster. Det betyder, at de kan opnå en stabil konfiguration og en fyldt ydre skal ved at afgive eller dele en elektron med et andet atom eller et molekyle som f.eks. vand. Brint vil donere eller dele sin elektron for at opnå denne konfiguration, mens lithium og natrium vil donere deres elektron for at blive stabile. Som følge af at de mister en negativt ladet elektron, bliver de positivt ladede ioner. Grundstoffer i gruppe 17, herunder fluor og klor, har syv elektroner i deres yderste skal, så de har en tendens til at fylde denne skal med en elektron fra andre atomer eller molekyler, hvilket gør dem til negativt ladede ioner. Elementer i gruppe 14, hvoraf kulstof er det vigtigste for levende systemer, har fire elektroner i deres yderste skal, hvilket gør det muligt for dem at lave flere kovalente bindinger (omtalt nedenfor) med andre atomer. Således repræsenterer kolonnerne i det periodiske system den potentielle fælles tilstand i disse grundstoffers ydre elektronskaller, som er ansvarlig for deres ensartede kemiske egenskaber.
Elektronorbitaler
Og selv om den er nyttig til at forklare visse grundstoffers reaktivitet og kemiske binding, afspejler Bohr-modellen af atomet ikke nøjagtigt, hvordan elektronerne er rumligt fordelt omkring kernen. De kredser ikke om kernen, som jorden kredser om solen, men befinder sig i elektronorbitaler. Disse relativt komplekse former skyldes, at elektroner ikke blot opfører sig som partikler, men også som bølger. Matematiske ligninger fra kvantemekanikken, kendt som bølgefunktioner, kan med en vis sandsynlighed forudsige, hvor en elektron kan befinde sig på et givet tidspunkt. Det område, hvor en elektron har størst sandsynlighed for at befinde sig, kaldes dens orbital.

Figur 4. Klik for et større billede. s-delskallerne er formet som kugler. Både 1n- og 2n-hovedskalerne har et s-orbital, men kuglens størrelse er større i 2n-orbitalet. Hver kugle er en enkelt orbital. p-underskaller består af tre dumbbell-formede orbitaler. Hovedskal 2n har en p-underskal, men det har skal 1 ikke.
Husk, at Bohr-modellen skildrer et atomers elektronskalkonfiguration. Inden for hver elektronskal er der underskaller, og hver underskal har et bestemt antal orbitaler, der indeholder elektroner. Selv om det er umuligt at beregne nøjagtigt, hvor en elektron befinder sig, ved forskerne, at den højst sandsynligt befinder sig inden for sin orbitalbane. Delskaller betegnes med bogstaverne s, p, d og f. Delskallen s er kugleformet og har én orbital. Hovedskal 1n har kun en enkelt s-orbital, som kan indeholde to elektroner. Hovedskal 2n har en s- og en p-underskal og kan indeholde i alt otte elektroner. p-underskallen har tre dumbbell-formede orbitaler, som illustreret i figur 4. Underskaller d og f har mere komplekse former og indeholder henholdsvis fem og syv orbitaler. De er ikke vist i illustrationen. Hovedskal 3n har s-, p- og d-underskaller og kan indeholde 18 elektroner. Hovedskal 4n har s-, p-, d- og f-orbitaler og kan indeholde 32 elektroner. Når man bevæger sig væk fra kernen, øges antallet af elektroner og orbitaler i energiniveauerne. Hvis man går fra et atom til det næste i det periodiske system, kan elektronstrukturen udarbejdes ved at indpasse en ekstra elektron i den næste tilgængelige orbital.
Den nærmeste orbital til kernen, kaldet 1s orbital, kan rumme op til to elektroner. Denne orbital svarer til den inderste elektronskal i Bohr-modellen af atomet. Den kaldes 1s-bobitalet, fordi den er kugleformet omkring kernen. 1s-bobitalet er det orbital, der er tættest på kernen, og det fyldes altid først, før andre orbitaler kan fyldes. Brint har én elektron; derfor er der kun én plads i 1s-bobitalet besat. Dette betegnes som 1s1, hvor 1 med overstregning henviser til den ene elektron i 1s-bobitalet. Helium har to elektroner; derfor kan det fylde 1s-bobitalet fuldstændigt med sine to elektroner. Dette betegnes som 1s2, idet der henvises til heliums to elektroner i 1s-bobitalet. På det periodiske systems figur 4 er hydrogen og helium de eneste to grundstoffer i den første række (periode); det skyldes, at de kun har elektroner i deres første skal, 1s-bobitalet. Brint og helium er de eneste to grundstoffer, der har 1s og ingen andre elektronorbitaler i den elektrisk neutrale tilstand.
Den anden elektronskal kan indeholde otte elektroner. Denne skal indeholder endnu en kugleformet s-orbital og tre “dumbbell”-formede p-orbitaler, som hver kan indeholde to elektroner, som vist i figur 4. Når 1s orbitalet er fyldt, fyldes den anden elektronskal, idet først dens 2s orbital og derefter dens tre p orbitaler fyldes. Når p-orbitalerne fyldes, tager de hver en enkelt elektron; når hver p-orbital har en elektron, kan der tilføjes en anden elektron. Lithium (Li) indeholder tre elektroner, der besætter den første og anden hylde. To elektroner fylder 1s-bobitalet, og den tredje elektron fylder derefter 2s-bobitalet. Dens elektronkonfiguration er 1s22s1. Neon (Ne) har på den anden side i alt ti elektroner: to er i dets inderste 1s orbital og otte fylder dets anden skal (to i hver 2s og tre p orbitaler); det er således en inert gas og energimæssigt stabilt som et enkelt atom, der sjældent vil danne en kemisk binding med andre atomer. Større grundstoffer har yderligere orbitaler, som udgør den tredje elektronskal. Mens begreberne elektronskaller og orbitaler er nært beslægtede, giver orbitaler en mere præcis skildring af et atoms elektronkonfiguration, fordi orbitalmodellen specificerer de forskellige former og særlige orienteringer af alle de pladser, som elektroner kan indtage.
Se denne visuelle animation for at se den rumlige placering af p- og s-orbitalerne. Bemærk, at denne video ikke har lyd.
Du kan se lydbeskrivelsesteksten til “Atomic Orbitals – Electron Configuration of Scandium” her (åbner i nyt vindue).
Video gennemgang
Denne video giver endnu et overblik over elektronerne:
Prøv det
Bidrag!
Forbedre denne sideLær mere