Resultados de aprendizaje
- Describir el comportamiento y la ubicación de los electrones, y cómo estos factores influyen en la formación de enlaces entre los átomos
Capas de electrones y el modelo de Bohr

Figura 1. El modelo de Bohr.
Hay que destacar que existe una conexión entre el número de protones de un elemento, el número atómico que distingue a un elemento de otro, y el número de electrones que tiene. En todos los átomos eléctricamente neutros, el número de electrones es el mismo que el número de protones. Así, cada elemento, al menos cuando es eléctricamente neutro, tiene un número característico de electrones igual a su número atómico.
Un primer modelo del átomo fue desarrollado en 1913 por el científico danés Niels Bohr (1885-1962). En este modelo, los electrones existen dentro de las capas principales. Un electrón se encuentra normalmente en la capa de menor energía disponible, que es la más cercana al núcleo. La energía de un fotón de luz puede elevarlo a una envoltura de mayor energía, pero esta situación es inestable y el electrón decae rápidamente al estado básico. En el proceso, se libera un fotón de luz.
El modelo de Bohr muestra el átomo como un núcleo central que contiene protones y neutrones, con los electrones en orbitales circulares a distancias específicas del núcleo, como se ilustra en la figura 1. Estas órbitas forman las capas de electrones o niveles de energía, que son una forma de visualizar el número de electrones en las capas más externas. Estos niveles de energía se designan con un número y el símbolo «n». Por ejemplo, 1n representa el primer nivel de energía situado más cerca del núcleo.
Los electrones llenan los orbitales en un orden coherente: primero llenan los orbitales más cercanos al núcleo, y luego continúan llenando orbitales de energía creciente más alejados del núcleo. Si hay varios orbitales de igual energía, se llenarán con un electrón en cada nivel de energía antes de añadir un segundo electrón. Los electrones del nivel de energía más externo determinan la estabilidad energética del átomo y su tendencia a formar enlaces químicos con otros átomos para formar moléculas.
En condiciones estándar, los átomos llenan primero las capas internas, lo que a menudo resulta en un número variable de electrones en la capa más externa. La capa más interna tiene un máximo de dos electrones, pero las dos capas siguientes pueden tener un máximo de ocho electrones cada una. Esto se conoce como la regla del octeto, que establece, con la excepción de la capa más interna, que los átomos son más estables energéticamente cuando tienen ocho electrones en su capa de valencia, la capa de electrones más externa. En la figura 2 se muestran ejemplos de algunos átomos neutros y sus configuraciones electrónicas. Obsérvese que en esta figura, el helio tiene una capa exterior de electrones completa, con dos electrones llenando su primera y única capa. Del mismo modo, el neón tiene una capa exterior 2n completa que contiene ocho electrones. En cambio, el cloro y el sodio tienen siete y uno en sus capas exteriores, respectivamente, pero teóricamente serían más estables energéticamente si siguieran la regla del octeto y tuvieran ocho.
Pregunta de práctica
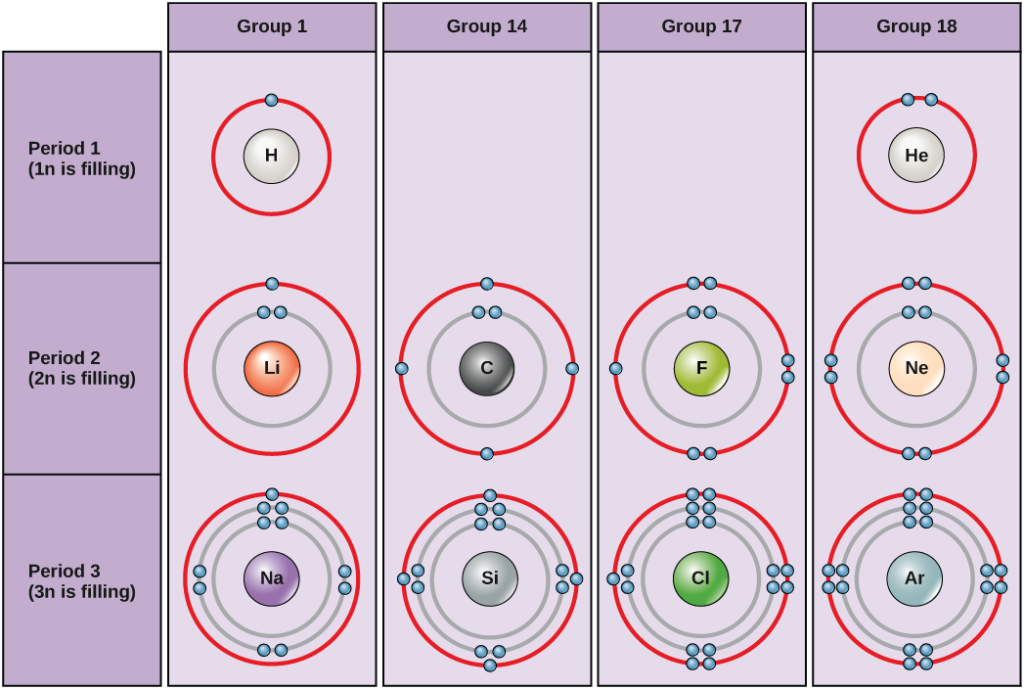
Figura 2. Diagramas de Bohr para el hidrógeno, el helio, el litio, el carbono, el flúor, el neón, el sodio, el silicio, el cloro y el argón.
Los diagramas de Bohr indican cuántos electrones llenan cada capa principal. Los elementos del grupo 18 (el helio, el neón y el argón se muestran en la figura 2) tienen una capa exterior o de valencia completa. Una capa de valencia completa es la configuración de electrones más estable. Los elementos de otros grupos tienen cáscaras de valencia parcialmente llenas y ganan o pierden electrones para lograr una configuración electrónica estable.
Un átomo puede dar, tomar o compartir electrones con otro átomo para lograr una cáscara de valencia completa, la configuración electrónica más estable. Observando esta figura, ¿cuántos electrones tienen que perder los elementos del grupo 1 para conseguir una configuración electrónica estable? ¿Cuántos electrones necesitan ganar los elementos de los grupos 14 y 17 para conseguir una configuración estable?
Entender que la organización de la tabla periódica se basa en el número total de protones (y electrones) nos ayuda a saber cómo se distribuyen los electrones entre la capa exterior. La tabla periódica se organiza en columnas y filas en función del número de electrones y del lugar en el que éstos se encuentran. Observa detenidamente algunos de los elementos de la columna de la extrema derecha de la tabla periódica en la Figura 3.

Figura 3. La tabla periódica muestra la masa atómica y el número atómico de cada elemento. El número atómico aparece encima del símbolo del elemento y la masa atómica aproximada aparece debajo.
Los átomos del grupo 18, el helio (He), el neón (Ne) y el argón (Ar), tienen las capas externas de electrones llenas, por lo que no es necesario que compartan electrones con otros átomos para alcanzar la estabilidad; son muy estables como átomos individuales. Su falta de reactividad ha hecho que reciban el nombre de gases inertes (o gases nobles). Compárese con los elementos del grupo 1 de la columna de la izquierda. Estos elementos, entre los que se encuentran el hidrógeno (H), el litio (Li) y el sodio (Na), tienen un electrón en sus capas más externas. Esto significa que pueden alcanzar una configuración estable y una capa exterior llena donando o compartiendo un electrón con otro átomo o una molécula como el agua. El hidrógeno donará o compartirá su electrón para lograr esta configuración, mientras que el litio y el sodio donarán su electrón para volverse estables. Como resultado de la pérdida de un electrón con carga negativa, se convierten en iones con carga positiva. Los elementos del grupo 17, entre los que se encuentran el flúor y el cloro, tienen siete electrones en sus capas más externas, por lo que tienden a llenar esta capa con un electrón de otros átomos o moléculas, convirtiéndose en iones con carga negativa. Los elementos del grupo 14, de los que el carbono es el más importante para los sistemas vivos, tienen cuatro electrones en su capa exterior, lo que les permite establecer varios enlaces covalentes (de los que hablaremos más adelante) con otros átomos. Así, las columnas de la tabla periódica representan el estado potencial compartido de las capas externas de electrones de estos elementos que es responsable de sus características químicas similares.
Orbitales de electrones
Aunque es útil para explicar la reactividad y el enlace químico de ciertos elementos, el modelo de Bohr del átomo no refleja con exactitud cómo se distribuyen espacialmente los electrones alrededor del núcleo. No rodean el núcleo como la tierra orbita el sol, sino que se encuentran en orbitales de electrones. Estas formas relativamente complejas se deben a que los electrones no se comportan sólo como partículas, sino también como ondas. Las ecuaciones matemáticas de la mecánica cuántica, conocidas como funciones de onda, pueden predecir con un cierto nivel de probabilidad dónde puede estar un electrón en un momento dado. La zona en la que es más probable que se encuentre un electrón se llama su orbital.

Figura 4. Haga clic para ampliar la imagen. Las subesferas s tienen forma de esfera. Tanto el caparazón principal 1n como el 2n tienen un orbital s, pero el tamaño de la esfera es mayor en el orbital 2n. Cada esfera es un único orbital. Las subcáscaras p están formadas por tres orbitales en forma de campana. El caparazón principal 2n tiene un subcaparazón p, pero el caparazón 1 no lo tiene.
Recordemos que el modelo de Bohr representa la configuración de caparazón de los electrones de un átomo. Dentro de cada cáscara de electrones hay subcáscaras, y cada subcáscara tiene un número específico de orbitales que contienen electrones. Aunque es imposible calcular exactamente dónde se encuentra un electrón, los científicos saben que lo más probable es que se encuentre dentro de su trayectoria orbital. Las subcubiertas se designan con las letras s, p, d y f. La subcubierta s tiene forma esférica y un orbital. La capa principal 1n tiene un solo orbital s, que puede contener dos electrones. La capa principal 2n tiene una subcapa s y una p, y puede contener un total de ocho electrones. La subcáscara p tiene tres orbitales en forma de campana, como se ilustra en la figura 4. Las subcubiertas d y f tienen formas más complejas y contienen cinco y siete orbitales, respectivamente. No se muestran en la ilustración. La capa principal 3n tiene subcubiertas s, p y d y puede contener 18 electrones. La capa principal 4n tiene orbitales s, p, d y f y puede contener 32 electrones. Al alejarse del núcleo, el número de electrones y orbitales que se encuentran en los niveles de energía aumenta. Al pasar de un átomo a otro en la tabla periódica, la estructura electrónica puede calcularse encajando un electrón adicional en el siguiente orbital disponible.
El orbital más cercano al núcleo, llamado orbital 1s, puede contener hasta dos electrones. Este orbital equivale a la capa de electrones más interna del modelo de Bohr del átomo. Se llama orbital 1s porque es esférico alrededor del núcleo. El orbital 1s es el más cercano al núcleo y siempre se llena primero, antes de que pueda llenarse cualquier otro orbital. El hidrógeno tiene un electrón; por lo tanto, sólo tiene un punto dentro del orbital 1s ocupado. Esto se designa como 1s1, donde el superíndice 1 se refiere al único electrón dentro del orbital 1s. El helio tiene dos electrones; por lo tanto, puede llenar completamente el orbital 1s con sus dos electrones. Esto se designa como 1s2, refiriéndose a los dos electrones del helio en el orbital 1s. En la figura 4 de la tabla periódica, el hidrógeno y el helio son los dos únicos elementos de la primera fila (período); esto se debe a que sólo tienen electrones en su primera capa, el orbital 1s. El hidrógeno y el helio son los únicos dos elementos que tienen el 1s y ningún otro orbital electrónico en el estado eléctricamente neutro.
La segunda capa de electrones puede contener ocho electrones. Esta capa contiene otro orbital s esférico y tres orbitales p en forma de «campana», cada uno de los cuales puede contener dos electrones, como se muestra en la figura 4. Después de llenar el orbital 1s, se llena la segunda capa de electrones, llenando primero su orbital 2s y luego sus tres orbitales p. Al llenar los orbitales p, cada uno toma un solo electrón; una vez que cada orbital p tiene un electrón, se puede añadir un segundo. El litio (Li) contiene tres electrones que ocupan los orbitales 1 y 2. Dos electrones llenan el orbital 1s, y el tercer electrón llena el orbital 2s. Su configuración electrónica es 1s22s1. El neón (Ne), por otro lado, tiene un total de diez electrones: dos están en su orbital 1s más interno y ocho llenan su segunda capa (dos en el orbital 2s y tres en el orbital p); por lo tanto, es un gas inerte y energéticamente estable como un solo átomo que raramente formará un enlace químico con otros átomos. Los elementos más grandes tienen orbitales adicionales, que constituyen la tercera capa de electrones. Aunque los conceptos de cáscaras de electrones y orbitales están estrechamente relacionados, los orbitales proporcionan una representación más precisa de la configuración de electrones de un átomo porque el modelo orbital especifica las diferentes formas y orientaciones especiales de todos los lugares que pueden ocupar los electrones.
Mira esta animación visual para ver la disposición espacial de los orbitales p y s. Tenga en cuenta que este vídeo no tiene audio.
Puede ver el texto de descripción de audio para «Orbitales atómicos – Configuración de los electrones del escandio» aquí (se abre en una nueva ventana).
Revisión en vídeo
Este vídeo ofrece otra visión general del electrón:
Pruébalo
¡Contribuye!
Mejora esta páginaAprende más