Learning Outcomes
- Opisać zachowanie i położenie elektronów oraz jak te czynniki wpływają na tworzenie wiązań między atomami
Powłoki elektronowe i model Bohra

Rysunek 1. Model Bohra.
Należy podkreślić, że istnieje związek pomiędzy liczbą protonów w pierwiastku, czyli liczbą atomową odróżniającą jeden pierwiastek od drugiego, a liczbą posiadanych przez niego elektronów. We wszystkich obojętnych elektrycznie atomach liczba elektronów jest taka sama jak liczba protonów. Tak więc każdy pierwiastek, przynajmniej gdy jest elektrycznie obojętny, ma charakterystyczną liczbę elektronów równą jego liczbie atomowej.
Wczesny model atomu został opracowany w 1913 roku przez duńskiego naukowca Nielsa Bohra (1885-1962). W tym modelu, elektrony istnieją w głównych powłokach. Elektron normalnie istnieje w powłoce o najniższej dostępnej energii, która jest najbliżej jądra. Energia pochodząca z fotonu światła może przesunąć go do powłoki o wyższej energii, ale taka sytuacja jest niestabilna i elektron szybko rozpada się z powrotem do stanu podstawowego. W procesie tym uwalniany jest foton światła.
Model Bohra przedstawia atom jako centralne jądro zawierające protony i neutrony, z elektronami na orbitach kołowych w określonych odległościach od jądra, jak pokazano na rysunku 1. Orbity te tworzą powłoki elektronowe lub poziomy energetyczne, które są sposobem wizualizacji liczby elektronów w najbardziej zewnętrznych powłokach. Te poziomy energetyczne są oznaczone liczbą i symbolem „n”. Na przykład, 1n reprezentuje pierwszy poziom energetyczny położony najbliżej jądra.
Elektrony wypełniają orbitale w spójnej kolejności: najpierw wypełniają orbitale najbliżej jądra, a następnie kontynuują wypełnianie orbitali o rosnącej energii dalej od jądra. Jeśli istnieje wiele orbitali o równej energii, będą one wypełnione jednym elektronem na każdym poziomie energetycznym zanim zostanie dodany drugi elektron. Elektrony najbardziej zewnętrznego poziomu energetycznego określają energetyczną stabilność atomu i jego skłonność do tworzenia wiązań chemicznych z innymi atomami w celu utworzenia molekuł.
W standardowych warunkach, atomy wypełniają najpierw wewnętrzne powłoki, często powodując zmienną liczbę elektronów w najbardziej zewnętrznej powłoce. The innerermost shell has a maximum of two electrons but the next two electron shells can each have a maximum of eight electrons. Jest to znane jako reguła oktetu, która mówi, z wyjątkiem najbardziej wewnętrznej powłoki, że atomy są bardziej stabilne energetycznie, gdy mają osiem elektronów w swojej powłoce walencyjnej, najbardziej zewnętrznej powłoce elektronowej. Przykłady niektórych neutralnych atomów i ich konfiguracji elektronowych pokazane są na rysunku 2. Zauważmy, że na tym rysunku hel ma kompletną zewnętrzną powłokę elektronową, z dwoma elektronami wypełniającymi jego pierwszą i jedyną powłokę. Podobnie, neon ma kompletną zewnętrzną powłokę 2n zawierającą osiem elektronów. W przeciwieństwie do nich, chlor i sód mają odpowiednio siedem i jeden w swoich zewnętrznych powłokach, ale teoretycznie byłyby bardziej stabilne energetycznie, gdyby postępowały zgodnie z regułą oktetu i miały osiem.
Practice Question
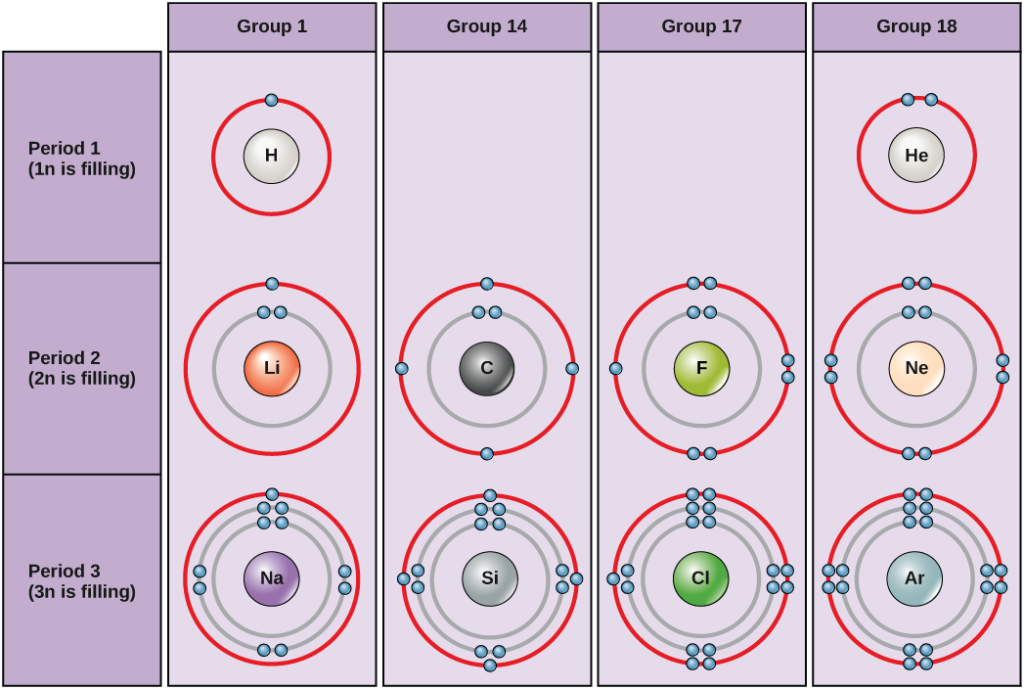
Figure 2. Diagramy Bohra dla wodoru, helu, litu, węgla, fluoru, neonu, sodu, krzemu, chloru i argonu.
Schematy Bohra wskazują, ile elektronów wypełnia każdą powłokę główną. Grupa 18 pierwiastków (hel, neon i argon są pokazane na rysunku 2) mają pełną zewnętrzną powłokę walencyjną. Pełna powłoka walencyjna jest najbardziej stabilną konfiguracją elektronową. Elementy w innych grupach mają częściowo wypełnione powłoki walencyjne i zyskują lub tracą elektrony, aby osiągnąć stabilną konfigurację elektronową.
An atom może dawać, brać lub dzielić elektrony z innym atomem, aby osiągnąć pełną powłokę walencyjną, najbardziej stabilną konfigurację elektronową. Patrząc na ten rysunek, ile elektronów muszą stracić pierwiastki z grupy 1, aby osiągnąć stabilną konfigurację elektronową? Ile elektronów muszą zdobyć pierwiastki z grup 14 i 17, aby osiągnąć stabilną konfigurację?
Zrozumienie, że organizacja układu okresowego jest oparta na całkowitej liczbie protonów (i elektronów) pomaga nam wiedzieć, jak elektrony są rozmieszczone w zewnętrznej powłoce. Układ okresowy jest ułożony w kolumnach i rzędach w oparciu o liczbę elektronów i miejsca ich rozmieszczenia. Przyjrzyj się bliżej niektórym pierwiastkom w skrajnie prawej kolumnie układu okresowego na rysunku 3.

Rysunek 3. W układzie okresowym podano masę atomową i liczbę atomową każdego pierwiastka. Liczba atomowa pojawia się nad symbolem pierwiastka, a przybliżona masa atomowa pod nim.
Atomy grupy 18: hel (He), neon (Ne) i argon (Ar) mają wypełnione zewnętrzne powłoki elektronowe, co sprawia, że nie muszą dzielić się elektronami z innymi atomami, aby osiągnąć stabilność; są bardzo stabilne jako pojedyncze atomy. Ich niereaktywność spowodowała, że nazwano je gazami obojętnymi (lub szlachetnymi). Porównaj to z pierwiastkami grupy 1, znajdującymi się w lewej kolumnie. Wszystkie te pierwiastki, w tym wodór (H), lit (Li) i sód (Na), posiadają po jednym elektronie w swoich najbardziej zewnętrznych powłokach. Oznacza to, że mogą one osiągnąć stabilną konfigurację i wypełnioną powłokę zewnętrzną poprzez oddanie lub współdzielenie jednego elektronu z innym atomem lub cząsteczką taką jak woda. Wodór odda lub podzieli się swoim elektronem, aby osiągnąć taką konfigurację, podczas gdy lit i sód oddadzą swój elektron, aby stać się stabilnymi. W wyniku utraty ujemnie naładowanego elektronu, stają się one dodatnio naładowanymi jonami. Pierwiastki grupy 17, w tym fluor i chlor, mają siedem elektronów w swoich skrajnych powłokach, więc mają tendencję do wypełniania tej powłoki elektronem z innych atomów lub cząsteczek, co czyni je ujemnie naładowanymi jonami. Pierwiastki grupy 14, z których węgiel jest najważniejszy dla systemów żywych, mają cztery elektrony w swojej zewnętrznej powłoce, co pozwala im na tworzenie kilku wiązań kowalencyjnych (omówionych poniżej) z innymi atomami. Tak więc, kolumny układu okresowego reprezentują potencjalny wspólny stan zewnętrznych powłok elektronowych tych pierwiastków, który jest odpowiedzialny za ich podobne właściwości chemiczne.
Orbitale elektronowe
Ale przydatne do wyjaśnienia reaktywności i wiązań chemicznych niektórych pierwiastków, model Bohra atomu nie odzwierciedla dokładnie jak elektrony są przestrzennie rozmieszczone wokół jądra. Nie kr±ż± one wokół j±dra jak ziemia wokół słońca, ale znajduj± się w orbitalach elektronowych. Te stosunkowo skomplikowane kształty wynikają z faktu, że elektrony zachowują się nie tylko jak cząstki, ale także jak fale. Równania matematyczne z mechaniki kwantowej znane jako funkcje falowe mogą przewidzieć z pewnym prawdopodobieństwem, gdzie elektron może się znaleźć w danym momencie. Obszar, w którym elektron najprawdopodobniej się znajdzie nazywany jest jego orbitalem.

Rysunek 4. Kliknij, aby powiększyć obraz. Podpowłoki s mają kształt kuli. Zarówno powłoki główne 1n jak i 2n mają orbital s, ale rozmiar sfery jest większy w przypadku orbitalu 2n. Każda sfera jest pojedynczym orbitalem. podpowłoki p składają się z trzech orbitali w kształcie hantli. Główna powłoka 2n ma podpowłoki p, ale powłoka 1 nie ma.
Przypomnij, że model Bohra przedstawia konfigurację powłoki elektronowej atomu. Wewnątrz każdej powłoki elektronowej są podpowłoki, a każda podpowłoka ma określoną liczbę orbitali zawierających elektrony. Podczas gdy niemożliwe jest dokładne obliczenie, gdzie znajduje się elektron, naukowcy wiedzą, że najprawdopodobniej znajduje się on w obrębie swojej ścieżki orbitalnej. Podpowłoki oznaczane są literami s, p, d, i f. Podpowłoka s ma kształt kulisty i posiada jeden orbital. Główna powłoka 1n ma tylko jeden orbital s, który może pomieścić dwa elektrony. Główna powłoka 2n ma jedną podpowłokę s i jedną podpowłokę p, i może pomieścić w sumie osiem elektronów. Podpowłoka p ma trzy orbitale w kształcie hantli, jak pokazano na rysunku 4. Podpowłoki d i f mają bardziej złożone kształty i zawierają odpowiednio pięć i siedem orbitali. Nie są one pokazane na ilustracji. Główna powłoka 3n posiada podpowłoki s, p, i d i może pomieścić 18 elektronów. Główna powłoka 4n ma orbitale s, p, d i f i może pomieścić 32 elektrony. Oddalając się od jądra, liczba elektronów i orbitali znajdujących się na poziomach energetycznych wzrasta. Postępując od jednego atomu do następnego w układzie okresowym, struktura elektronowa może być opracowana przez dopasowanie dodatkowego elektronu do następnego dostępnego orbitalu.
Najbliższy orbital do jądra, zwany orbitalem 1s, może pomieścić do dwóch elektronów. Ten orbital jest odpowiednikiem najbardziej wewnętrznej powłoki elektronowej w modelu Bohra atomu. Jest on nazywany orbitalem 1s, ponieważ jest sferyczny wokół jądra. Orbital 1s jest najbliższym orbitalem w stosunku do jądra i zawsze jest wypełniany jako pierwszy, zanim jakikolwiek inny orbital może zostać wypełniony. Wodór posiada jeden elektron, dlatego ma zajęte tylko jedno miejsce na orbitalu 1s. Jest to oznaczane jako 1s1, gdzie indeks 1 odnosi się do jednego elektronu w orbitalu 1s. Hel posiada dwa elektrony, dlatego może całkowicie wypełnić orbital 1s swoimi dwoma elektronami. Jest to oznaczane jako 1s2, odnosząc się do dwóch elektronów helu na orbitalu 1s. Na rysunku 4 układu okresowego wodór i hel są jedynymi dwoma pierwiastkami w pierwszym rzędzie (okresie); dzieje się tak dlatego, że posiadają one tylko elektrony w swojej pierwszej powłoce, czyli na orbitalu 1s. Wodór i hel są jedynymi dwoma elementami, które mają 1s i żadnych innych orbitali elektronowych w elektrycznie neutralnym stanie.
Druga powłoka elektronowa może zawierać osiem elektronów. Ta powłoka zawiera inny sferyczny orbital s i trzy „hantle” w kształcie orbitali p, z których każdy może pomieścić dwa elektrony, jak pokazano na rysunku 4. Po zapełnieniu orbitalu 1s, zapełniana jest druga powłoka elektronowa, najpierw zapełniany jest orbital 2s, a następnie trzy orbitale p. Podczas wypełniania orbitali p, każdy z nich przyjmuje jeden elektron; kiedy każdy z orbitali p posiada już elektron, można dodać drugi. Lit (Li) zawiera trzy elektrony, które zajmują pierwszą i drugą powłokę. Dwa elektrony wypełniają orbital 1s, a trzeci elektron wypełnia orbital 2s. Jego konfiguracja elektronowa to 1s22s1. Neon (Ne), z drugiej strony, ma w sumie dziesięć elektronów: dwa znajdują się na najbardziej wewnętrznym orbitalu 1s, a osiem wypełnia jego drugą powłokę (po dwa na orbitalu 2s i trzech p); dlatego jest gazem obojętnym i jest energetycznie stabilny jako pojedynczy atom, który rzadko będzie tworzył wiązania chemiczne z innymi atomami. Większe pierwiastki mają dodatkowe orbitale, tworzące trzecią powłokę elektronową. Podczas gdy koncepcje powłok elektronowych i orbitali są blisko spokrewnione, orbitale zapewniają dokładniejsze przedstawienie konfiguracji elektronowej atomu, ponieważ model orbitalny określa różne kształty i specjalne orientacje wszystkich miejsc, które elektrony mogą zajmować.
Zobacz tę wizualną animację, aby zobaczyć przestrzenne rozmieszczenie orbitali p i s. Zauważ, że ten film nie ma dźwięku.
Możesz zobaczyć tekst opisu audio dla „Orbitale atomowe – konfiguracja elektronowa skandu” tutaj (otwiera się w nowym oknie).
Przegląd filmów
Ten film daje inny przegląd elektronu:
Spróbuj
Przyczyń się!
Popraw tę stronęDowiedz się więcej