Oppimistavoitteet
- Kuvaa elektronien käyttäytymistä ja sijaintia sekä sitä, miten nämä tekijät vaikuttavat atomien välisten sidosten muodostumiseen
Elektronien kuoret ja Bohrin malli

Kuva 1. Bohrin malli.
Korostettakoon, että alkuaineen protonien lukumäärän, alkuaineen toisistaan erottavan järjestysluvun ja alkuaineessa olevien elektronien lukumäärän välillä on yhteys. Kaikissa sähköisesti neutraaleissa atomeissa elektronien lukumäärä on sama kuin protonien lukumäärä. Näin ollen jokaisella alkuaineella, ainakin silloin kun se on sähköisesti neutraali, on sille ominainen elektronien lukumäärä, joka on yhtä suuri kuin sen järjestysluku.
Tanskalainen tiedemies Niels Bohr (1885-1962) kehitti vuonna 1913 varhaisen atomimallin. Tässä mallissa elektronit ovat olemassa pääkuorissa. Elektroni on tavallisesti matalimman energian omaavalla kuorella, joka on lähimpänä ydintä. Valofotonista peräisin oleva energia voi nostaa sen korkeamman energian kuoreen, mutta tämä tilanne on epävakaa, ja elektroni hajoaa nopeasti takaisin perustilaan. Samalla vapautuu valofoton.
Bohrin mallissa atomi on keskeinen ydin, jossa on protonit ja neutronit, ja elektronit ovat ympyräradoilla tietyillä etäisyyksillä ytimestä, kuten kuvassa 1 on esitetty. Nämä radat muodostavat elektronikuoria tai energiatasoja, jotka ovat tapa havainnollistaa elektronien määrää uloimmissa kuorissa. Nämä energiatasot merkitään numerolla ja symbolilla ”n”. Esimerkiksi 1n edustaa ensimmäistä energiatasoa, joka sijaitsee lähimpänä ydintä.
Elektronit täyttävät orbitaalit johdonmukaisessa järjestyksessä: ne täyttävät ensin lähimpänä ydintä olevat orbitaalit, minkä jälkeen ne jatkavat täyttämällä kasvavan energian orbitaaleja kauempana ytimestä. Jos on useita yhtä energisiä orbitaaleja, ne täytetään yhdellä elektronilla kullakin energiatasolla ennen toisen elektronin lisäämistä. Uloimman energiatason elektronit määräävät atomin energeettisen vakauden ja sen taipumuksen muodostaa kemiallisia sidoksia muiden atomien kanssa muodostaen molekyylejä.
Vakiolämpötiloissa atomit täyttävät ensin sisemmät kuoret, jolloin uloimmalle kuorelle jää usein vaihteleva määrä elektroneja. Sisimmällä kuorella on enintään kaksi elektronia, mutta kahdella seuraavalla elektronikuorella voi kummallakin olla enintään kahdeksan elektronia. Tämä tunnetaan niin sanottuna oktettisääntönä, jonka mukaan sisintä kuorta lukuun ottamatta atomit ovat energeettisesti vakaampia, kun niiden valenssikuoressa eli uloimmassa elektronikuoressa on kahdeksan elektronia. Esimerkkejä eräistä neutraaleista atomeista ja niiden elektronikonfiguraatioista on esitetty kuvassa 2. Huomatkaa, että tässä kuvassa heliumilla on täydellinen ulompi elektronikuori, jossa kaksi elektronia täyttää sen ensimmäisen ja ainoan kuoren. Vastaavasti neonilla on täydellinen ulompi 2n-kuori, jossa on kahdeksan elektronia. Sitä vastoin kloorilla on seitsemän ja natriumilla yksi elektroni ulkokuoressaan, mutta teoriassa ne olisivat energeettisesti vakaampia, jos ne noudattaisivat oktettisääntöä ja niissä olisi kahdeksan elektronia.
Harjoituskysymys
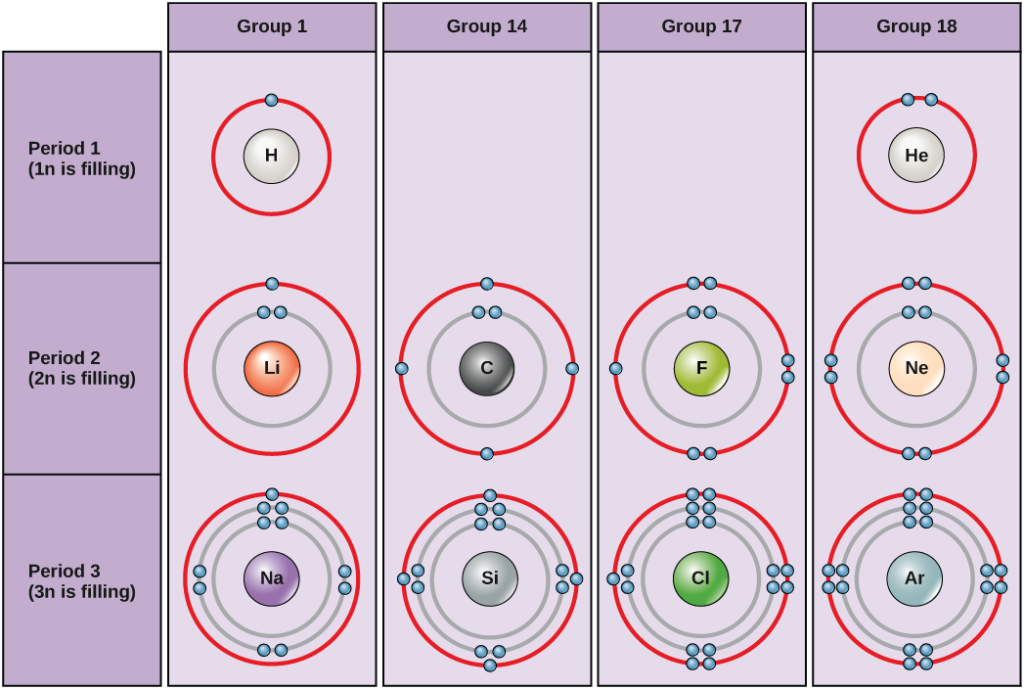
Kuva 2. Vedyn, heliumin, litiumin, hiilen, fluorin, neonin, natriumin, piin, kloorin ja argonin Bohrin kaaviot.
Bohrin kaaviot osoittavat, kuinka monta elektronia täyttää kunkin pääkuoren. Ryhmän 18 alkuaineilla (helium, neon ja argon on esitetty kuvassa 2) on täysi ulompi eli valenssikuori. Täysi valenssikuori on vakain elektronikonfiguraatio. Muiden ryhmien alkuaineilla on osittain täytetyt valenssikuoret, ja ne saavat tai menettävät elektroneja saavuttaakseen stabiilin elektronikonfiguraation.
Atomi voi antaa, ottaa tai jakaa elektroneja toisen atomin kanssa saavuttaakseen täyden valenssikuoren, joka on stabiilin elektronikonfiguraatio. Kun tarkastellaan tätä kuviota, kuinka monta elektronia ryhmän 1 alkuaineiden on menetettävä saavuttaakseen vakaan elektronikonfiguraation? Kuinka monta elektronia ryhmien 14 ja 17 alkuaineiden on saatava saavuttaakseen vakaan konfiguraation?
Ymmärtää, että jaksollisen järjestelmän järjestys perustuu protonien (ja elektronien) kokonaislukumäärään, auttaa meitä tietämään, miten elektronit jakautuvat ulkokuoren kesken. Jaksollinen järjestelmä on järjestetty sarakkeisiin ja riveihin elektronien lukumäärän ja elektronien sijainnin perusteella. Tutustu tarkemmin joihinkin alkuaineisiin jaksollisen järjestelmän oikeanpuoleisimmassa sarakkeessa kuvassa 3.

Kuva 3. Jaksollisen järjestelmän oikeanpuoleinen sarake. Jaksollisessa järjestelmässä näkyy kunkin alkuaineen atomimassa ja järjestysluku. Atomiluku näkyy alkuaineen symbolin yläpuolella ja likimääräinen atomimassa sen alapuolella.
Ryhmän 18 atomeilla heliumilla (He), neonilla (Ne) ja argonilla (Ar) on kaikilla täydet ulommat elektronikuoret, joten niiden ei tarvitse jakaa elektroneja muiden atomien kanssa vakauden saavuttamiseksi; ne ovat erittäin stabiileja yksittäisinä atomeina. Niiden reagoimattomuus on johtanut siihen, että niitä on kutsuttu inertteiksi kaasuiksi (tai jalokaasuiksi). Vertaa tätä vasemmanpuoleisessa sarakkeessa oleviin ryhmän 1 alkuaineisiin. Näillä alkuaineilla, kuten vedyllä (H), litiumilla (Li) ja natriumilla (Na), on kaikilla yksi elektroni uloimmissa kuorissaan. Tämä tarkoittaa, että ne voivat saavuttaa vakaan konfiguraation ja täytetyn ulomman kuoren luovuttamalla tai jakamalla yhden elektronin toisen atomin tai molekyylin, kuten veden, kanssa. Vety luovuttaa tai jakaa elektroninsa saavuttaakseen tämän konfiguraation, kun taas litium ja natrium luovuttavat elektroninsa tullakseen stabiiliksi. Negatiivisesti varautuneen elektronin menettämisen seurauksena niistä tulee positiivisesti varautuneita ioneja. Ryhmän 17 alkuaineilla, kuten fluorilla ja kloorilla, on seitsemän elektronia uloimmassa kuoressaan, joten niillä on taipumus täyttää tämä kuori toisista atomeista tai molekyyleistä peräisin olevalla elektronilla, mikä tekee niistä negatiivisesti varautuneita ioneja. Ryhmän 14 alkuaineilla, joista hiili on elävien järjestelmien kannalta tärkein, on neljä elektronia uloimmalla kuorellaan, minkä ansiosta ne voivat muodostaa useita kovalenttisia sidoksia (joita käsitellään jäljempänä) muiden atomien kanssa. Siten jaksollisen järjestelmän pylväät edustavat näiden alkuaineiden uloimpien elektronikuorien potentiaalista jaettua tilaa, joka on vastuussa niiden samankaltaisista kemiallisista ominaisuuksista.
Elektroniorbitaalit
Vaikka se on hyödyllinen tiettyjen alkuaineiden reaktiivisuuden ja kemiallisten sidosten selittämisessä, Bohrin atomimalli ei kuvaa tarkasti sitä, miten elektronit jakautuvat tilallisesti ytimen ympärille. Ne eivät kierrä ydintä kuten maa kiertää aurinkoa, vaan ne sijaitsevat elektroniorbitaaleissa. Nämä suhteellisen monimutkaiset muodot johtuvat siitä, että elektronit käyttäytyvät hiukkasten lisäksi myös aaltojen tavoin. Kvanttimekaniikan matemaattisilla yhtälöillä, joita kutsutaan aaltofunktioiksi, voidaan ennustaa tietyllä todennäköisyydellä, missä elektroni voi olla milloinkin. Aluetta, jossa elektroni todennäköisimmin on, kutsutaan sen orbitaaliksi.

Kuva 4. Klikkaa saadaksesi suuremman kuvan. S-alakuoret ovat pallonmuotoisia. Sekä 1n- että 2n-pääkuorilla on s-orbitaali, mutta pallon koko on suurempi 2n-orbitaalissa. Jokainen pallo on yksittäinen orbitaali. p-alakuoret koostuvat kolmesta käpylehmän muotoisesta orbitaalista. Pääkuorella 2n on p-alakuori, mutta kuorella 1 ei ole.
Muistetaan, että Bohrin malli kuvaa atomin elektronikuoren konfiguraatiota. Jokaisen elektronikuoren sisällä on alikuoria, ja kullakin alikuorella on tietty määrä elektroneja sisältäviä orbitaaleja. Vaikka on mahdotonta laskea tarkalleen, missä elektroni sijaitsee, tiedemiehet tietävät, että se todennäköisesti sijaitsee orbitaaliradallaan. Alakuoria merkitään kirjaimilla s, p, d ja f. S-alakuori on muodoltaan pallomainen, ja siinä on yksi orbitaali. Pääkuorella 1n on vain yksi s-orbitaali, johon voi mahtua kaksi elektronia. Pääkuoressa 2n on yksi s- ja yksi p-alakuori, ja niihin voi mahtua yhteensä kahdeksan elektronia. P-alikuoressa on kolme käpylehmän muotoista orbitaalia, kuten kuvassa 4 on esitetty. Alakuoret d ja f ovat muodoltaan monimutkaisempia ja sisältävät viisi ja seitsemän orbitaalia. Näitä ei ole esitetty kuvassa. Pääkuoressa 3n on s-, p- ja d-alakuoret, ja siihen mahtuu 18 elektronia. Pääkuorella 4n on s-, p-, d- ja f-orbitaalit, ja siihen mahtuu 32 elektronia. Kun etäännytään ytimestä, energiatasoissa olevien elektronien ja orbitaalien määrä kasvaa. Etenemällä atomista toiseen jaksollisessa järjestelmässä elektronirakenne voidaan selvittää sovittamalla ylimääräinen elektroni seuraavaan käytettävissä olevaan orbitaaliin.
Ytimelle lähimpänä olevaan orbitaaliin, jota kutsutaan 1s-orbitaaliksi, mahtuu enintään kaksi elektronia. Tämä orbitaali vastaa Bohrin atomimallin sisintä elektronikuorta. Sitä kutsutaan 1s-orbitaaliksi, koska se on pallomainen ytimen ympärillä. 1s:n orbitaali on lähimpänä ydintä oleva orbitaali, ja se täytetään aina ensin, ennen kuin mikään muu orbitaali voidaan täyttää. Vedyllä on yksi elektroni, joten sillä on vain yksi paikka 1s-kiertoradalla. Tämä merkitään 1s1:ksi, jossa ylinumero 1 viittaa yhteen elektroniin 1s-orbitaalissa. Heliumilla on kaksi elektronia, joten se voi täyttää 1s-orbitaalin kokonaan kahdella elektronillaan. Tästä käytetään nimitystä 1s2, joka viittaa heliumin kahteen elektroniin 1s-orbitaalissa. Jaksollisen järjestelmän kuvassa 4 vety ja helium ovat ainoat alkuaineet ensimmäisellä rivillä (jaksossa); tämä johtuu siitä, että niillä on elektroneja vain ensimmäisellä kuorella eli 1s-orbitaalissa. Vety ja helium ovat ainoat alkuaineet, joilla on sähköisesti neutraalissa tilassa 1s eikä muita elektroniorbitaaleja.
Kakkoselektronikuori voi sisältää kahdeksan elektronia. Tämä kuori sisältää toisen pallomaisen s-orbitaalin ja kolme ”nyytin” muotoista p-orbitaalia, joihin kuhunkin voi mahtua kaksi elektronia, kuten kuvassa 4 on esitetty. Kun 1s-orbitaali on täytetty, täytetään toinen elektronikuori täyttämällä ensin sen 2s-orbitaali ja sitten sen kolme p-orbitaalia. Kun p-orbitaaleja täytetään, kukin ottaa yhden elektronin; kun jokaisella p-orbitaalilla on elektroni, voidaan lisätä toinen elektroni. Litium (Li) sisältää kolme elektronia, jotka täyttävät ensimmäisen ja toisen kuoren. Kaksi elektronia täyttää 1s-orbitaalin, ja kolmas elektroni täyttää 2s-orbitaalin. Sen elektronikonfiguraatio on 1s22s1. Neonilla (Ne) puolestaan on yhteensä kymmenen elektronia: kaksi on sen sisimmässä 1s-orbitaalissa ja kahdeksan täyttää sen toisen kuoren (kaksi kumpikin 2s- ja kolme p-orbitaalia); näin ollen se on inertti kaasu ja energeettisesti vakaa yksittäisenä atomina, joka harvoin muodostaa kemiallisen sidoksen muiden atomien kanssa. Suuremmilla alkuaineilla on ylimääräisiä orbitaaleja, jotka muodostavat kolmannen elektronikuoren. Vaikka elektronikuorien ja orbitaalien käsitteet liittyvät läheisesti toisiinsa, orbitaalit antavat tarkemman kuvan atomin elektronikonfiguraatiosta, koska orbitaalimalli määrittää kaikkien niiden paikkojen erilaiset muodot ja erityiset suunnat, joita elektronit voivat miehittää.
Katsele tätä visuaalista animaatiota nähdäksesi p- ja s-orbitaalien avaruudellisen järjestyksen. Huomaa, että tässä videossa ei ole ääntä.
Voit katsoa ”Atomic Orbitals – Electron Configuration of Scandium” (Atomic Orbitals – Electron Configuration of Scandium) -videon äänikuvaustekstin tästä (avautuu uuteen ikkunaan).
Videokatsaus
Tässä videossa annetaan toinen yleiskatsaus elektronista:
Kokeile
Kirjoita!
Paranna tätä sivuaOpi lisää