Rezultatele învățării
- Descrieți comportamentul și localizarea electronilor, precum și modul în care acești factori influențează formarea legăturilor între atomi
Electron Shells and the Bohr Model

Figura 1. Modelul Bohr.
Este de subliniat faptul că există o legătură între numărul de protoni dintr-un element, numărul atomic care deosebește un element de altul, și numărul de electroni pe care îl are. În toți atomii neutrii din punct de vedere electric, numărul de electroni este același cu numărul de protoni. Astfel, fiecare element, cel puțin atunci când este neutru din punct de vedere electric, are un număr caracteristic de electroni egal cu numărul său atomic.
Un prim model al atomului a fost dezvoltat în 1913 de către omul de știință danez Niels Bohr (1885-1962). În acest model, electronii există în interiorul unor învelișuri principale. Un electron există în mod normal în învelișul cu cea mai mică energie disponibilă, care este cel mai apropiat de nucleu. Energia provenită de la un foton de lumină îl poate urca într-o cochilie de energie mai mare, dar această situație este instabilă, iar electronul se dezintegrează rapid înapoi la starea fundamentală. În acest proces, se eliberează un foton de lumină.
Modelul Bohr prezintă atomul ca un nucleu central care conține protoni și neutroni, cu electronii în orbitale circulare la distanțe specifice față de nucleu, așa cum este ilustrat în figura 1. Aceste orbite formează învelișuri de electroni sau niveluri de energie, care sunt o modalitate de a vizualiza numărul de electroni din învelișurile cele mai exterioare. Aceste niveluri de energie sunt desemnate printr-un număr și prin simbolul „n”. De exemplu, 1n reprezintă primul nivel energetic situat cel mai aproape de nucleu.
Electronii umplu orbitele într-o ordine consecventă: mai întâi umplu orbitele cele mai apropiate de nucleu, apoi continuă să umple orbitele de energie crescândă mai departe de nucleu. Dacă există mai mulți orbitali de energie egală, aceștia vor fi umpluți cu câte un electron în fiecare nivel energetic înainte de a se adăuga un al doilea electron. Electronii din nivelul energetic cel mai exterior determină stabilitatea energetică a atomului și tendința acestuia de a forma legături chimice cu alți atomi pentru a forma molecule.
În condiții standard, atomii umplu mai întâi învelișurile interioare, rezultând adesea un număr variabil de electroni în învelișul cel mai exterior. Învelișul cel mai interior are cel mult doi electroni, dar următoarele două învelișuri electronice pot avea fiecare maximum opt electroni. Acest lucru este cunoscut sub numele de regula octetului, care afirmă, cu excepția învelișului cel mai interior, că atomii sunt mai stabili din punct de vedere energetic atunci când au opt electroni în învelișul de valență, învelișul electronic cel mai exterior. În figura 2 sunt prezentate câteva exemple de atomi neutri și configurațiile electronice ale acestora. Observați că, în această figură, heliul are un înveliș electronic exterior complet, cu doi electroni care îi umplu primul și singurul înveliș. În mod similar, neonul are un înveliș exterior 2n complet, conținând opt electroni. În schimb, clorul și sodiul au șapte și, respectiv, unul în învelișurile lor exterioare, dar, teoretic, ar fi mai stabile din punct de vedere energetic dacă ar urma regula octetului și ar avea opt.
Întrebare practică
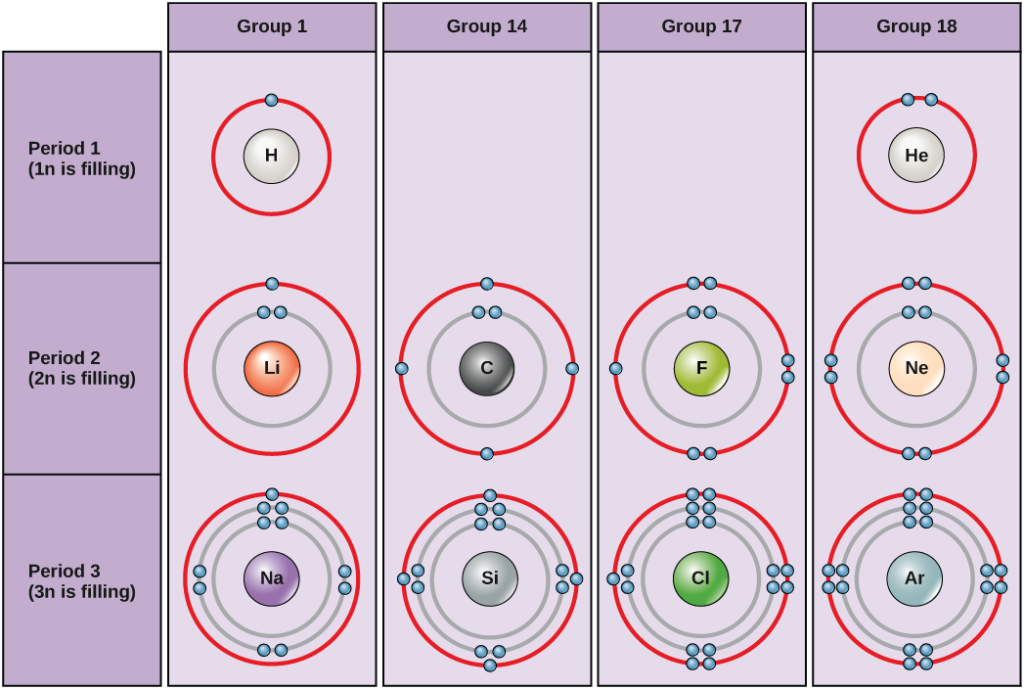
Figura 2. Diagramele Bohr pentru hidrogen, heliu, litiu, carbon, fluor, neon, sodiu, siliciu, clor și argon.
Diagramele Bohr indică câți electroni umplu fiecare înveliș principal. Elementele din grupa 18 (heliul, neonul și argonul sunt prezentate în figura 2) au un înveliș exterior, sau de valență, plin. Un înveliș de valență plin este cea mai stabilă configurație electronică. Elementele din alte grupe au învelișurile de valență parțial pline și câștigă sau pierd electroni pentru a obține o configurație electronică stabilă.
Un atom poate da, lua sau împărți electroni cu un alt atom pentru a obține un înveliș de valență plin, cea mai stabilă configurație electronică. Privind această figură, câți electroni trebuie să piardă elementele din grupa 1 pentru a obține o configurație electronică stabilă? Câți electroni trebuie să câștige elementele din grupele 14 și 17 pentru a obține o configurație stabilă?
Înțelegerea faptului că organizarea tabelului periodic se bazează pe numărul total de protoni (și electroni) ne ajută să știm cum sunt distribuiți electronii între învelișul exterior. Tabelul periodic este aranjat în coloane și rânduri pe baza numărului de electroni și a locului în care sunt localizați acești electroni. Aruncați o privire mai atentă asupra unora dintre elementele din coloana din extrema dreaptă a tabelului periodic din figura 3.

Figura 3. Tabelul periodic arată masa atomică și numărul atomic al fiecărui element. Numărul atomic apare deasupra simbolului elementului, iar masa atomică aproximativă apare dedesubt.
Atomii din grupa 18 heliu (He), neon (Ne) și argon (Ar) au toți învelișurile exterioare de electroni pline, ceea ce face inutilă împărțirea electronilor cu alți atomi pentru a atinge stabilitatea; aceștia sunt foarte stabili ca atomi individuali. Nereactivitatea lor a făcut ca acestea să fie denumite gaze inerte (sau gaze nobile). Comparați aceste elemente cu cele din grupa 1 din coloana din stânga. Aceste elemente, inclusiv hidrogenul (H), litiul (Li) și sodiul (Na), au toate câte un electron în straturile lor cele mai exterioare. Aceasta înseamnă că pot obține o configurație stabilă și un înveliș exterior plin prin donarea sau împărțirea unui electron cu un alt atom sau cu o moleculă precum apa. Hidrogenul își va dona sau împărți electronul pentru a obține această configurație, în timp ce litiul și sodiul își vor dona electronul pentru a deveni stabile. Ca urmare a pierderii unui electron cu sarcină negativă, aceștia devin ioni cu sarcină pozitivă. Elementele din grupa 17, inclusiv fluorul și clorul, au șapte electroni în învelișurile lor cele mai exterioare, astfel încât au tendința de a umple acest înveliș cu un electron de la alți atomi sau molecule, devenind astfel ioni cu sarcină negativă. Elementele din grupa 14, dintre care carbonul este cel mai important pentru sistemele vii, au patru electroni în învelișul lor exterior, ceea ce le permite să realizeze mai multe legături covalente (discutate mai jos) cu alți atomi. Astfel, coloanele tabelului periodic reprezintă starea potențială partajată a învelișurilor electronice exterioare ale acestor elemente, care este responsabilă de caracteristicile lor chimice similare.
Orbitalii electronilor
Deși este util pentru a explica reactivitatea și legăturile chimice ale anumitor elemente, modelul Bohr al atomului nu reflectă cu exactitate modul în care electronii sunt distribuiți în spațiu în jurul nucleului. Aceștia nu înconjoară nucleul așa cum pământul orbitează în jurul soarelui, ci se găsesc în orbitali electronici. Aceste forme relativ complexe rezultă din faptul că electronii nu se comportă doar ca niște particule, ci și ca niște unde. Ecuațiile matematice din mecanica cuantică, cunoscute sub numele de funcții de undă, pot prezice, cu un anumit nivel de probabilitate, unde s-ar putea afla un electron la un moment dat. Zona în care este cel mai probabil să se găsească un electron se numește orbitalul său.

Figura 4. Faceți clic pentru o imagine mai mare. Subsferele s au forma unor sfere. Atât învelișurile principale 1n cât și 2n au un orbital s, dar dimensiunea sferei este mai mare în cazul orbitalului 2n. Fiecare sferă este un singur orbital. subshell-urile p sunt alcătuite din trei orbitali în formă de halteră. Învelișul principal 2n are o subînveliș p, dar învelișul 1 nu are.
Reamintim că modelul Bohr descrie configurația învelișului electronic al unui atom. În cadrul fiecărei învelișuri electronice există subînvelișuri, iar fiecare subînveliș are un număr specificat de orbitali care conțin electroni. Deși este imposibil de calculat cu exactitate unde se află un electron, oamenii de știință știu că acesta se află cel mai probabil în interiorul traiectoriei sale orbitale. Subînvelișurile sunt desemnate prin literele s, p, d și f. Subînvelișul s este de formă sferică și are un singur orbital. Învelișul principal 1n are doar un singur orbital s, care poate conține doi electroni. Învelișul principal 2n are un subshell s și un subshell p și poate conține un total de opt electroni. Subshell-ul p are trei orbitali în formă de halteră, așa cum este ilustrat în figura 4. Subshell-urile d și f au forme mai complexe și conțin cinci și, respectiv, șapte orbitali. Aceștia nu sunt prezentați în ilustrație. Învelișul principal 3n are subînvelișurile s, p și d și poate conține 18 electroni. Învelișul principal 4n are orbitali s, p, d și f și poate conține 32 de electroni. Îndepărtându-se de nucleu, numărul de electroni și de orbitali care se găsesc în nivelurile energetice crește. Progresând de la un atom la altul în tabelul periodic, structura electronică poate fi elaborată prin încadrarea unui electron suplimentar în următorul orbital disponibil.
Orbitalul cel mai apropiat de nucleu, numit orbitalul 1s, poate conține până la doi electroni. Acest orbital este echivalent cu cel mai interior înveliș electronic din modelul Bohr al atomului. Se numește orbitalul 1s deoarece este sferic în jurul nucleului. Orbitalul 1s este cel mai apropiat orbital de nucleu și este întotdeauna ocupat primul, înainte de a putea fi ocupat orice alt orbital. Hidrogenul are un singur electron; prin urmare, are un singur loc ocupat în orbitalul 1s. Acesta este desemnat ca 1s1, unde 1 se referă la un singur electron din orbitalul 1s. Heliul are doi electroni; prin urmare, poate umple complet orbitalul 1s cu cei doi electroni ai săi. Acesta este desemnat ca 1s2, referindu-se la cei doi electroni ai heliului în orbitalul 1s. În tabelul periodic Figura 4, hidrogenul și heliul sunt singurele două elemente din primul rând (perioadă); acest lucru se datorează faptului că au numai electroni în prima lor înveliș, orbitalul 1s. Hidrogenul și heliul sunt singurele două elemente care au orbitalul 1s și nici un alt orbital de electroni în stare neutră din punct de vedere electric.
Cel de-al doilea înveliș electronic poate conține opt electroni. Acest înveliș conține un alt orbital s sferic și trei orbitali p în formă de „halteră”, fiecare dintre aceștia putând conține doi electroni, așa cum se arată în figura 4. După ce orbitalul 1s este umplut, se umple al doilea înveliș electronic, umplând mai întâi orbitalul 2s și apoi cei trei orbitali p ai acestuia. La umplerea orbitalilor p, fiecare dintre aceștia primește un singur electron; odată ce fiecare orbital p are un electron, se poate adăuga un al doilea. Litiul (Li) conține trei electroni care ocupă primul și al doilea înveliș. Doi electroni umplu orbitalul 1s, iar al treilea electron umple apoi orbitalul 2s. Configurația sa electronică este 1s22s1. Neonul (Ne), pe de altă parte, are în total zece electroni: doi se află în orbitalul 1s cel mai interior, iar opt îi umplu al doilea înveliș (câte doi în orbitalul 2s și trei în orbitalul p); astfel, este un gaz inert și este stabil din punct de vedere energetic ca un singur atom care rareori va forma o legătură chimică cu alți atomi. Elementele mai mari au orbitali suplimentari, care alcătuiesc al treilea înveliș electronic. Deși conceptele de învelișuri de electroni și orbitali sunt strâns legate, orbitalii oferă o reprezentare mai precisă a configurației electronice a unui atom, deoarece modelul orbital specifică diferitele forme și orientări speciale ale tuturor locurilor pe care le pot ocupa electronii.
Vizionați această animație vizuală pentru a vedea dispunerea spațială a orbitalilor p și s. Rețineți că acest videoclip nu are audio.
Puteți vizualiza textul descrierii audio pentru „Atomic Orbitals – Electron Configuration of Scandium” aici (se deschide într-o fereastră nouă).
Revizuire video
Acest videoclip oferă o altă prezentare generală a electronului:
Încercați-l
Contribuie!
Îmbunătățiți această paginăÎnvățați mai mult
.