Learning Outcomes
- Az elektronok viselkedésének és elhelyezkedésének leírása, és hogy ezek a tényezők hogyan befolyásolják az atomok közötti kötések kialakulását
Elektronhéjak és a Bohr-modell

1. ábra. A Bohr-modell.
Kiemelendő, hogy az elemben lévő protonok száma, az egyik elemet a másiktól megkülönböztető atomszám és az elektronok száma között összefüggés van. Minden elektromosan semleges atomban az elektronok száma megegyezik a protonok számával. Így minden elemnek, legalábbis amikor elektromosan semleges, az atomszámával megegyező jellemző elektronszámmal rendelkezik.
Az atom korai modelljét Niels Bohr (1885-1962) dán tudós dolgozta ki 1913-ban. Ebben a modellben az elektronok főhéjakon belül léteznek. Egy elektron általában az elérhető legalacsonyabb energiájú héjban létezik, amelyik a legközelebb van az atommaghoz. Egy fényfoton energiája feljuttathatja egy magasabb energiahéjba, de ez a helyzet instabil, és az elektron gyorsan visszabomlik az alapállapotba. Ennek során egy fényfoton szabadul fel.
A Bohr-modell szerint az atom egy központi atommag, amely protonokat és neutronokat tartalmaz, az elektronok pedig az atommagtól meghatározott távolságban lévő körpályákon helyezkednek el, ahogyan azt az 1. ábra szemlélteti. Ezek a pályák elektronhéjakat vagy energiaszinteket alkotnak, amelyek a legkülső héjakban lévő elektronok számának szemléltetésére szolgálnak. Ezeket az energiaszinteket egy számmal és az “n” szimbólummal jelöljük. Az 1n például az atommaghoz legközelebbi első energiaszintet jelöli.
Az elektronok következetes sorrendben töltik ki a pályákat: először az atommaghoz legközelebbi pályákat töltik ki, majd az atommagtól távolodva egyre nagyobb energiájú pályákat töltenek ki. Ha több azonos energiájú pálya van, akkor azokat minden energiaszinten egy elektron tölti ki, mielőtt egy második elektron hozzáadódik. A legkülső energiaszint elektronjai határozzák meg az atom energetikai stabilitását és azt, hogy hajlamos-e más atomokkal kémiai kötéseket kialakítani, hogy molekulákat alkosson.
Szokásos körülmények között az atomok először a belső héjakat töltik meg, ami gyakran változó számú elektront eredményez a legkülső héjban. A legbelső héjban legfeljebb két elektron van, de a következő két elektronhéjban egyenként legfeljebb nyolc elektron lehet. Ez az úgynevezett oktett-szabály, amely szerint – a legbelső héj kivételével – az atomok energetikailag stabilabbak, ha a valenciahéjukban, a legkülső elektronhéjban nyolc elektron van. A 2. ábra néhány semleges atomot és elektronkonfigurációjukat mutatja be. Vegyük észre, hogy ezen az ábrán a héliumnak teljes külső elektronhéja van, két elektron tölti ki az első és egyetlen héját. Hasonlóképpen a neonnak is van egy teljes külső 2n héja, amely nyolc elektront tartalmaz. Ezzel szemben a klórnak és a nátriumnak hét, illetve egy elektron van a külső héjában, de elméletileg energetikailag stabilabbak lennének, ha követnék a nyolcas szabályt, és nyolc elektronjuk lenne.
gyakorlati kérdés
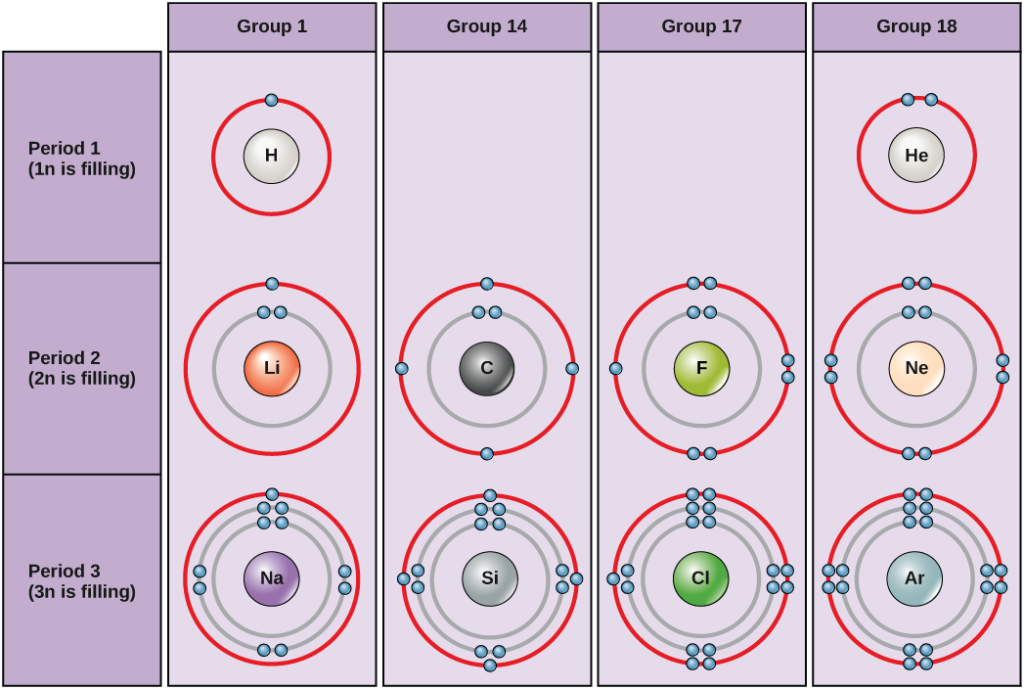
2. ábra. Bohr-diagramok hidrogén, hélium, lítium, szén, fluor, neon, nátrium, szilícium, klór és argon esetén.
A Bohr-diagramokon látható, hogy hány elektron tölti ki az egyes főhéjakat. A 18. csoportba tartozó elemek (a hélium, a neon és az argon a 2. ábrán látható) teljes külső, azaz valenciahéjjal rendelkeznek. A teljes valenciahéj a legstabilabb elektronkonfiguráció. A többi csoport elemei részben kitöltött valenciahéjjal rendelkeznek, és a stabil elektronkonfiguráció elérése érdekében elektronokat vesznek vagy veszítenek.
Egy atom adhat, vehet el vagy oszthat meg elektronokat egy másik atommal, hogy elérje a teljes valenciahéjat, a legstabilabb elektronkonfigurációt. Ha megnézzük ezt az ábrát, hány elektront kell az 1. csoportba tartozó elemeknek elveszíteniük ahhoz, hogy stabil elektronkonfigurációt érjenek el? Hány elektront kell nyerniük a 14. és 17. csoportba tartozó elemeknek ahhoz, hogy stabil konfigurációt érjenek el?
Az, hogy a periódusos rendszer szerveződése a protonok (és elektronok) teljes számán alapul, segít megismerni, hogyan oszlanak el az elektronok a külső héjban. A periódusos rendszer oszlopokba és sorokba rendeződik az elektronok száma és az alapján, hogy ezek az elektronok hol helyezkednek el. Nézz meg közelebbről néhány elemet a periódusos rendszer jobb szélső oszlopában a 3. ábrán.

3. ábra. A periódusos rendszerben az egyes elemek atomtömege és atomszáma látható. Az elem szimbóluma felett az atomszám, alatta pedig a hozzávetőleges atomtömeg látható.
A 18. csoportba tartozó hélium (He), neon (Ne) és argon (Ar) atomok külső elektronhéjai mind tele vannak, így a stabilitás eléréséhez nem szükséges, hogy elektronokat osszanak meg más atomokkal; önálló atomként rendkívül stabilak. Nem reakcióképességük miatt nevezték el őket inert gázoknak (vagy nemesgázoknak). Hasonlítsuk össze a bal oldali oszlopban található 1. csoportba tartozó elemekkel. Ezek az elemek, köztük a hidrogén (H), a lítium (Li) és a nátrium (Na), mind rendelkeznek egy elektronnal a legkülső héjukban. Ez azt jelenti, hogy stabil konfigurációt és töltött külső héjat úgy érhetnek el, hogy egy elektront adományoznak vagy megosztanak egy másik atommal vagy egy molekulával, például vízzel. A hidrogén az elektronját adja vagy megosztja, hogy elérje ezt a konfigurációt, míg a lítium és a nátrium az elektronját adja, hogy stabil legyen. A negatív töltésű elektron elvesztése következtében pozitív töltésű ionokká válnak. A 17. csoportba tartozó elemek, köztük a fluor és a klór, hét elektronnal rendelkeznek a legkülső héjukban, ezért hajlamosak ezt a héjat más atomoktól vagy molekuláktól származó elektronnal feltölteni, így negatív töltésű ionokká válnak. A 14. csoportba tartozó elemek, amelyek közül a szén a legfontosabb az élő rendszerek számára, négy elektronnal rendelkeznek a külső héjukban, ami lehetővé teszi számukra, hogy más atomokkal több kovalens kötést hozzanak létre (amelyekről alább lesz szó). Így a periódusos rendszer oszlopai ezen elemek külső elektronhéjainak potenciálisan közös állapotát jelölik, amely felelős hasonló kémiai tulajdonságaikért.
Elektronorbitálisok
Bár hasznos az egyes elemek reakcióképességének és kémiai kötéseinek magyarázatához, az atom Bohr-féle modellje nem tükrözi pontosan, hogy az elektronok térben hogyan helyezkednek el az atommag körül. Nem úgy keringenek az atommag körül, mint a Föld a Nap körül, hanem elektronpályákon találhatók. Ezek a viszonylag bonyolult alakzatok abból adódnak, hogy az elektronok nemcsak részecskékként, hanem hullámokként is viselkednek. A kvantummechanikából származó matematikai egyenletek, az úgynevezett hullámfüggvények egy bizonyos valószínűségi szinten belül meg tudják jósolni, hogy egy elektron hol lehet egy adott időpontban. Azt a területet, ahol egy elektron a legnagyobb valószínűséggel található, orbitálisnak nevezzük.

4. ábra. Kattintson a nagyobb képért. Az s alhéjak gömb alakúak. Mind az 1n, mind a 2n főhéjnak van s orbitálja, de a gömb mérete a 2n orbitálisnál nagyobb. Mindegyik gömb egy-egy orbitál. A p alhéjakat három lengőhüvely alakú orbitál alkotja. A 2n főhéjnak van p alhéja, de az 1. héjnak nincs.
Emlékezzünk vissza, hogy a Bohr-modell egy atom elektronhéj-konfigurációját ábrázolja. Minden elektronhéjon belül vannak alhéjak, és minden alhéjnak meghatározott számú elektronokat tartalmazó pályája van. Bár lehetetlen pontosan kiszámítani, hogy egy elektron hol helyezkedik el, a tudósok tudják, hogy nagy valószínűséggel a saját pályáján belül helyezkedik el. Az alhéjakat az s, p, d és f betűkkel jelölik. Az s alhéj gömb alakú, és egy pályával rendelkezik. Az 1n főhéjnak csak egyetlen s orbitálisa van, amely két elektron befogadására képes. A 2n főhéj egy s és egy p alhéjjal rendelkezik, és összesen nyolc elektron befogadására képes. A p alhéjnak három, a 4. ábrán bemutatott lengőhüvely alakú orbitálja van. A d és f alhéjak összetettebb alakúak, és öt, illetve hét pályát tartalmaznak. Ezek nem szerepelnek az ábrán. A 3n főhéj s, p és d alhéjakkal rendelkezik, és 18 elektront képes befogadni. A 4n főhéj s, p, d és f pályákkal rendelkezik, és 32 elektron befogadására képes. Az atommagtól távolodva az energiaszinteken található elektronok és pályák száma növekszik. A periódusos rendszerben atomról atomra haladva az elektronszerkezet úgy alakítható ki, hogy egy plusz elektront illesztünk a következő szabad pályára.
A maghoz legközelebbi pálya, az 1s pálya legfeljebb két elektron befogadására alkalmas. Ez a pálya megfelel a Bohr-féle atommodell legbelső elektronhéjának. Azért hívják 1s orbitálisnak, mert gömb alakú az atommag körül. Az 1s orbitális az atommaghoz legközelebbi orbitális, és mindig ez töltődik be először, mielőtt bármely más orbitális betölthető lenne. A hidrogénnek egy elektronja van, ezért az 1s pályán belül csak egy hely van elfoglalva. Ezt a helyet 1s1-nek nevezzük, ahol az 1s orbitálon belüli egy elektronra utal az 1s felirat. A héliumnak két elektronja van, ezért két elektronjával teljesen ki tudja tölteni az 1s pályát. Ezt 1s2-vel jelöljük, ami a hélium két elektronjára utal az 1s orbitálisban. A periódusos rendszer 4. ábráján a hidrogén és a hélium az egyetlen két elem az első sorban (periódusban); ez azért van így, mert csak az első héjukban, az 1s orbitálisban van elektronjuk. A hidrogén és a hélium az egyetlen olyan elem, amelynek elektromosan semleges állapotában az 1s és egyetlen más elektronpálya sincs.
A második elektronhéjban nyolc elektron is lehet. Ez a héj tartalmaz egy másik gömb alakú s-orbitált és három “súlyzó” alakú p-orbitált, amelyek mindegyike két elektron befogadására alkalmas, amint az a 4. ábrán látható. Az 1s pálya kitöltése után a második elektronhéjat töltjük ki, először a 2s pályát, majd a három p pályát. A p-orbitálisok feltöltésekor mindegyik egy-egy elektront vesz fel; miután minden p-orbitálisban van egy elektron, egy második is hozzáadható. A lítium (Li) három elektront tartalmaz, amelyek az első és a második héjat foglalják el. Két elektron tölti ki az 1s pályát, a harmadik elektron pedig a 2s pályát. Elektronkonfigurációja 1s22s1. A neonnak (Ne) viszont összesen tíz elektronja van: kettő a legbelső 1s pályán, nyolc pedig a második héjban (két-két elektron a 2s és három p pályán); ezért inert gáz, és energetikailag stabil egyetlen atomként, amely ritkán létesít kémiai kötést más atomokkal. A nagyobb elemek további pályákkal rendelkeznek, amelyek a harmadik elektronhéjat alkotják. Bár az elektronhéjak és az orbitálok fogalma szorosan kapcsolódik egymáshoz, az orbitálok pontosabb képet adnak az atom elektronkonfigurációjáról, mivel az orbitális modell meghatározza az elektronok által elfoglalható összes hely különböző alakját és speciális orientációját.
Nézd meg ezt a vizuális animációt, hogy lásd a p és s orbitálok térbeli elrendezését. Vegye figyelembe, hogy ez a videó nem tartalmaz hangot.
Az “Atomi pályák – A szkandium elektronkonfigurációja” című videó hangleírásának szövegét itt nézheti meg (új ablakban nyílik meg).
Videó áttekintés
Ez a videó újabb áttekintést ad az elektronról:
Kipróbáld
Tegyél hozzá!
Javítsd ezt az oldaltTudj meg többet