Résultats d’apprentissage
- Décrire le comportement et la localisation des électrons, et comment ces facteurs influencent la formation de liaisons entre les atomes
Coquilles d’électrons et modèle de Bohr

Figure 1. Le modèle de Bohr.
Il faut souligner qu’il existe un lien entre le nombre de protons d’un élément, le numéro atomique qui distingue un élément d’un autre, et le nombre d’électrons qu’il possède. Dans tous les atomes électriquement neutres, le nombre d’électrons est le même que le nombre de protons. Ainsi, chaque élément, du moins lorsqu’il est électriquement neutre, possède un nombre caractéristique d’électrons égal à son numéro atomique.
Un premier modèle de l’atome a été développé en 1913 par le scientifique danois Niels Bohr (1885-1962). Dans ce modèle, les électrons existent à l’intérieur de coquilles principales. Un électron se trouve normalement dans la coquille la moins énergétique disponible, qui est la plus proche du noyau. L’énergie d’un photon de lumière peut le faire passer à une enveloppe d’énergie supérieure, mais cette situation est instable et l’électron retourne rapidement à l’état fondamental. Dans le processus, un photon de lumière est libéré.
Le modèle de Bohr montre l’atome comme un noyau central contenant des protons et des neutrons, avec les électrons dans des orbitales circulaires à des distances spécifiques du noyau, comme illustré dans la figure 1. Ces orbites forment des coquilles électroniques ou niveaux d’énergie, qui sont une façon de visualiser le nombre d’électrons dans les coquilles les plus extérieures. Ces niveaux d’énergie sont désignés par un nombre et le symbole « n ». Par exemple, 1n représente le premier niveau d’énergie situé le plus près du noyau.
Les électrons remplissent les orbitales dans un ordre cohérent : ils remplissent d’abord les orbitales les plus proches du noyau, puis ils continuent à remplir des orbitales d’énergie croissante plus loin du noyau. S’il existe plusieurs orbitales d’énergie égale, elles seront remplies par un électron dans chaque niveau d’énergie avant qu’un deuxième électron ne soit ajouté. Les électrons du niveau d’énergie le plus externe déterminent la stabilité énergétique de l’atome et sa tendance à former des liaisons chimiques avec d’autres atomes pour former des molécules.
Dans des conditions standard, les atomes remplissent d’abord les coquilles internes, ce qui entraîne souvent un nombre variable d’électrons dans la coquille la plus externe. La coquille la plus interne a un maximum de deux électrons, mais les deux coquilles électroniques suivantes peuvent chacune avoir un maximum de huit électrons. C’est ce que l’on appelle la règle de l’octuor, selon laquelle, à l’exception de la coquille la plus interne, les atomes sont énergétiquement plus stables lorsqu’ils ont huit électrons dans leur coquille de valence, la coquille électronique la plus externe. Des exemples de quelques atomes neutres et de leurs configurations électroniques sont présentés dans la figure 2. Remarquez que dans cette figure, l’hélium possède une couche électronique externe complète, avec deux électrons remplissant sa première et unique couche. De même, le néon possède une couche externe 2n complète contenant huit électrons. En revanche, le chlore et le sodium ont respectivement sept et un dans leur coquille externe, mais théoriquement ils seraient plus stables énergétiquement s’ils suivaient la règle de l’octuor et en avaient huit.
Question pratique
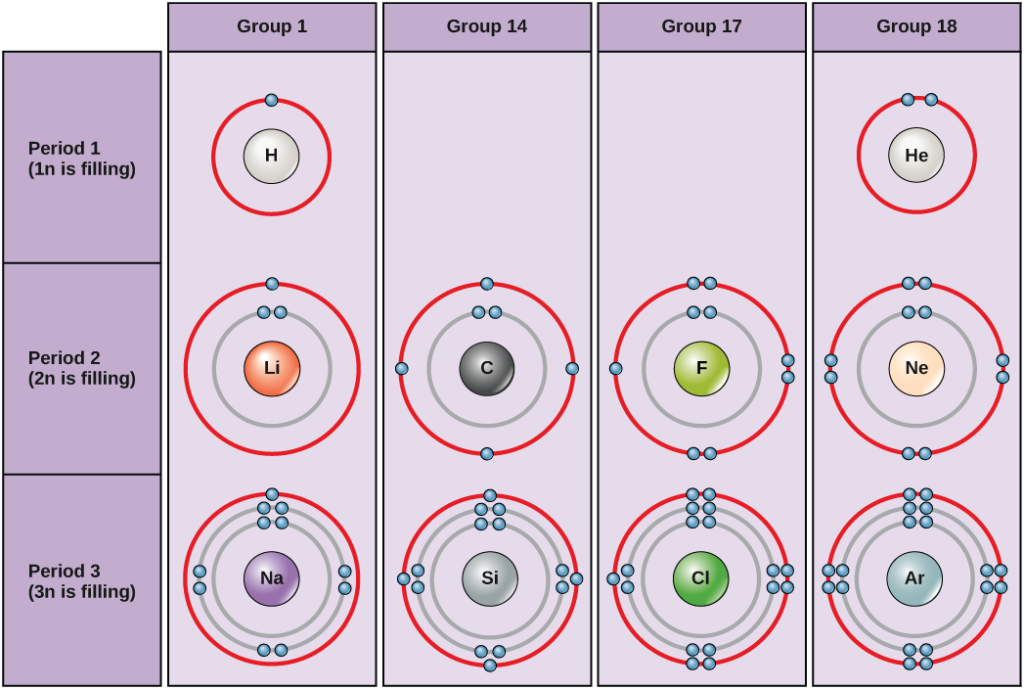
Figure 2. Diagrammes de Bohr pour l’hydrogène, l’hélium, le lithium, le carbone, le fluor, le néon, le sodium, le silicium, le chlore et l’argon.
Les diagrammes de Bohr indiquent combien d’électrons remplissent chaque enveloppe principale. Les éléments du groupe 18 (l’hélium, le néon et l’argon sont représentés sur la figure 2) ont une coquille extérieure, ou de valence, complète. Une coquille de valence pleine est la configuration électronique la plus stable. Les éléments des autres groupes ont des coquilles de valence partiellement remplies et gagnent ou perdent des électrons pour obtenir une configuration électronique stable.
Un atome peut donner, prendre ou partager des électrons avec un autre atome pour obtenir une coquille de valence complète, la configuration électronique la plus stable. En observant cette figure, combien d’électrons les éléments du groupe 1 doivent-ils perdre pour obtenir une configuration électronique stable ? Combien d’électrons les éléments des groupes 14 et 17 doivent-ils gagner pour obtenir une configuration stable ?
Comprendre que l’organisation du tableau périodique est basée sur le nombre total de protons (et d’électrons) nous aide à savoir comment les électrons sont distribués parmi la coquille extérieure. Le tableau périodique est organisé en colonnes et en rangées en fonction du nombre d’électrons et de l’emplacement de ces électrons. Regardez de plus près certains des éléments de la colonne d’extrême droite du tableau périodique dans la figure 3.

Figure 3. Le tableau périodique indique la masse atomique et le numéro atomique de chaque élément. Le numéro atomique apparaît au-dessus du symbole de l’élément et la masse atomique approximative apparaît en dessous.
Les atomes du groupe 18, l’hélium (He), le néon (Ne) et l’argon (Ar), ont tous des enveloppes électroniques extérieures remplies, ce qui rend inutile le partage d’électrons avec d’autres atomes pour atteindre la stabilité ; ils sont très stables en tant qu’atomes uniques. Leur non-réactivité leur a valu d’être appelés les gaz inertes (ou gaz nobles). Comparez cela aux éléments du groupe 1 de la colonne de gauche. Ces éléments, dont l’hydrogène (H), le lithium (Li) et le sodium (Na), possèdent tous un électron dans leur enveloppe extérieure. Cela signifie qu’ils peuvent obtenir une configuration stable et une enveloppe extérieure remplie en donnant ou en partageant un électron avec un autre atome ou une molécule comme l’eau. L’hydrogène donnera ou partagera son électron pour obtenir cette configuration, tandis que le lithium et le sodium donneront leur électron pour devenir stables. En raison de la perte d’un électron chargé négativement, ils deviennent des ions chargés positivement. Les éléments du groupe 17, y compris le fluor et le chlore, ont sept électrons dans leur coquille extérieure. Ils ont donc tendance à remplir cette coquille avec un électron d’autres atomes ou molécules, ce qui en fait des ions chargés négativement. Les éléments du groupe 14, dont le carbone est le plus important pour les systèmes vivants, ont quatre électrons dans leur coquille extérieure, ce qui leur permet de créer plusieurs liaisons covalentes (discutées ci-dessous) avec d’autres atomes. Ainsi, les colonnes du tableau périodique représentent l’état potentiel partagé des coquilles électroniques externes de ces éléments qui est responsable de leurs caractéristiques chimiques similaires.
Orbitales des électrons
Bien qu’utile pour expliquer la réactivité et la liaison chimique de certains éléments, le modèle de Bohr de l’atome ne reflète pas précisément la façon dont les électrons sont répartis dans l’espace autour du noyau. Ils ne tournent pas autour du noyau comme la terre autour du soleil, mais se trouvent dans des orbitales électroniques. Ces formes relativement complexes résultent du fait que les électrons ne se comportent pas seulement comme des particules, mais aussi comme des ondes. Les équations mathématiques de la mécanique quantique, connues sous le nom de fonctions d’onde, peuvent prédire, avec un certain niveau de probabilité, où un électron peut se trouver à un moment donné. La zone où un électron a le plus de chances de se trouver est appelée son orbite.

Figure 4. Cliquez pour agrandir l’image. Les sous-coquilles s ont la forme de sphères. Les deux coquilles principales 1n et 2n ont une orbitale s, mais la taille de la sphère est plus grande dans l’orbitale 2n. Chaque sphère est une orbitale unique. Les sous-coquilles p sont constituées de trois orbitales en forme d’haltères. La coquille principale 2n possède une sous-coquille p, mais pas la coquille 1.
Rappellez-vous que le modèle de Bohr décrit la configuration de la coquille électronique d’un atome. Au sein de chaque coquille électronique se trouvent des sous-coquilles, et chaque sous-coquille possède un nombre spécifié d’orbitales contenant des électrons. Bien qu’il soit impossible de calculer l’emplacement exact d’un électron, les scientifiques savent qu’il se trouve très probablement sur la trajectoire de son orbite. Les sous-coquilles sont désignées par les lettres s, p, d et f. La sous-coquille s est de forme sphérique et possède une orbitale. La coquille principale 1n ne possède qu’une seule orbitale s, qui peut contenir deux électrons. La coquille principale 2n possède une sous-coquille s et une sous-coquille p, et peut contenir un total de huit électrons. La sous-coquille p possède trois orbitales en forme d’haltère, comme l’illustre la figure 4. Les sous-coquilles d et f ont des formes plus complexes et contiennent respectivement cinq et sept orbitales. Elles ne sont pas représentées sur l’illustration. La coque principale 3n possède des sous-coques s, p et d et peut contenir 18 électrons. La coquille principale 4n possède des orbitales s, p, d et f et peut contenir 32 électrons. En s’éloignant du noyau, le nombre d’électrons et d’orbitales présents dans les niveaux d’énergie augmente. En progressant d’un atome à l’autre dans le tableau périodique, la structure électronique peut être élaborée en adaptant un électron supplémentaire dans la prochaine orbitale disponible.
L’orbitale la plus proche du noyau, appelée orbitale 1s, peut contenir jusqu’à deux électrons. Cette orbitale est équivalente à la coquille électronique la plus interne du modèle de Bohr de l’atome. On l’appelle l’orbitale 1s parce qu’elle est sphérique autour du noyau. L’orbitale 1s est l’orbitale la plus proche du noyau et elle est toujours remplie en premier, avant que toute autre orbitale puisse être remplie. L’hydrogène a un électron ; par conséquent, il n’a qu’une seule place occupée dans l’orbitale 1s. Ce point est désigné par 1s1, où le 1 en exposant fait référence à l’électron de l’orbitale 1s. L’hélium possède deux électrons ; il peut donc remplir complètement l’orbitale 1s avec ses deux électrons. On parle alors de 1s2, en référence aux deux électrons de l’hélium dans l’orbitale 1s. Sur la figure 4 du tableau périodique, l’hydrogène et l’hélium sont les deux seuls éléments de la première rangée (période), car ils ne possèdent que des électrons dans leur première couche, l’orbitale 1s. L’hydrogène et l’hélium sont les deux seuls éléments qui possèdent l’orbitale 1s et aucune autre orbitale électronique à l’état électriquement neutre.
La deuxième coquille électronique peut contenir huit électrons. Cette coquille contient une autre orbitale s sphérique et trois orbitales p en forme d' »haltères », qui peuvent chacune contenir deux électrons, comme le montre la figure 4. Une fois l’orbitale 1s remplie, la deuxième enveloppe électronique est remplie, en remplissant d’abord son orbitale 2s, puis ses trois orbitales p. Lors du remplissage des orbitales p, les orbitales s sont remplies d’électrons. Lorsque l’on remplit les orbitales p, chacune d’entre elles prend un seul électron ; une fois que chaque orbitale p a un électron, on peut en ajouter un deuxième. Le lithium (Li) contient trois électrons qui occupent les première et deuxième coquilles. Deux électrons occupent l’orbitale 1s et le troisième remplit l’orbitale 2s. Sa configuration électronique est 1s22s1. Le néon (Ne), quant à lui, possède un total de dix électrons : deux se trouvent dans l’orbitale 1s la plus interne et huit remplissent sa deuxième enveloppe (deux dans l’orbitale 2s et trois dans l’orbitale p) ; c’est donc un gaz inerte et énergétiquement stable en tant qu’atome unique qui formera rarement une liaison chimique avec d’autres atomes. Les éléments plus grands possèdent des orbitales supplémentaires, qui constituent la troisième enveloppe électronique. Bien que les concepts de coquilles électroniques et d’orbitales soient étroitement liés, les orbitales fournissent une représentation plus précise de la configuration électronique d’un atome parce que le modèle orbital spécifie les différentes formes et les orientations spéciales de tous les endroits que les électrons peuvent occuper.
Voyez cette animation visuelle pour voir la disposition spatiale des orbitales p et s. Notez que cette vidéo n’a pas d’audio.
Vous pouvez voir le texte de description audio pour « Orbitales atomiques – Configuration des électrons du scandium » ici (s’ouvre dans une nouvelle fenêtre).
Revue vidéo
Cette vidéo donne un autre aperçu de l’électron :
Essayez-le
Contribuez !
Améliorer cette pageEn savoir plus
.