Lernergebnisse
- Beschreiben Sie das Verhalten und die Lage von Elektronen und wie diese Faktoren die Bindungsbildung zwischen Atomen beeinflussen
Elektronenschalen und das Bohrsche Modell

Abbildung 1. Das Bohrsche Modell.
Es sollte betont werden, dass es einen Zusammenhang zwischen der Anzahl der Protonen in einem Element, der Ordnungszahl, die ein Element von einem anderen unterscheidet, und der Anzahl der Elektronen gibt. In allen elektrisch neutralen Atomen ist die Anzahl der Elektronen gleich der Anzahl der Protonen. Somit hat jedes Element, zumindest wenn es elektrisch neutral ist, eine charakteristische Anzahl von Elektronen, die seiner Ordnungszahl entspricht.
Ein frühes Modell des Atoms wurde 1913 von dem dänischen Wissenschaftler Niels Bohr (1885-1962) entwickelt. In diesem Modell existieren die Elektronen in Hauptschalen. Ein Elektron befindet sich normalerweise in der Schale mit der niedrigsten Energie, die dem Atomkern am nächsten ist. Die Energie eines Lichtphotons kann es in eine Schale mit höherer Energie befördern, aber diese Situation ist instabil, und das Elektron zerfällt schnell wieder in den Grundzustand. Dabei wird ein Lichtphoton freigesetzt.
Das Bohrsche Modell zeigt das Atom als einen zentralen Kern mit Protonen und Neutronen, wobei sich die Elektronen in kreisförmigen Orbitalen in bestimmten Abständen vom Kern befinden, wie in Abbildung 1 dargestellt. Diese Bahnen bilden Elektronenschalen oder Energieniveaus, mit denen die Anzahl der Elektronen in den äußersten Schalen veranschaulicht werden kann. Diese Energieniveaus werden mit einer Zahl und dem Symbol „n“ bezeichnet. Zum Beispiel steht 1n für das erste Energieniveau, das dem Kern am nächsten liegt.
Elektronen füllen Orbitale in einer konsistenten Reihenfolge: Sie füllen zuerst die Orbitale, die dem Kern am nächsten sind, dann füllen sie weiter vom Kern entfernte Orbitale mit zunehmender Energie. Wenn es mehrere Orbitale gleicher Energie gibt, werden sie in jedem Energieniveau mit einem Elektron gefüllt, bevor ein zweites Elektron hinzugefügt wird. Die Elektronen des äußersten Energieniveaus bestimmen die energetische Stabilität des Atoms und seine Neigung, mit anderen Atomen chemische Bindungen einzugehen, um Moleküle zu bilden.
Unter Standardbedingungen füllen Atome zuerst die inneren Schalen, was oft zu einer variablen Anzahl von Elektronen in der äußersten Schale führt. Die innerste Schale hat maximal zwei Elektronen, aber die nächsten beiden Elektronenschalen können jeweils bis zu acht Elektronen haben. Dies ist als Oktettregel bekannt, die besagt, dass Atome mit Ausnahme der innersten Schale energetisch stabiler sind, wenn sie acht Elektronen in ihrer Valenzschale, der äußersten Elektronenschale, haben. Beispiele für einige neutrale Atome und ihre Elektronenkonfigurationen sind in Abbildung 2 dargestellt. Man beachte, dass Helium in dieser Abbildung eine vollständige äußere Elektronenschale hat, wobei zwei Elektronen seine erste und einzige Schale ausfüllen. Ebenso hat Neon eine vollständige äußere 2n-Schale mit acht Elektronen. Im Gegensatz dazu haben Chlor und Natrium sieben bzw. eins in ihren äußeren Schalen, aber theoretisch wären sie energetisch stabiler, wenn sie der Oktettregel folgen und acht hätten.
Praxisfrage
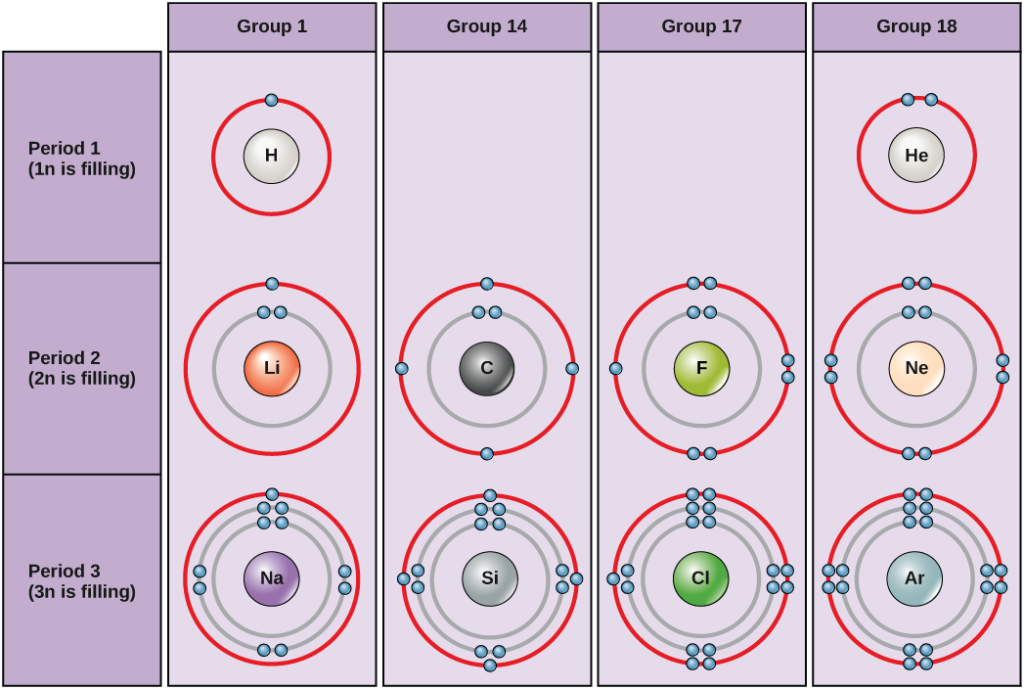
Abbildung 2. Bohr-Diagramme für Wasserstoff, Helium, Lithium, Kohlenstoff, Fluor, Neon, Natrium, Silizium, Chlor und Argon.
Bohr-Diagramme geben an, wie viele Elektronen jede Hauptschale füllen. Die Elemente der Gruppe 18 (Helium, Neon und Argon sind in Abbildung 2 dargestellt) haben eine volle äußere Schale, die Valenzschale. Eine volle Valenzschale ist die stabilste Elektronenkonfiguration. Elemente in anderen Gruppen haben teilweise gefüllte Valenzschalen und gewinnen oder verlieren Elektronen, um eine stabile Elektronenkonfiguration zu erreichen.
Ein Atom kann Elektronen abgeben, nehmen oder mit einem anderen Atom teilen, um eine volle Valenzschale, die stabilste Elektronenkonfiguration, zu erreichen. Wie viele Elektronen müssen die Elemente der Gruppe 1 verlieren, um eine stabile Elektronenkonfiguration zu erreichen? Wie viele Elektronen müssen die Elemente der Gruppen 14 und 17 gewinnen, um eine stabile Konfiguration zu erreichen?
Das Verständnis, dass die Organisation des Periodensystems auf der Gesamtzahl der Protonen (und Elektronen) basiert, hilft uns zu wissen, wie die Elektronen in der äußeren Schale verteilt sind. Das Periodensystem ist in Spalten und Zeilen gegliedert, die sich nach der Anzahl der Elektronen und der Position dieser Elektronen richten. Sieh dir einige der Elemente in der Spalte ganz rechts im Periodensystem in Abbildung 3 genauer an.

Abbildung 3. Das Periodensystem zeigt die Atommasse und die Ordnungszahl der einzelnen Elemente. Die Ordnungszahl steht über dem Symbol des Elements und die ungefähre Atommasse darunter.
Die Atome der Gruppe 18, Helium (He), Neon (Ne) und Argon (Ar), haben alle gefüllte äußere Elektronenschalen, so dass sie keine Elektronen mit anderen Atomen teilen müssen, um Stabilität zu erreichen. Ihre Nicht-Reaktivität hat dazu geführt, dass sie als Edelgase bezeichnet werden. Vergleichen Sie dies mit den Elementen der Gruppe 1 in der linken Spalte. Diese Elemente, darunter Wasserstoff (H), Lithium (Li) und Natrium (Na), haben alle ein Elektron in ihrer äußersten Schale. Das bedeutet, dass sie eine stabile Konfiguration und eine gefüllte äußere Schale erreichen können, indem sie ein Elektron an ein anderes Atom oder ein Molekül wie z. B. Wasser abgeben oder mit ihm teilen. Wasserstoff spendet oder teilt sein Elektron, um diese Konfiguration zu erreichen, während Lithium und Natrium ihr Elektron spenden, um stabil zu werden. Infolge des Verlusts eines negativ geladenen Elektrons werden sie zu positiv geladenen Ionen. Die Elemente der Gruppe 17, zu denen auch Fluor und Chlor gehören, haben sieben Elektronen in ihrer äußersten Schale, so dass sie dazu neigen, diese Schale mit einem Elektron aus anderen Atomen oder Molekülen aufzufüllen, wodurch sie zu negativ geladenen Ionen werden. Die Elemente der Gruppe 14, von denen Kohlenstoff das wichtigste für lebende Systeme ist, haben vier Elektronen in ihrer äußeren Schale, was ihnen erlaubt, mehrere kovalente Bindungen (siehe unten) mit anderen Atomen einzugehen. Die Spalten des Periodensystems stellen also den potenziell gemeinsamen Zustand der äußeren Elektronenschalen dieser Elemente dar, der für ihre ähnlichen chemischen Eigenschaften verantwortlich ist.
Elektronenorbitale
Obwohl das Bohrsche Modell des Atoms nützlich ist, um die Reaktivität und die chemischen Bindungen bestimmter Elemente zu erklären, spiegelt es nicht genau wider, wie die Elektronen räumlich um den Kern verteilt sind. Sie kreisen nicht um den Kern wie die Erde um die Sonne, sondern befinden sich in Elektronenorbitalen. Diese relativ komplexen Formen ergeben sich aus der Tatsache, dass sich Elektronen nicht nur wie Teilchen, sondern auch wie Wellen verhalten. Mathematische Gleichungen aus der Quantenmechanik, die so genannten Wellenfunktionen, können mit einer gewissen Wahrscheinlichkeit vorhersagen, wo sich ein Elektron zu einem bestimmten Zeitpunkt befinden könnte. Der Bereich, in dem sich ein Elektron am wahrscheinlichsten aufhält, wird als Orbital bezeichnet.

Abbildung 4. Für eine größere Darstellung anklicken. Die s-Unterschalen sind wie Kugeln geformt. Sowohl die 1n- als auch die 2n-Hauptschale haben ein s-Orbital, aber die Größe der Kugel ist beim 2n-Orbital größer. Jede Kugel ist ein einzelnes Orbital. Die p-Unterschalen bestehen aus drei hantelförmigen Orbitalen. Die Hauptschale 2n hat eine p-Unterschale, die Schale 1 jedoch nicht.
Erinnern Sie sich, dass das Bohr-Modell die Elektronenschalenkonfiguration eines Atoms darstellt. Innerhalb jeder Elektronenschale gibt es Unterschalen, und jede Unterschale hat eine bestimmte Anzahl von Orbitalen, die Elektronen enthalten. Obwohl es unmöglich ist, genau zu berechnen, wo sich ein Elektron befindet, wissen die Wissenschaftler, dass es sich höchstwahrscheinlich innerhalb seiner Orbitalbahn befindet. Die Unterschalen werden mit den Buchstaben s, p, d und f bezeichnet. Die Unterschale s ist kugelförmig und hat ein Orbital. Die Hauptschale 1n hat nur ein einziges s-Orbital, das zwei Elektronen aufnehmen kann. Die Hauptschale 2n hat eine s- und eine p-Unterschale, die insgesamt acht Elektronen aufnehmen kann. Die p-Unterschale hat drei hantelförmige Orbitale, wie in Abbildung 4 dargestellt. Die Unterschalen d und f haben eine komplexere Form und enthalten fünf bzw. sieben Orbitale. Diese sind in der Abbildung nicht dargestellt. Die Hauptschale 3n hat s-, p- und d-Unterschalen und kann 18 Elektronen aufnehmen. Die Hauptschale 4n hat s-, p-, d- und f-Orbitale und kann 32 Elektronen aufnehmen. Mit zunehmender Entfernung vom Kern nimmt die Anzahl der Elektronen und Orbitale in den Energieniveaus zu. Wenn man im Periodensystem von einem Atom zum nächsten geht, kann man die Elektronenstruktur berechnen, indem man ein zusätzliches Elektron in das nächste verfügbare Orbital einfügt.
Das dem Kern am nächsten liegende Orbital, das so genannte 1s-Orbital, kann bis zu zwei Elektronen aufnehmen. Dieses Orbital entspricht der innersten Elektronenschale des Bohrschen Atommodells. Es wird als 1s-Orbital bezeichnet, weil es kugelförmig um den Atomkern herum verläuft. Das 1s-Orbital ist das dem Kern am nächsten gelegene Orbital und wird immer zuerst besetzt, bevor ein anderes Orbital besetzt werden kann. Wasserstoff hat ein Elektron; daher ist nur eine Stelle im 1s-Orbital besetzt. Diese wird als 1s1 bezeichnet, wobei die hochgestellte 1 das eine Elektron im 1s-Orbital bezeichnet. Helium hat zwei Elektronen und kann daher das 1s-Orbital mit seinen beiden Elektronen vollständig besetzen. Dies wird als 1s2 bezeichnet, was sich auf die beiden Elektronen des Heliums im 1s-Orbital bezieht. Im Periodensystem (Abbildung 4) sind Wasserstoff und Helium die einzigen beiden Elemente in der ersten Reihe (Periode), weil sie nur in ihrer ersten Schale, dem 1s-Orbital, Elektronen haben. Wasserstoff und Helium sind die einzigen beiden Elemente, die im elektrisch neutralen Zustand das 1s-Orbital und keine anderen Elektronen-Orbitale haben.
Die zweite Elektronenschale kann acht Elektronen enthalten. Diese Schale enthält ein weiteres kugelförmiges s-Orbital und drei „hantelförmige“ p-Orbitale, von denen jedes zwei Elektronen aufnehmen kann, wie in Abbildung 4 dargestellt. Nachdem das 1s-Orbital gefüllt ist, wird die zweite Elektronenschale gefüllt, wobei zuerst das 2s-Orbital und dann die drei p-Orbitale gefüllt werden. Beim Auffüllen der p-Orbitale nimmt jedes ein einzelnes Elektron auf; sobald jedes p-Orbital ein Elektron hat, kann ein zweites hinzugefügt werden. Lithium (Li) enthält drei Elektronen, die die erste und zweite Schale besetzen. Zwei Elektronen besetzen das 1s-Orbital, und das dritte Elektron besetzt das 2s-Orbital. Seine Elektronenkonfiguration ist 1s22s1. Neon (Ne) hingegen hat insgesamt zehn Elektronen: zwei im innersten 1s-Orbital und acht in der zweiten Schale (je zwei im 2s-Orbital und drei im p-Orbital); es ist also ein Edelgas und energetisch stabil als Einzelatom, das nur selten eine chemische Verbindung mit anderen Atomen eingeht. Größere Elemente haben zusätzliche Orbitale, die die dritte Elektronenschale bilden. Die Konzepte von Elektronenschalen und Orbitalen sind zwar eng miteinander verwandt, doch bieten Orbitale eine genauere Darstellung der Elektronenkonfiguration eines Atoms, da das Orbitalmodell die verschiedenen Formen und speziellen Ausrichtungen aller Plätze, die Elektronen einnehmen können, spezifiziert.
Sehen Sie sich diese visuelle Animation an, um die räumliche Anordnung der p- und s-Orbitale zu sehen. Beachten Sie, dass dieses Video keinen Ton enthält.
Sie können den Audio-Beschreibungstext für „Atomic Orbitals – Electron Configuration of Scandium“ hier ansehen (öffnet in neuem Fenster).
Video Review
Dieses Video gibt einen weiteren Überblick über das Elektron:
Try It
Contribute!
Verbessern Sie diese SeiteMehr erfahren