Palladia Indicaciones
Los comprimidos de PALLADIA están indicados para el tratamiento de mastocitomas cutáneos recurrentes de grado Patnaik II o III, con o sin afectación de los ganglios linfáticos regionales en perros.
Dosificación y administración
Siempre proporcione la hoja de información al cliente con la receta. Administrar una dosis inicial de 3,25 mg/kg (1,48 mg/lb) de peso corporal, por vía oral en días alternos (ver Tabla 1). Pueden utilizarse reducciones de la dosis de 0,5 mg/kg (hasta una dosis mínima de 2,2 mg/kg (1,0 mg/lb) en días alternos) e interrupciones de la dosis (suspensión de PALLADIA durante un máximo de dos semanas), si es necesario, para controlar las reacciones adversas (véase la Tabla 2, así como las Advertencias y Precauciones). Ajustar la dosis basándose en evaluaciones veterinarias aproximadamente semanales durante las primeras 6 semanas y aproximadamente cada 6 semanas, a partir de entonces. PALLADIA puede administrarse con o sin alimentos. No dividir los comprimidos.
Tabla 1. 3.Tabla de dosis de 25 mg/kg
|
Peso corporal del perro |
Número de comprimidos |
||||
|
Libras |
Kilogramos |
Dosis |
10 mg |
15 mg |
50 mg |
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
|||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
|||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
|||
|
18.6 – 22,0 |
8,5 – 10,0 |
30 mg |
|||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
|||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
|||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
|||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
|||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
|||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
|||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
|||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
|||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
|||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
|||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
|||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
|||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
|||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
|||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
|||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
|||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||
|
139.0 – 144,0 |
63,1 – 65,3 |
210 mg |
|||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
|||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
|||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
|||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
|||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
|||
Tabla 2: Modificación de la dosis según la toxicidad observada
|
Toxicidad |
Ajuste de la dosis |
|
Neutropenia |
|
|
>1000/µL |
Mantener nivel de dosis |
|
≤1000/µL o fiebre neutropénica o infección |
Suspender el fármaco hasta que >1000/µL y los signos clínicos sean normales; entonces disminuir la dosis en 0.5 mg/kg |
|
Toxicidades renales (creatinina) |
|
|
<2.0 mg/dL |
Mantener el nivel de la dosis |
|
≥2,0 mg/dL |
Suspender el fármaco hasta <2.0 mg/dL y luego disminuir la dosis en 0,5 mg/kg |
|
Albúmina |
|
|
<1,5 g/dL |
Suspender el fármaco hasta >2.5 g/dL y luego disminuir la dosis en 0,5 mg/kg |
|
Hematocrito |
|
|
<26% |
Suspender el fármaco hasta >30% y luego disminuir la dosis en 0.5 mg/kg |
|
Diarrea |
|
|
<4 deposiciones acuosas/día durante menos de 2 días |
Mantener el nivel de dosis y instituir cuidados de apoyo |
|
≥4 deposiciones acuosas/día o ≥ 2 días |
Suspender el medicamento hasta que se formen deposiciones e instituir cuidados de apoyo. Cuando se reanude la dosificación, disminuir la dosis en 0,5 mg/kg |
|
GI Sangrado |
|
|
Sangre fresca en las heces o heces negras alquitranadas durante > 2 días o hemorragia franca o coágulos de sangre en las heces. |
Suspender el fármaco e instituir cuidados de apoyo hasta la resolución de todos los signos clínicos de sangre en las heces, entonces disminuir la dosis en 0.5 mg/kg. |
Contraindicaciones
No utilizar en perros utilizados para la cría, ni en perras gestantes o lactantes (ver Farmacología Clínica).
Advertencias
PALLADIA puede causar disfunción vascular que puede conducir a edema y tromboembolismo, incluyendo tromboembolismo pulmonar. Suspender el medicamento hasta que los signos clínicos y la patología clínica se hayan normalizado. Para asegurar la homeostasis de la vasculatura, espere al menos 3 días después de suspender el fármaco antes de realizar una intervención quirúrgica (ver Reacciones adversas).
En perros tratados con PALLADIA se han producido raramente complicaciones gastrointestinales graves y a veces mortales, incluyendo perforación gastrointestinal (ver Reacciones adversas). Si se sospecha de ulceración gastrointestinal, interrumpa la administración del medicamento y trátelo adecuadamente.
Advertencias en humanos:
NO USAR EN HUMANOS. MANTENGA ÉSTE Y TODOS LOS MEDICAMENTOS FUERA DEL ALCANCE DE LOS NIÑOS. Los niños no deben entrar en contacto con PALLADIA. Mantenga a los niños alejados de las heces, la orina o el vómito de los perros tratados. Para evitar la exposición al medicamento, lávese las manos con agua y jabón después de administrar PALLADIA y utilice guantes de protección para evitar el contacto directo con las heces, la orina, el vómito y los comprimidos de PALLADIA rotos o humedecidos. Coloque todos los materiales de desecho en una bolsa de plástico y séllela antes de su eliminación general. En caso de exposición accidental de los ojos al medicamento, enjuagar los ojos con agua inmediatamente. En caso de ingestión accidental por parte de una persona, acuda inmediatamente al médico, muéstrele el prospecto o la etiqueta. Pueden producirse molestias gastrointestinales como vómitos o diarrea si se ingiere accidentalmente este medicamento.
Las mujeres embarazadas, las que puedan quedar embarazadas o las madres lactantes deben prestar especial atención a estas precauciones de manipulación. (Véanse las instrucciones de manipulación más arriba.) PALLADIA, al igual que otros medicamentos de su clase, impide la formación de nuevos vasos sanguíneos en los tumores. De forma similar, PALLADIA puede afectar a la formación de vasos sanguíneos en el feto en desarrollo y puede dañar al feto (causar defectos de nacimiento). En el caso de las mujeres embarazadas, la ingestión accidental de PALLADIA puede tener efectos adversos sobre el embarazo.
Precauciones
Interrumpa temporalmente el uso de PALLADIA si se producen simultáneamente anemia, azotemia, hipoalbuminemia e hiperfosfatemia. Reanudar el tratamiento con una reducción de la dosis de 0,5 mg/kg después de 1 a 2 semanas cuando los valores hayan mejorado y la albúmina sea >2,5 g/dL. Puede ser necesario interrumpir temporalmente el tratamiento si se produce solo alguno de estos casos: hematocrito <26%, creatinina ≥2,0 mg/dL o albúmina <1,5 g/dL. A continuación, reanudar el tratamiento con una reducción de la dosis de 0,5 mg/kg una vez que el hematocrito sea >30%, la creatinina sea <2,0 mg/dL y la albúmina sea >2,5 g/dL.
Interrumpir temporalmente el uso de PALLADIA si el recuento de neutrófilos es ≤1000/µL. Reanudar el tratamiento después de 1 a 2 semanas con una reducción de la dosis de 0,5 mg/kg, cuando el recuento de neutrófilos haya vuelto a ser >1000/µL. Pueden ser necesarias reducciones adicionales de la dosis si reaparece la neutropenia grave.
La presencia de un mastocitoma sistémico antes del tratamiento puede predisponer a un perro a una degranulación de mastocitos clínicamente significativa con posibles reacciones adversas sistémicas graves cuando se trata con PALLADIA. Se debe intentar descartar la mastocitosis sistémica antes de iniciar el tratamiento con PALLADIA.
PALLADIA se ha asociado con diarrea grave o hemorragia gastrointestinal que requiere un tratamiento rápido. Puede ser necesario interrumpir y reducir la dosis dependiendo de la gravedad de los signos clínicos. (Ver Tabla 2 en Posología y Administración.)
Utilizar con precaución los antiinflamatorios no esteroideos junto con PALLADIA debido a un mayor riesgo de ulceración o perforación gastrointestinal.
PALLADIA se metaboliza en el hígado. La coadministración de PALLADIA con fuertes inhibidores de la familia CYP3A4 puede aumentar las concentraciones de PALLADIA. No se ha evaluado el efecto de los medicamentos concomitantes que pueden inhibir el metabolismo de PALLADIA. Debe vigilarse la compatibilidad de los medicamentos en los pacientes que requieren medicamentos concomitantes.
No se ha evaluado el uso seguro de PALLADIA en perros de menos de 24 meses de edad o que pesen menos de 5 kg.
Reacciones adversas
Un estudio clínico de campo en EE.UU. compuesto por una fase enmascarada de 6 semanas, seguida de una fase abierta, evaluó la seguridad y eficacia de PALLADIA en 151 perros propiedad de clientes que tenían mastocitos cutáneos recurrentes de grado Patnaik II o III, con o sin afectación de los ganglios linfáticos regionales. Las reacciones adversas más comunes notificadas durante la fase enmascarada se resumen en la Tabla 3; las notificadas durante todo el estudio (fase enmascarada combinada con la fase abierta) se resumen en la Tabla 4.
Tabla 3. Resumen de las reacciones adversas más frecuentes durante la fase enmascaradaa
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Reacción adversa Reacción |
Cualquier gradob |
Grado 3 o 4b |
Cualquier gradob |
Grado 3 o 4b |
|
Diarrea |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anorexia |
31,3% |
6.3% |
39,1% |
6,9% |
|
Alargo |
29.7% |
3.1% |
35.6% |
4.6% |
|
Vómitos |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lamidad |
9,4% |
0,0% |
17.2% |
0,0% |
|
Pérdida de peso |
3,1% |
0.0% |
14,9% |
1,1% |
|
Sangre en las heces/sangrado por vía oral/diarrea hemorrágica |
3.1% |
0.0% |
12.6% |
2.3% |
|
Trastorno musculoesquelético |
6,3% |
0.0% |
11,5% |
1,1% |
|
Deshidratación |
4.7% |
0.0% |
9.2% |
2.3% |
|
Dermatitis |
9,4% |
1,6% |
9,2% |
0.0% |
|
Prurito |
4,7% |
0,0% |
9.2% |
0,0% |
|
Taquipnea |
4.7% |
0,0% |
8,0% |
1,1% |
|
Dolor localizado |
4,7% |
0,0% |
8.0% |
0,0% |
|
Náuseas |
3,1% |
0.0% |
8,0% |
1,1% |
|
Dolor general |
4.7% |
1,6% |
6,9% |
0,0% |
|
Polidipsia |
7,8% |
0.0% |
6,9% |
0,0% |
|
Pirexia |
3.1% |
0.0% |
5.7% |
2.3% |
|
Flatulencia |
3,1% |
0,0% |
5.7% |
0,0% |
|
Trastorno de la pigmentación |
1.6% |
0.0% |
5.7% |
0.0% |
|
Anormalidad de Laboratorio |
Cualquier Gradec |
Grado 3 o 4c |
Cualquier Gradec |
Grado 3 o 4c |
|
Neutropenia |
6.3% |
0.0% |
46.0% |
0,0% |
|
Trombocitopenia |
20,3% |
0,0% |
24,1% |
0.0% |
|
Aumento de la alanina aminotransferasa |
21,9% |
4.7% |
24,1% |
1,1% |
|
Hipoalbuminemia |
7.8% |
0,0% |
12,6% |
0,0% |
|
Disminución del hematocrito |
7,8% |
0.0% |
5,7% |
3,4% |
|
Hiperbilirrubinemia |
1.6% |
1.6% |
5.7% |
0.0% |
|
Aumento de la creatinina |
4,7% |
0,0% |
5.7% |
0,0% |
|
Infección del tracto urinario |
1.6% |
0,0% |
5,7% |
0,0% |
a El tiempo medio de estudio durante la fase enmascarada fue de 37,0 días para los perros tratados con PALLADIA (mediana, 42.0 días) y 27,6 días para los perros tratados con placebo (mediana, 21,0 días); no se realizaron ajustes en las comparaciones estadísticas por esta disparidad.
b Los investigadores asignaron un grado de gravedad de 1, 2, 3 o 4 (1 – menos grave; 4 – más grave).
c La clasificación de las anomalías de laboratorio se basó en la directriz Common Toxicity Criteria del Instituto Nacional del Cáncer adaptada para los caninos (1 – menos grave; 4 – más grave).
Tabla 4. Resumen de las reacciones adversas más comunes durante el estudio (fase enmascarada combinada con la fase abierta).a
|
PALLADIA (n = 145) a |
||
|
Reacciones adversas |
Cualquier gradob |
Grado 3 ó 4b |
|
Diarrea |
58.6% |
8,3% |
|
Anorexia |
49.7% |
8,3% |
|
Vómitos |
47.6% |
9,7% |
|
Alargo |
39,3% |
4.1% |
|
Pérdida de peso |
22,8% |
0,0% |
|
Pérdida de peso |
21,4% |
2.8% |
|
Sangre en las heces/sangrado por vía oral/diarrea hemorrágica |
18.6% |
2,8% |
|
Deshidratación |
15,2% |
2.1% |
|
Prurito |
12,4% |
0,0% |
|
Trastorno de la pigmentación |
11.7% |
0,0% |
|
Dermatitis |
11.0% |
0,0% |
|
Trastorno musculoesquelético |
11,0% |
0,0% |
|
Dolor general |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0,0% |
|
Taquipnea |
8,3% |
0.0% |
|
Náuseas |
7,6% |
1.4% |
|
Polidipsia |
7,6% |
0,0% |
|
Pirexia |
6.9% |
2,8% |
|
Artritis |
6,2% |
0,0% |
|
Edema localizado |
6.2% |
0,0% |
|
Infección cutánea bacteriana |
5,5% |
0,0% |
|
Conjuntivitis |
5.5% |
0.0% |
|
Anormalidad de laboratorio |
Cualquier grado |
Grado 3 o 4c |
|
Neutropenia |
44.8% |
1,4% |
|
Hipoalbuminemia |
28,3% |
1.4% |
|
Trombocitopenia |
28,3% |
2.1% |
|
Aumento de la alanina aminotransferasa |
27,6% |
4.1% |
|
Disminución del hematocrito |
11,0% |
2.8% |
|
Aumento de la creatinina |
13,8% |
1,4% |
|
Hiperbilirrubinemia |
6,9% |
0.0% |
|
Infección del tracto urinario |
7,6% |
0,0% |
a La duración del tratamiento con PALLADIA osciló entre 2 y 812 días (media, 144 días; mediana, 68 días). Todos los perros recibieron al menos 1 dosis de PALLADIA.
b Los investigadores asignaron un grado de gravedad de 1, 2, 3 o 4 (1 – menos grave; 4 – más grave).
c La clasificación de las anomalías de laboratorio se basó en la directriz Common Toxicity Criteria del Instituto Nacional del Cáncer adaptada a los caninos (1 – menos grave; 4 – más grave).
Se notificaron otros acontecimientos adversos, pero ocurrieron en < el 5% de los perros. Cualquier perro individual puede haber tenido múltiples acontecimientos adversos.
Hubo 5 muertes durante este estudio que posiblemente estaban relacionadas con el medicamento. Los hallazgos patológicos revelaron generalmente evidencia de disfunción vascular, incluyendo tromboembolismo pulmonar (postoperatorio); fallo multiorgánico asociado a vasculitis y trombosis; trombosis vascular con coagulopatía intravascular diseminada (CID) y pancreatitis; y vasculitis con CID. Un perro murió como consecuencia de una perforación gástrica; la duración del tratamiento con PALLADIA fue de 221 días y no hubo evidencia de mastocitoma en la necropsia. Estas muertes se produjeron en presencia o ausencia de enfermedad macroscópica; la duración del tratamiento osciló entre 18 y 221 días.
Se desconoce la relación de las siguientes muertes con el medicamento. Un perro, tratado por primera vez durante 3 semanas con un placebo, murió por causa desconocida 7 días después del inicio del tratamiento con PALLADIA. Otro perro murió por causa desconocida 92 días después del inicio del tratamiento con PALLADIA. No se realizó necropsia a ninguno de los dos perros.
Veintisiete perros desarrollaron alguna forma de hemorragia gastrointestinal, con un 2,8% de perros con hemorragia grave. Un perro desarrolló una ulceración gástrica que posiblemente estaba relacionada con el fármaco. Tres perros murieron por perforaciones gástricas (1 perro) o duodenales (2 perros) durante el estudio. Un perro con una perforación duodenal recibió sólo 1 dosis del fármaco del estudio y, por tanto, no se consideró relacionado con el fármaco.
Siete perros desarrollaron despigmentación nasal en las primeras semanas de tratamiento. Once perros desarrollaron cambios en el color del pelaje o en la piel durante el estudio. Dos de estos perros tuvieron cambios completos en el color del pelaje, de leonado a blanco y de rojo intenso a rubio. Siete perros experimentaron alopecia.
Hay un efecto relacionado con el fármaco en el peso corporal: el 20,0% de los perros tuvieron >13% de pérdida de peso en la fase enmascarada más abierta atribuible al fármaco. De estos, 5 perros tuvieron >25% de pérdida de peso.
Tres perros tuvieron actividad similar a las convulsiones mientras tomaban el medicamento del estudio. No se puede determinar si éstas estaban relacionadas con el fármaco.
Dos perros desarrollaron epistaxis que no se asoció con trombocitopenia. Otro perro desarrolló epistaxis con coagulopatía intravascular diseminada concurrente.
Para obtener una copia de la Ficha de Datos de Seguridad (FDS) o para notificar acontecimientos adversos llame a Zoetis al 1-888-963-8471.
Información para los propietarios de perros:
Entregue siempre la Ficha de Información al Cliente con la prescripción y revísela con los propietarios. Los propietarios deben ser informados de las posibles reacciones adversas y de cuándo suspender el medicamento y llamar al veterinario. Se debe informar a los propietarios de las instrucciones de manipulación.
Farmacología clínica
Mecanismo de acción: El fosfato de toceranib es una pequeña molécula que tiene actividad antitumoral y antiangiogénica directa. En estudios farmacológicos no clínicos, toceranib inhibió selectivamente la actividad tirosina quinasa de varios miembros de la familia de receptores tirosina quinasa (RTK) divididos, algunos de los cuales están implicados en el crecimiento tumoral, la angiogénesis patológica y la progresión metastásica del cáncer. Toceranib inhibió la actividad de la tirosina quinasa Flk-1/KDR (receptor del factor de crecimiento endotelial vascular, VEGFR2), el receptor del factor de crecimiento derivado de las plaquetas (PDGFR) y el receptor del factor de células madre (Kit) tanto en ensayos bioquímicos como celulares. Se ha demostrado que el toceranib ejerce un efecto antiproliferativo sobre las células endoteliales in vitro. El tratamiento con toceranib puede inducir la detención del ciclo celular y la subsiguiente apoptosis en las líneas celulares tumorales que expresan mutaciones activadoras en la quinasa dividida RTK, ckit. El crecimiento de los tumores de mastocitos caninos suele estar impulsado por mutaciones activadoras en c-kit.1,2
Se sabe que otros compuestos de la clase de agentes antineoplásicos antiangiogénicos aumentan la embriotalidad y las anomalías fetales. Dado que la angiogénesis es un componente crítico del desarrollo embrionario y fetal, debe esperarse que la inhibición de la angiogénesis tras la administración de PALLADIA produzca efectos adversos en el embarazo de la perra.
Farmacocinética
Después de la administración intravenosa, la farmacocinética de toceranib se caracteriza por un volumen de distribución muy grande (>20 L/kg, lo que indica partición en los tejidos), una semivida de eliminación terminal de unas 16 horas y un aclaramiento de >1 L/hora/kg. Con un régimen de dosis de 3,25 mg de equivalente de base libre (fbe)/kg de toceranib administrado en comprimidos por vía oral en días alternos durante 2 semanas (7 dosis), los parámetros farmacocinéticos de toceranib en plasma en perros Beagle sanos (entre 7,2 – 12,5 kg) se muestran en la siguiente tabla.
Tabla 5: Parámetros farmacocinéticos
|
Parámetros farmacocinéticos (Media + 1SD) |
Total (n=11;6M, 5F) |
Total (n=10; 5M, 5F) |
|
Vida media de eliminación, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Tiempo hasta la concentración plasmática máxima, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Concentración plasmática máxima, Cmáx (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmín (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Área bajo la curva temporal de concentración plasmática, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Valor normalizado por dosis (ajustado a 3.25 mg/kg de dosis)
b Cmin es la concentración a las 48 h postdosis, que corresponde al intervalo de dosis.
La biodisponibilidad oral de toceranib es del 77%. PALLADIA está altamente unido a las proteínas en un 91% a 93%.
Debe tenerse en cuenta que a pesar de la homogeneidad de los sujetos incluidos en este estudio, se observó una gran variabilidad entre sujetos. Independientemente de la vía de administración, se ha observado una farmacocinética lineal a dosis de hasta 5 mg/kg dos veces al día. Utilizando un sistema de ensayo in vitro de hepatocitos y microsomas hepáticos, se observó que el isómero Z se metaboliza en el derivado N-óxido de toceranib en perros, humanos, gatos y ratas. Aunque se observó una pequeña diferencia de género en el estudio in vitro (81% de conversión en perros machos, 56% de conversión en perros hembras), no se observaron diferencias en la farmacocinética del toceranib in vivo. No se han investigado los efectos de la insuficiencia renal, la insuficiencia hepática o la raza en la farmacocinética de toceranib.
Eficacia
La eficacia y la seguridad de los comprimidos orales de PALLADIA para el tratamiento de los mastocitomas se evaluaron en un estudio clínico de campo aleatorizado, controlado con placebo, con doble enmascaramiento y multicéntrico. El propósito de este estudio era evaluar la eficacia y la seguridad de PALLADIA en el tratamiento de los mastocitos en perros que tenían una enfermedad medible recurrente después de la cirugía y evaluar la respuesta objetiva (respuesta completa o parcial). El tratamiento con PALLADIA se comparó con el tratamiento con placebo utilizando las tasas de respuesta al final de la fase enmascarada de 6 semanas. Las tasas de respuesta se determinaron utilizando los Criterios de Evaluación de la Respuesta en Tumores Sólidos del Instituto Nacional del Cáncer3 que fueron modificados específicamente para la evaluación de los mastocitos caninos.
Ciento cincuenta y tres perros fueron asignados aleatoriamente al tratamiento con 3,25 mg/kg de PALLADIA (n = 88) o placebo (n = 65) por vía oral, en días alternos durante 6 semanas, o hasta la progresión de la enfermedad o la retirada del estudio por otra causa. El tratamiento se desenmascaró en el momento de la progresión de la enfermedad: a los perros que recibían placebo se les ofreció pasar a PALLADIA de etiqueta abierta; los perros que recibían PALLADIA fueron retirados del estudio. Los perros debían tener mastocitos cutáneos recurrentes de grado Patnaik II o III, con o sin afectación de los ganglios linfáticos regionales. Al menos 1 de los tumores debía tener al menos 20 mm de diámetro. Los perros tenían un límite de 1 protocolo de radiación completado y un límite de 1 régimen de quimioterapia sistémica previa. Se excluyeron los perros con evidencia de un mastocitoma sistémico. No se permitió el tratamiento con corticosteroides sistémicos durante el estudio o en los 14 días anteriores al inicio del mismo. Si era necesario para controlar las reacciones adversas, se prescribieron interrupciones de la dosis (suspensión de PALLADIA durante un máximo de 2 semanas) y/o se redujo la dosis a un nivel tan bajo como 2,2 mg/kg.
El análisis de eficacia mostró una ventaja estadísticamente significativa de PALLADIA sobre el placebo en el criterio de valoración primario de eficacia de la respuesta objetiva al final de la fase enmascarada de seis semanas. La respuesta objetiva es la respuesta completa + la respuesta parcial. La respuesta parcial es ≥ 30% de disminución en la suma del diámetro más largo de las lesiones diana, tomando como referencia la suma basal, la no progresión de las lesiones no diana y la no aparición de nuevas lesiones.
Tumor de células maestras – Resultados de eficacia primaria
|
Parámetro de eficacia |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-valor |
|
Tasa de respuesta objetiva * |
7.9% |
37.2% |
< 0.001 |
* La diferencia en la tasa de respuesta objetiva entre los grupos no se asoció significativamente con la carga tumoral (presencia frente a ausencia de afectación de los ganglios linfáticos regionales) ni con el grado del tumor (P > 0,05).
Durante el estudio, PALLADIA se administró de forma concomitante con otros medicamentos como antimicrobianos, bloqueadores de los receptores H-2, antihistamínicos, antieméticos, antiinflamatorios no esteroideos, medicamentos antiulcerosos de acción local, modificadores opiáceos de la motilidad gastrointestinal, opioides, vacunas, antihelmínticos, antiparasitarios y preparados de corticoides tópicos/oftálmicos. Durante la fase abierta solamente, 5 perros recibieron un curso breve de corticosteroides de acción corta.
Seguridad en animales:
En el estudio de seguridad en animales objetivo que se presenta a continuación, se demostró que PALLADIA tiene un estrecho margen de seguridad; los perros que están siendo tratados con PALLADIA deben ser monitorizados para detectar reacciones adversas que puedan indicar que se requiere un ajuste de la dosis. Dos perros del grupo de 6 mg/kg fueron eutanasiados por toxicidades clínicas en los días 23 y 27 del estudio, respectivamente.
Toceranib se administró por vía oral a 20 perros Beagle adultos, machos y hembras (de aproximadamente 2 años de edad) a dosis de 0 mg/kg (placebo, 12 perros), 2 mg/kg (0,5X, 8 perros), 4 mg/kg (1X, 12 perros), o 6 mg/kg (1,5X, 8 perros) una vez cada dos días durante 13 semanas consecutivas sin interrupción de la dosis. Toceranib causó pérdida de peso, disminución del consumo de alimento, cambios pancreáticos, gonadales, suprarrenales, musculares y hematopoyéticos.
El consumo de alimento disminuyó en el grupo de 6 mg/kg en comparación con el placebo, y la mayor diferencia de medias se produjo en el día 35. Se observó una disminución del peso corporal en el grupo de 4 mg/kg en el día 31 y en el grupo de 6 mg/kg en el día 15 en comparación con el placebo y continuó durante todo el estudio. La cojera relacionada con la dosis, observada casi exclusivamente en las extremidades traseras, y el dolor en las extremidades fue mayor en todos los grupos de tratamiento en comparación con el placebo, siendo el grupo de 6 mg/kg el que mostró la mayor incidencia. Se observó rigidez y debilidad casi exclusivamente en el grupo de 6 mg/kg. Se observó enrojecimiento de la mucosa oral en todos los grupos de tratamiento. Un perro del grupo de 4 mg/kg presentó ulceraciones orales y un perro del grupo de 6 mg/kg presentó ulceraciones cutáneas, ambos con presencia de infecciones bacterianas. Se observó diarrea o heces blandas en los cuatro grupos.
Los análisis hematológicos mostraron descensos en el hematocrito, la hemoglobina y el recuento de eritrocitos y un descenso en el recuento de reticulocitos en los grupos de 4 y 6 mg/kg que tendieron a recuperarse lo suficiente como para limitar más descensos en el recuento de eritrocitos. Los recuentos de glóbulos blancos fueron significativamente más bajos a lo largo del estudio en todos los grupos tratados en comparación con el placebo, principalmente debido a una disminución de los neutrófilos. Los linfocitos disminuyeron en menor medida, especialmente en la dosis baja. Los eosinófilos y los basófilos mostraron disminuciones marcadas y persistentes. Los monocitos no se vieron afectados.
El recuento de plaquetas aumentó ligeramente en los grupos de 4 y 6 mg/kg. Se observaron aumentos en el fibrinógeno en el grupo de 4 y 6 mg/kg.
Se observaron aumentos en las concentraciones de aspartato aminotransferasa, creatina quinasa y fósforo sérico en los grupos de 4 y 6 mg/kg. Se observaron aumentos de la fosfatasa alcalina en el grupo de 6 mg/kg. Se observó un aumento de la amilasa en un perro de cada grupo de tratamiento. Se observó un aumento del potasio sérico en un perro del grupo de 6 mg/kg. Se observaron aumentos de la deshidrogenasa láctica y de las globulinas en el grupo de 6 mg/kg.
Los cambios microscópicos relacionados con el tratamiento incluyeron una reducción de leve a marcada de la celularidad de la médula ósea esternal y femoral. Hubo una leve hematopoyesis extramedular correspondiente, principalmente eritropoyesis, en el bazo. En el páncreas, se produjo una degranulación acinar de leve a moderada relacionada con la dosis, caracterizada por la pérdida difusa de gránulos de zimógeno. En las glándulas suprarrenales, se produjo una mínima congestión/hemorragia cortical en todas las dosis, con una sugestiva relación con la dosis. Se observó vacuolación cortical suprarrenal con baja frecuencia en todos los grupos. Se observaron cambios relacionados con la dosis en los órganos reproductores de ambos sexos. Los varones mostraron un agotamiento de las células germinales relacionado con la dosis, vacuolación tubular y reducción del número de espermatozoides maduros. En las hembras, los ovarios mostraron una incidencia reducida de cuerpos lúteos maduros/en regresión y un aumento de la incidencia de folículos pequeños.
Dos perros (un macho y una hembra) del grupo de 6 mg/kg fueron eutanasiados por toxicidades clínicas relacionadas con el tratamiento en los días 23 y 27 del estudio, respectivamente. El inicio del síndrome terminal se observó como una marcada reducción de la ingesta de alimento y melena. Durante los 9 días siguientes, la disminución de la ingesta de alimentos progresó hasta convertirse en una anorexia casi completa y apareció la hematoquecia. Se observó pérdida de peso, letargo, cojera de las extremidades posteriores y debilidad. Los siguientes resultados de patología clínica son coherentes con los cambios observados en los otros perros del grupo de 6 mg/kg, así como con los cambios debidos a las condiciones de debilitamiento de los perros justo antes de la eutanasia. Ambos perros tenían aumentos de proteínas totales, globulinas, fósforo, colesterol, triglicéridos y fibrinógeno. Uno de los perros tenía pancitopenia, disminución del hematocrito, la hemoglobina, los reticulocitos, la albúmina y el TP y aumento de las bandas. También había hematuria. El otro perro también presentaba una disminución de los linfocitos, los eosinófilos, el cloro y el sodio y un aumento de los GR, el hematocrito, la hemoglobina, las plaquetas, la ALP, la amilasa, la creatinina, el BUN, el magnesio, el potasio y la bilirrubina total. El perfil de coagulación mostró una disminución del TP y un aumento del TPT en ambos perros. Estos perros mostraron una depleción linfoide en los ganglios linfáticos, el timo y los tejidos linfáticos asociados al intestino y lesiones gastrointestinales de leves a marcadas, además de los hallazgos microscópicos descritos en los animales que sobrevivieron hasta el final del estudio. Estos dos perros también tenían lesiones en el tracto gastrointestinal, los riñones, el páncreas, la hipófisis y las glándulas suprarrenales.
Condiciones de almacenamiento: Almacenar a temperatura ambiente controlada 20° a 25° C (68° a 77° F).
Cómo se suministra
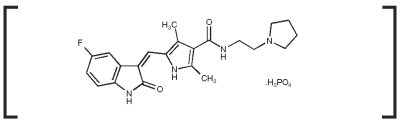
Los comprimidos de PALLADIA contienen 10 mg, 15 mg o 50 mg de toceranib como fosfato de toceranib por comprimido. Los comprimidos se presentan en frascos de 30 unidades.
1 London CA, Hannah AL, Zadovoskaya R, et al. Estudio de fase I de escalada de dosis de SU11654, un inhibidor de tirosina quinasa receptora de molécula pequeña, en perros con neoplasias espontáneas. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Aprobado por la FDA
Fabricado por: Pfizer Inc, Ascoli, Italia
Distribuido por: Zoetis Inc, Kalamazoo, MI 49007
Revisado: Agosto 2015