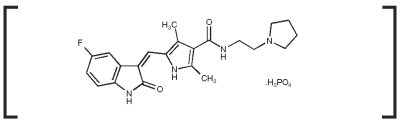
Indicações Palladia
PALLADIA comprimidos são indicados para o tratamento de Patnaik grau II ou III, recorrentes, tumores cutâneos de mastócitos com ou sem envolvimento de linfonodos regionais em cães.
Dosagem e Administração
Disponibilizar sempre a Ficha de Informação ao Cliente com receita médica. Administrar uma dose inicial de 3,25 mg/kg (1,48 mg/lb) de peso corporal, por via oral, dia sim dia não (ver Tabela 1). Reduções de dose de 0,5 mg/kg (para uma dose mínima de 2,2 mg/kg (1,0 mg/lb) a cada dois dias) e interrupções de dose (cessação do PALLADIA por até duas semanas) podem ser utilizadas, se necessário, para gerir reacções adversas (ver Tabela 2, bem como Avisos e Precauções). Ajustar a dose com base em avaliações veterinárias aproximadamente semanais durante as primeiras 6 semanas e aproximadamente a cada 6 semanas, a partir daí. A PALLADIA pode ser administrada com ou sem alimentos. Não dividir os comprimidos.
Tabela 1. 3.25 mg/kg Tabela de Doses
|
Peso Corporal Cão |
Número de Comprimidos |
||||
|
Libras |
Kilogramas |
Dose |
10 mg |
15 mg |
50 mg |
|
11.0 – 11.8 |
5.0 – 5.3 |
15 mg |
> | ||
|
11.9 – 15.2 |
5.4 – 6.9 |
20 mg |
|||
|
15.3 – 18.5 |
7.0 – 8.4 |
25 mg |
> | ||
|
18.6 – 22.0 |
8.5 – 10.0 |
30 mg |
> | > | |
| >
22.1 – 25.4 |
10.1 – 11.5 |
35 mg |
|||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg > |
> | ||
| >
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
> | ||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
|||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
> | ||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
|||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
> | ||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
|||
| >
66,0 – 71,2 |
>
30,0 – 32.3 |
100 mg |
|||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
> | ||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
|||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
> | ||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
> | ||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
> | ||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg > |
> | ||
| >
118.7 – 128,8 |
53,9 – 58,4 |
180 mg > |
> | ||
| >
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||
|
139.0 – 144,0 |
63,1 – 65,3 |
210 mg |
> | ||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
> | ||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
> | ||
| >
173.2 – 177,9 |
78,6 – 80,7 > |
260 mg > |
> | ||
| >
178.0 – 191,6 |
80,8 – 86,9 > |
265 mg |
> | ||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
> | ||
Tabela 2: Modificação de dose baseada na toxicidade observada
|
Toxicidade |
Ajuste da dose > |
|
>1000/µL |
Manter nível de dose |
|
≤1000/µL ou febre ou infecção neutropénica |
Parar o medicamento até >1000/µL e sinais clínicos normais; depois diminuir a dose em 0.5 mg/kg |
|
Toxicidade renal (Creatinina) |
|
|
<2.0 mg/dL |
Manter nível de dose |
|
≥2.0 mg/dL |
Parar droga até <2.0 mg/dL depois diminuir a dose em 0,5 mg/kg |
|
Albumina |
|
|
<1,5 g/dL |
Parar o fármaco até >2.5 g/dL depois diminuir a dose em 0,5 mg/kg |
|
Hematocritar |
|
|
<26% |
Parar o medicamento até >3>30% depois diminuir a dose em 0.5 mg/kg |
|
Diarreia |
|
|
<4 fezes aquosas/dia por menos de 2 dias |
Manter nível de dose e instituto de cuidados de apoio |
|
≥4 fezes aquosas/dia ou ≥ 2 dias |
>
Parar o medicamento até as fezes formadas e instituir cuidados de apoio. Quando a dosagem for retomada, diminuir a dose em 0,5 mg/kg |
|
Sangramento gastrointestinal |
|
|
Sangue refrescante nas fezes ou fezes negras durante > 2 dias ou hemorragia franca ou coágulos de sangue nas fezes. |
Parar o medicamento e instituir cuidados de apoio até à resolução de todos os sinais clínicos de sangue nas fezes, depois diminuir a dose em 0.5 mg/kg. |
Contraindicações
Não usar em cães usados para reprodução, ou para cadelas grávidas ou lactantes (ver Farmacologia Clínica).
Avencimentos
PALLADIA pode causar disfunção vascular que pode levar a edema e tromboembolismo, incluindo tromboembolismo pulmonar. Descontinuar o medicamento até que os sinais clínicos e a patologia clínica tenham normalizado. Para assegurar a homeostase da vasculatura, aguarde pelo menos 3 dias após a interrupção da droga antes de realizar a cirurgia (ver Reações adversas).
Complicações gastrointestinais graves e às vezes fatais, incluindo perfuração gastrointestinal, raramente ocorreram em cães tratados com PALLADIA (ver Reações adversas). Se houver suspeita de ulceração gastrointestinal, parar a administração de drogas e tratar adequadamente.
Avisos Humanos:
NÃO DE UTILIZAÇÃO EM HUMANOS. MANTENHA ISTO E TODOS OS MEDICAMENTOS FORA DO ALCANCE DAS CRIANÇAS. As crianças não devem entrar em contato com a PALLADIA. Mantenha as crianças longe de fezes, urina ou vômito de cães tratados. Para evitar a exposição a drogas, lavar as mãos com água e sabão após a administração de PALLADIA e usar luvas de proteção para evitar contato direto com fezes, urina, vômito e comprimidos de PALLADIA quebrados ou umedecidos. Colocar todos os resíduos num saco plástico e selar antes da sua eliminação geral. Se os olhos forem acidentalmente expostos ao medicamento, enxaguar os olhos com água imediatamente. Em caso de ingestão acidental por uma pessoa, procurar imediatamente um médico, mostrar a bula ou rótulo ao médico. Desconforto gastrointestinal, como vómitos ou diarreia, pode ocorrer se este medicamento for ingerido acidentalmente.
Mulheres grávidas, mulheres que possam engravidar ou mães lactantes devem prestar especial atenção a estas precauções de manuseamento. (Ver instruções de manuseamento acima.) PALLADIA, tal como outros medicamentos da sua classe, previne a formação de novos vasos sanguíneos em tumores. De forma semelhante, a PALLADIA pode afectar a formação de vasos sanguíneos no feto em desenvolvimento e pode prejudicar um feto em gestação (causar defeitos congénitos). Para mulheres grávidas, a ingestão acidental de PALLADIA pode ter efeitos adversos na gravidez.
Precauções
Deixe de usar PALLADIA se anemia, azotemia, hipoalbuminemia e hiperfosfatemia ocorrerem simultaneamente. Retomar o tratamento com uma redução de dose de 0,5 mg/kg após 1 a 2 semanas quando os valores tiverem melhorado e a albumina for >2,5 g/dL. Interrupções temporárias do tratamento podem ser necessárias se alguma delas ocorrer isoladamente: hematócrito <26%, creatinina ≥2.0 mg/dL ou albumina <1.5 g/dL. Em seguida, retomar o tratamento com uma redução de dose de 0,5 mg/kg uma vez que o hematócrito é >30%, a creatinina é <2,0 mg/dL, e a albumina é >2,5 g/dL.
Temporariamente descontinuar o uso de PALLADIA se a contagem de neutrófilos for ≤1000/µL. Retomar o tratamento após 1 a 2 semanas com uma redução de dose de 0,5 mg/kg, quando a contagem de neutrófilos tiver voltado a >1000/µL. Outras reduções de dose podem ser necessárias se a neutropenia grave voltar a ocorrer.
A presença de tumor sistêmico em mastócitos antes do tratamento pode predispor um cão a uma degranulação clinicamente significativa dos mastócitos com possíveis reações adversas sistêmicas graves quando tratado com PALLADIA. Tentativas devem ser feitas para descartar mastocitose sistêmica antes do início do tratamento com PALLADIA.
PALLADIA tem sido associada com diarréia grave ou sangramento gastrointestinal que requer tratamento imediato. Interrupções de dose e reduções de dose podem ser necessárias, dependendo da gravidade dos sinais clínicos. (Ver Tabela 2 em Dosagem e Administração.)
Utilizar anti-inflamatórios não esteróides com cautela em conjunto com PALLADIA devido a um risco aumentado de ulceração ou perfuração gastrointestinal.
PALLADIA é metabolizado no fígado. A co-administração de PALLADIA com inibidores fortes da família CYP3A4 pode aumentar as concentrações de PALLADIA. O efeito de medicamentos concomitantes que podem inibir o metabolismo da PALLADIA ainda não foi avaliado. A compatibilidade de medicamentos deve ser monitorada em pacientes que requerem medicamentos concomitantes.
O uso seguro da PALLADIA não foi avaliado em cães com menos de 24 meses de idade ou com peso inferior a 5 kg.
Reações adversas
Um estudo de campo clínico norte-americano composto de uma fase mascarada de 6 semanas, seguida de uma fase aberta, avaliou a segurança e eficácia do PALLADIA em 151 cães de propriedade de clientes que apresentavam tumores de mastócitos cutâneos de grau Patnaik II ou III, recorrentes, com ou sem envolvimento de linfonodos regionais. As reações adversas mais comuns relatadas durante a fase mascarada estão resumidas na Tabela 3; as relatadas durante todo o estudo (fase mascarada combinada com a fase aberta) estão resumidas na Tabela 4.
Tabela 3. Resumo das reações adversas mais comuns durante a fase mascarada
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Adverse Reação |
Any Gradeb |
Grade 3 ou 4b |
Any Gradeb |
Grade 3 ou 4b |
|
Diarreia |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anorexia |
31,3% |
6.3% |
39,1% |
6,9% |
|
Lethargy |
29.7% |
3.1% |
35.6% |
4.6% |
|
Vomitar |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lameness |
9,4% |
0,0% |
17.2% |
0,0% |
|
Perda de peso |
3,1% |
0.0% |
14,9% |
1,1% |
|
Sangue nas fezes/Sangria gastrointestinal/diarreia hemorrágica |
3.1% |
0.0% |
12.6% |
2.3% |
|
Desordem músculo-esquelética |
6,3% |
0.0% |
11,5% |
1,1% |
|
Desidratação |
4.7% |
0.0% |
9.2% |
2.3% |
|
Dermatites |
9,4% |
1,6% |
9,2% |
0.0% |
|
Pruritus |
4,7% |
0,0% |
9.2% |
0,0% |
|
Tachypnea |
4.7% |
0,0% |
8,0% |
1,1% |
|
Dores localizados |
4,7% |
>
0>0,0% |
8.0% |
0,0% |
|
Nausea |
3,1% |
0.0% |
8,0% |
1,1% |
|
Dores gerais |
4.7% |
1,6% |
6,9% |
0,0% |
|
Polidipsia |
7,8% |
0.0% |
6,9% |
0,0% |
|
Pirexia |
3.1% |
0.0% |
5.7% |
2.3% |
|
Flatulência |
3,1% |
0,0% |
5.7% |
0,0% |
|
Pigmentação |
1.6% |
0.0% |
5.7% |
0.0% |
|
Anormalidade Laboratorial |
Any Gradec |
Grade 3 ou 4c |
Any Gradec |
Grade 3 ou 4c |
|
Neutropenia |
6.3% |
0.0% |
46.0% |
0,0% |
|
Thrombocytopenia |
20,3% |
0,0% |
>
24,1% |
0.0% |
|
Increased alanine aminotransferase |
21,9% |
4.7% |
24,1% |
1,1% |
|
Hypoalbuminemia |
7.8% |
0,0% |
12,6% |
0,0% |
|
Hematócrito diminuído |
7,8% |
0.0% |
5,7% |
3,4% |
|
Hiperbilirrubinemia |
1.6% |
1.6% |
5.7% |
0.0% |
|
Increased creatinine |
4,7% |
0,0% |
5.7% |
0,0% |
|
Infecção do tracto urinário |
1.6% |
0,0% |
5,7% |
0,0% |
a O tempo médio de estudo durante a fase mascarada foi de 37,0 dias para cães tratados com PALLADIA (mediana, 42.0 dias) e 27,6 dias para cães tratados com placebo (mediana, 21,0 dias); não foram feitos ajustes nas comparações estatísticas para esta disparidade.
b Investigadores atribuíram grau de severidade de 1, 2, 3 ou 4 (1 – menos severo; 4 – mais severo).
c A classificação das anormalidades laboratoriais foi baseada na diretriz Critérios de Toxicidade Comum do Instituto Nacional do Câncer adaptada para os caninos (1 – menos grave; 4 – mais grave).
Tabela 4. Resumo das reacções adversas mais comuns durante o estudo (fase mascarada combinada com a fase aberta).fase de etiqueta)a
|
PALLADIA (n = 145) a |
||
|
Reacções Adversas |
Any Gradeb |
Grade 3 ou 4b |
|
Diarreia |
58.6% |
8,3% |
|
Anorexia |
49.7% |
8,3% |
|
Vomitar |
47.6% |
9,7% |
|
Lethargy |
39,3% |
4.1% |
|
Lameness |
22,8% |
0,0% |
|
Perda de peso > |
21,4% |
2.8% |
|
Sangue nas fezes/diarreia hemorrágica |
18.6% |
2,8% |
|
Desidratação |
15,2% |
2.1% |
|
Pruritus |
12,4% |
0,0% |
|
Pigmentação > |
11.7% |
0,0% |
|
Dermatite |
11.0% |
0,0% |
| >
Dormatite muscular esquelética |
11,0% |
0,0% |
|
Dormatite geral |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0,0% |
|
Tachypnea |
8,3% |
0.0% |
|
Nausea |
7,6% |
1.4% |
|
Polidipsia |
7,6% |
0,0% |
|
Pirexia |
6.9% |
2,8% |
|
Artrites |
6,2% |
0,0% |
|
Edema localizado |
6.2% |
0,0% |
|
Infecção bacteriana da pele |
5,5% |
0,0% |
|
Conjuntivite |
5.5% |
0.0% |
|
Anormalidade Laboratorial |
Any Gradec |
Grade 3 ou 4c |
|
Neutropenia |
44.8% |
1,4% |
|
Hypoalbuminemia |
28,3% |
1.4% |
|
Trombocitopenia |
28,3% |
2.1% |
|
Aminotransferase alaninina aumentada |
27,6% |
4.1% |
|
Hematócrito diminuído |
11,0% |
2.8% |
|
Criadorinina desencarnada |
13,8% |
1,4% |
|
Hiperbilirrubinemia |
6,9% |
0.0% |
|
Infecção urinária |
>
7,6% |
0,0% |
a A duração do tratamento com PALLADIA variou de 2 a 812 dias (média, 144 dias; mediana, 68 dias). Todos os cães receberam pelo menos 1 dose de PALLADIA.
b Os investigadores atribuíram grau de severidade de 1, 2, 3 ou 4 (1 – menos grave; 4 – mais grave).
c A classificação das anormalidades laboratoriais foi baseada na diretriz Critérios de Toxicidade Comum do Instituto Nacional do Câncer (National Cancer Institute Common Toxicity Criteria) adaptada para caninos (1 – menos grave; 4 – mais grave).
Outros eventos adversos foram relatados, mas ocorreram em < 5% dos cães. Qualquer cão individualmente pode ter tido múltiplos eventos adversos.
Havia 5 mortes durante este estudo que possivelmente estavam relacionadas a drogas. Os achados patológicos geralmente revelaram evidências de disfunção vascular, incluindo tromboembolismo pulmonar (pós-operatório); insuficiência de múltiplos órgãos associada a vasculite e trombose; trombose vascular com coagulopatia intravascular disseminada (DIC) e pancreatite; e vasculite com DIC. Um cão morreu secundário à perfuração gástrica; a duração do tratamento com PALLADIA foi de 221 dias e não houve evidência de tumor em mastócitos na necropsia. Estas mortes ocorreram na presença ou ausência de doença grave; a duração do tratamento variou de 18 a 221 dias.
A relação dos seguintes óbitos com a droga é desconhecida. Um cão, tratado pela primeira vez durante 3 semanas com placebo, morreu de causa desconhecida 7 dias após o início da terapia de PALLADIA. Outro cão morreu de causa desconhecida 92 dias após o início da terapia de PALLADIA. Não foi realizada necropsia em nenhum dos cães.
Vinte e sete cães desenvolveram alguma forma de sangramento gastrointestinal com 2,8% dos cães com sangramento grave. Um cão desenvolveu ulceração gástrica que possivelmente estava relacionada a drogas. Três cães morreram de perfuração gástrica (1 cão) ou duodenal (2 cães) durante o estudo. Um cão com perfuração duodenal recebeu apenas 1 dose do medicamento em estudo e, portanto, não foi considerado relacionado a drogas.
Sete cães desenvolveram despigmentação nasal nas primeiras semanas de tratamento. Onze cães desenvolveram cor do pêlo ou mudanças na pele durante o estudo. Dois desses cães tiveram mudanças completas na cor do pêlo, de fulvo para branco e de vermelho profundo para loiro. Sete cães tiveram alopecia.
Existe um efeito relacionado a drogas no peso corporal: 20,0% dos cães tiveram >13% de perda de peso na fase mascarada mais aberta atribuível a drogas. Destes, 5 cães tiveram >25% de perda de peso.
Três cães tiveram uma actividade semelhante a convulsões enquanto estavam a tomar a droga em estudo. Não se pode determinar se estes estavam relacionados com a droga.
Dois cães desenvolveram epistaxe que não estava associada com trombocitopenia. Outro cão desenvolveu epistaxe com coagulopatia intravascular disseminada simultaneamente.
Para uma cópia da Folha de Dados de Segurança (SDS) ou para relatar eventos adversos ligue para Zoetis em 1-888-963-8471.
Informação para Proprietários de Cães:
Disponibilize sempre a Folha de Dados do Cliente com prescrição e revisão com os proprietários. Os donos devem ser aconselhados sobre possíveis reacções adversas e quando devem parar o medicamento e chamar o veterinário. Os donos devem ser aconselhados sobre as instruções de manuseio.
Farmacologia Clínica
Mecanismo de Ação: O fosfato de Toceranibe é uma pequena molécula que tem actividade antitumoral e antiangiogénica directa. Em estudos farmacológicos não clínicos, o toceranibe inibiu seletivamente a atividade da tirosina quinase de vários membros da família dos receptores de tirosina quinase dividida (RTK), alguns dos quais estão implicados no crescimento tumoral, angiogênese patológica e progressão metastática do câncer. O Toceranib inibiu a atividade do Flk-1/KDR tirosina quinase (receptor de fator de crescimento endotelial vascular, VEGFR2), receptor de fator de crescimento derivado de plaquetas (PDGFR), e receptor de fator de células-tronco (Kit), tanto em ensaios bioquímicos como celulares. O Toceranibe demonstrou exercer um efeito antiproliferativo sobre as células endoteliais in vitro. O tratamento com Toceranibe pode induzir a parada do ciclo celular e subsequente apoptose nas linhas de células tumorais expressando mutações ativadoras na cinase RTK dividida, ckit. O crescimento tumoral do mastócito canino é frequentemente impulsionado pela ativação de mutações no c-kit.1,2
Outros compostos na classe de antiangiogênese dos agentes antineoplásicos são conhecidos por aumentarem a embrioletaridade e as anormalidades fetais. Como a angiogênese é um componente crítico do desenvolvimento embrionário e fetal, a inibição da angiogênese após a administração de PALLADIA deve resultar em efeitos adversos sobre a gravidez na cadela.
Farmacocinética
Segundo a administração intravenosa, a farmacocinética do toceranibe é caracterizada por um volume muito grande de distribuição (>20 L/kg, indicando divisão em tecidos), uma semi-vida de eliminação terminal de cerca de 16 hrs, e uma folga de >1 L/hr/kg. Com um regime de 3,25 mg de equivalente de base livre (fbe)/kg de toceranibe administrado por via oral a cada dois dias durante 2 semanas (7 doses), os parâmetros farmacocinéticos do toceranibe no plasma em cães Beagle saudáveis (entre 7,2 – 12,5 kg) são mostrados na tabela abaixo.
Tabela 5: Parâmetros farmacocinéticos
|
Parâmetros farmacocinéticos (Média + 1SD) |
Total (n=11;6M, 5F) |
Total (n=10; 5M, 5F) |
|
Eliminar meia-vida, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Tempo à concentração plasmática máxima, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Concentração máxima de plasma, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Área sob a curva de tempo de concentração plasmática, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Valor da dose normalizada (ajustado a 3.25 mg/kg de dose)
b Cmin é a concentração a 48 h pós-dose, que corresponde ao intervalo de dose.
Bioavailability of toceranib é 77%. PALLADIA é altamente ligado a proteínas entre 91% e 93%.
De notar que apesar da homogeneidade dos sujeitos incluídos neste estudo, grande variabilidade entre sujeitos foi observada. Independentemente da via de administração, a farmacocinética linear foi observada em doses de até 5 mg/kg duas vezes ao dia. Usando um sistema de teste in vitro de hepatócitos e microssomas hepáticos, o isômero Z foi metabolizado para o derivado N-óxido de toceranibe em cães, humanos, gatos e ratos. Embora uma pequena diferença de gênero tenha sido observada no estudo in vitro (81% de conversão em cães machos, 56% de conversão em cães fêmeas), nenhuma diferença na farmacocinética do toceranibe foi observada in vivo. Os efeitos do comprometimento renal, comprometimento hepático ou da raça na farmacocinética do toceranibe não foram investigados.
Eficácia
A eficácia e segurança dos comprimidos orais PALLADIA para o tratamento de tumores em mastócitos foi avaliada em um estudo de campo clínico randomizado, controlado por placebo, com dupla marcação e multicêntrico. O objetivo deste estudo foi avaliar a eficácia e segurança da PALLADIA no tratamento de tumores de mastócitos em cães que tiveram doença mensurável recorrente após a cirurgia e avaliar a resposta objetiva (resposta completa ou parcial). O tratamento com PALLADIA foi comparado ao tratamento com placebo usando taxas de resposta ao final da fase mascarada de 6 semanas. As taxas de resposta foram determinadas usando a Diretriz de Avaliação de Resposta em Tumores Sólidos3 do National Cancer Institute, que foi modificada especificamente para a avaliação de tumores de mastócitos caninos.
Cento e cinquenta e três cães foram designados aleatoriamente para o tratamento com 3,25 mg/kg de PALLADIA (n = 88) ou placebo (n = 65) oralmente, a cada dois dias durante 6 semanas, ou até a progressão da doença ou retirada do estudo por outra causa. O tratamento foi desmascarado no momento da progressão da doença: os cães que receberam placebo foram então oferecidos em cruz a PALLADIA de marca aberta; os cães que receberam PALLADIA foram descontinuados do estudo. Os cães eram obrigados a ter Patnaik grau II ou III, tumores recorrentes de mastócitos cutâneos com ou sem envolvimento dos linfonodos regionais. Pelo menos 1 tumor tinha que ter pelo menos 20 mm de diâmetro. Os cães tinham um limite de 1 protocolo de radiação completo e um limite de 1 regime prévio de quimioterapia sistêmica. Cães com evidência de tumor sistêmico em mastócitos foram excluídos. O tratamento com corticosteróides sistêmicos durante o estudo ou nos 14 dias anteriores ao início do estudo não foi permitido. Se necessário para o tratamento de reações adversas, foram prescritas interrupções de dose (cessação da PALLADIA por até 2 semanas) e/ou a dosagem foi reduzida para tão pouco quanto 2,2 mg/kg.
A análise de eficácia mostrou uma vantagem estatisticamente significativa para a PALLADIA sobre o placebo no desfecho primário de eficácia da resposta objetiva ao final da fase mascarada de seis semanas. A resposta objetiva é resposta completa + resposta parcial. A resposta parcial é ≥. A redução de 30% na soma do diâmetro mais longo das lesões alvo, tomando como referência a soma basal, a não progressão das lesões não alvo e o aparecimento de novas lesões.
Tumor de mastócito – Eficácia primária Resultados do ponto final
|
Parâmetro de eficácia |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-valor |
|
Taxa de resposta objetiva * |
7.9% |
37.2% |
< 0.001 |
** A diferença na taxa de resposta objetiva entre os grupos não foi significativamente associada com a carga tumoral (presença vs. ausência de envolvimento do linfonodo regional) ou grau tumoral (P > 0,05).
Durante o estudo, PALLADIA foi administrada concomitantemente com outros medicamentos, tais como antimicrobianos, bloqueadores dos receptores H-2, anti-histamínicos, antieméticos, anti-inflamatórios não-esteróides, anti-inflamatórios de ação local, modificadores de motilidade gastrointestinal opiácea, opióides, vacinas, anti-helmínticos, antiparasíticos e preparações de corticosteróides tópicos/oftálmicos/óticos. Apenas durante a fase de marca aberta, 5 cães receberam um breve curso de corticosteróides de ação curta.
SegurançaAnimal:
No estudo de segurança animal alvo apresentado abaixo, foi demonstrado que o PALLADIA tem uma margem de segurança estreita; cães sendo tratados com PALLADIA devem ser monitorados para reações adversas que podem indicar que um ajuste de dose é necessário. Dois cães do grupo 6 mg/kg foram eutanizados para toxicidade clínica nos dias 23 e 27 do estudo, respectivamente.
Toceranibe foi administrado oralmente a 20 cães Beagle adultos machos e 20 cães adultos fêmeas (aproximadamente 2 anos de idade) na dose de 0 mg/kg (placebo, 12 cães), 2 mg/kg (0,5X, 8 cães), 4 mg/kg (1X, 12 cães), ou 6 mg/kg (1,5X, 8 cães) uma vez a cada dois dias por 13 semanas consecutivas sem interrupção da dose. O Toceranibe causou perda de peso, diminuição no consumo de ração, pâncreas, gonadal, adrenal, muscular e alterações hematopoiéticas.
O consumo de ração foi diminuído no grupo de 6 mg/kg em comparação ao placebo, com a maior diferença de médias ocorrendo no 35º dia. A diminuição do peso corporal no grupo 4 mg/kg foi observada no dia 31 e no grupo 6 mg/kg no dia 15, em comparação com o placebo, e continuou através do estudo. A manqueira relacionada à dose, observada quase exclusivamente nos membros posteriores, e a dor nos membros foi maior em todos os grupos de tratamento em relação ao placebo, com o grupo de 6 mg/kg demonstrando a maior incidência. Rigidez e fraqueza foram observadas quase que exclusivamente no grupo de 6 mg/kg. A vermelhidão da mucosa oral foi observada em todos os grupos de tratamento. Um cão no grupo 4 mg/kg tinha ulcerações orais e um cão no grupo 6 mg/kg tinha ulcerações cutâneas, ambos com infecções bacterianas presentes. Diarréia ou fezes moles foram observadas em todos os quatro grupos.
Análises hematológicas mostraram diminuições no hematócrito, hemoglobina e contagem de eritrócitos e uma diminuição na contagem de reticulócitos nos grupos de 4 e 6 mg/kg que tendiam a se recuperar o suficiente para limitar mais diminuições na contagem de eritrócitos. A contagem de leucócitos foi significativamente menor em todos os grupos tratados em comparação com placebo, principalmente devido a uma diminuição de neutrófilos. Os linfócitos diminuíram em menor grau, especialmente com a dose baixa. Eosinófilos e basófilos apresentaram diminuições marcadas e persistentes. Os monócitos não foram afetados.
Contagem de plaquetas aumentou ligeiramente nos grupos de 4 e 6 mg/kg. Aumentos foram observados no fibrinogênio nos grupos 4 e 6 mg/kg.
Aumento foi observado em aspartato aminotransferase, creatina quinase e concentrações séricas de fósforo nos grupos 4 e 6 mg/kg. Aumentos na fosfatase alcalina foram observados no grupo de 6 mg/kg. Um aumento na amilase foi observado em um cão em cada um dos grupos de tratamento. Um aumento no soro de potássio foi observado em um cão no grupo de 6 mg/kg. Aumentos na desidrogenase láctica e globulinas foram observados no grupo 6 mg/kg.
Mudanças microscópicas relacionadas ao tratamento incluíram leve a acentuada redução na celularidade da medula óssea esternal e femoral. Houve uma hematopoiese extramedular leve correspondente, principalmente eritropoiese, no baço. No pâncreas, ocorreu desgranulação acinar leve a moderada, caracterizada por perda difusa de grânulos de zymogen. Nas glândulas supra-renais, ocorreu congestão cortical/hemorragia mínima em todas as doses, com sugestiva relação dose-relação. A vacuolação da cortical adrenal foi observada com baixa freqüência em todos os grupos. Alterações relacionadas à dose foram observadas nos órgãos reprodutivos de ambos os sexos. Os homens apresentaram depleção das células germinativas relacionadas à dose, vacuolação tubular e redução do número de espermatozóides maduros. Nas fêmeas, os ovários mostraram uma incidência reduzida de corpos lúteos maduros/regressores e um aumento da incidência de pequenos folículos.
Dois cães (um macho, uma fêmea) no grupo de 6 mg/kg foram eutanizados para toxicidade clínica relacionada ao tratamento nos dias 23 e 27 do estudo, respectivamente. O início da síndrome terminal foi visto como uma redução acentuada na ingestão de ração e melena. Nos 9 dias seguintes, a diminuição da ingestão de ração progrediu para anorexia quase completa e apareceu hematochezia. Perda de peso, letargia, coxeio e fraqueza foram observados. Os seguintes resultados de patologia clínica são consistentes com as mudanças observadas nos outros cães do grupo de 6 mg/kg, assim como as mudanças devidas às condições debilitadas dos cães imediatamente antes da eutanásia. Ambos os cães tiveram aumentos no total de proteínas, globulinas, fósforo, colesterol, triglicérides e fibrinogênio. Um cão tinha pancitopenia, diminuição do hematócrito, hemoglobina, reticulócitos, albumina, e PT e aumento das bandas. A hematúria também estava presente. O outro cão também tinha linfócitos, eosinófilos, cloreto e sódio diminuídos e aumento de hemácias, hematócrito, hemoglobina, plaquetas, ALP, amilase, creatinina, BUN, magnésio, potássio e bilirrubina total. O perfil de coagulação mostrou uma diminuição do TP e um aumento do TPT em ambos os cães. Estes cães mostraram depleção linfóide nos linfonodos, timo e tecidos linfáticos associados ao intestino e lesões gastrointestinais leves a marcadas, além dos achados microscópicos descritos em animais sobreviventes até o final do estudo. Estes dois cães também tiveram lesões no trato gastrointestinal, rins, pâncreas, hipófise e glândulas supra-renais.
Condições de estocagem: Armazenar a temperatura ambiente controlada de 20° a 25° C (68° a 77° F).
Como Fornecido
PALLADIA comprimidos contêm 10 mg, 15 mg, ou 50 mg de toceranibe como fosfato de toceranibe por comprimido. Os comprimidos são embalados em 30 frascos de contagem.
1 London CA, Hannah AL, Zadovoskaya R, et al. Estudo de Dosagem Fase I do SU11654, um Pequeno Inibidor de Tirosina Kinase Receptor de Moléculas, em Cães com Malignidades Espontâneas. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured by: Pfizer Inc, Ascoli, Itália
Distribuído por: Pfizer Inc, Ascoli, Itália
Distribuído por: Zoetis Inc., Kalamazoo, MI 49007
Revisado: Agosto 2015