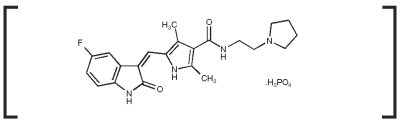
パラディアの効能・効果
パラディア錠は、犬の局所リンパ節転移を伴うまたは伴わないPatanaikグレードIIまたはIII、再発、皮膚肥満細胞腫の治療に適応されています
用法用量
処方に必ずクライアント情報シートを添付してください。 初回投与量は3.25mg/kg(1.48mg/lb)体重で、隔日に経口投与する(表1参照)。 必要に応じて、0.5mg/kgの減量(最低用量2.2mg/kg(1.0mg/lb)隔日)および投与中断(最大2週間までパラディアを中止)を行い、副作用に対処します(表2および警告と注意参照)。 最初の6週間は毎週、その後は6週間ごとに、獣医師の評価に基づいて投与量を調節してください。 パラディアは食事とともに、あるいは食事なしで投与することができます。 錠剤を分割しないでください。 3.25mg/kg投与量表
|
犬の体重 |
錠剤数 |
|||||||
|
重量<6019> キログラム |
用量 |
10 mg |
15 mg |
50 mg |
||||
| 11.0 – 11.8 |
5.0 – 5.3 |
15mg |
||||||
|
11.9 – 15.2 |
5.4 – 6.9 |
20mg |
||||||
|
15.0 |
15.3 – 18.5 |
7.0 – 8.4 |
25mg |
|||||
|
18.5mg |
16.0mg | 18.0kg6 – 22.0 |
8.5 – 10.0 |
30mg |
||||
|
22.1 – 25.4 |
10.1 – 11.5 |
35mg |
||||||
|
25.5 – 28.7 |
11.6 – 13.0 |
40mg |
||||||
|
28.8 – 32.2 |
13.1 – 14.6 |
45 mg |
||||||
|
32.3 – 35.5 |
14.7 – 16.1 |
50mg |
||||||
|
35.6 – 38.8 |
16.2 – 17.6 |
55 mg |
||||||
|
38.9 – 42.3 |
17.7 – 19.2 |
|||||||
|
42.4 – 45.0.6 |
19.3 – 20.7 |
65 mg |
||||||
|
45.7 – 50.0.7 |
20.8 – 23.0 |
|||||||
|
50.8 – 59.3 |
23.8 – 59.0 |
80 mg |
||||||
|
59.4 – 65.9 |
27.0 – 29.9 |
95 mg |
||||||
|
66.0 – 71.2 |
30.0 – 32.0 |
100 mg |
||||||
|
71.3 – 76.3 |
32.4 – 34.0.6 |
110 mg |
||||||
|
76.4 – 79.6 |
115 mg |
|||||||
|
79.7 – 84.7 |
36.2 – 38.2。4 |
120 mg |
||||||
|
84.8 – 94.0.8 |
38.5 – 43.0 |
130 mg |
||||||
|
94.9 – 105.0 |
43.1 – 47.6 |
150mg |
||||||
|
105.0 |
||||||||
| 150.01 – 110.0 |
47.7 – 49.9 |
160 mg |
||||||
|
110.1 – 113.5 |
50.0 – 51.5 |
165mg |
||||||
|
113.6 – 118.6 |
51.6 – 53.8 |
170mg |
||||||
|
118.0 |
118.07 – 128.8 |
53.9 – 58.4 |
180 mg |
|||||
|
128.0 |
180 mg |
128.9 – 138.9 |
58.5 – 63.0 |
200 mg |
||||
|
139.9 |
||||||||
| 139.0 – 144.0 |
63.1 – 65.3 |
210mg |
||||||
|
144.0 |
144.1 – 157.6 |
65.4 – 71.5 |
215mg |
|||||
|
157.5> |
155.7 – 173.1 |
71.6 – 78.5 |
250mg |
|||||
|
173.0 |
。2 – 177.9 |
78.6 – 80.7 |
260 mg |
|||||
|
178.5 |
||||||||
| 178.0 – 191.6 |
80.8 – 86.9 |
265mg |
||||||
|
191.7 – 220.5 |
87.0 – 100.0 |
300 mg |
||||||
表2.1、表2: 観察された毒性に基づく用量変更
|
毒性 |
用量調整 |
|
|
Neutropenia |
||
|
>1000/µL |
投与量を維持 |
|
|
≦1000/µL または好中球減少熱または感染 |
<303>1000/µLおよび臨床症状が正常になるまで投与を中止してください。 その後、0.5%ずつ減量する。5mg/kg |
|
|
腎毒性(クレアチニン) |
||
|
<2.5mg/kg |
用量維持 |
|
|
≧2.0mg/dL |
まで薬剤停止<2.0mg/L |
2.0 mg/dL |
2.0mg/dLから0.5mg/kg減量 |
|
アルブミン |
||
|
<1.5 g/dL |
>2.2まで中止する <。5 g/dL まで中止し、その後 0.5 mg/kg 減量 |
|
|
Hematocrit |
||
|
<26% |
303% まで中止、その後 0.5 mg/kg 減量。5 mg/kg |
|
|
下痢 |
||
|
用量レベルを維持する、そして 支持療法を行う |
||
|
≧4水様便/日又は≧2日 |
形成便が出るまで投与を中止し、支持療法を行う |
|
|
GI出血 |
||
|
2日間鮮血便又は黒いタール便、あるいは鮮血便又は血栓がある場合>。 |
便潜血のすべての臨床症状が消失するまで、薬剤を中止し、支持療法を実施し、その後、投与量を0.5%減少させる。5mg/kg。 |
|
禁忌
繁殖に用いる犬、妊娠または授乳中の雌犬に使用しない(「臨床薬理学」を参照)
警告
パラディアは血管機能障害により浮腫および肺血栓塞栓症などの血栓塞栓症に至るおそれがあります。 臨床症状及び臨床病態が正常化するまで服用を中止すること。 血管の恒常性を確保するため、投薬を中止してから少なくとも3日間待ってから手術を行ってください(「有害反応」の項参照)。
パラディアで治療した犬では、消化管穿孔を含む重篤で時に致命的な消化器系の合併症がまれに発生しています(「有害反応」の項参照)。
ヒトに対する警告:
ヒトには使用しないこと。 この薬とすべての薬は子供の手の届かないところに保管してください。 子供はPALLADIAに接触してはいけません。 治療した犬の糞便、尿、嘔吐物に子供を近づけないようにしてください。 薬物への曝露を避けるため、パラディアを投与した後は石鹸と水で手を洗い、保護手袋を着用し、糞、尿、嘔吐物、壊れたり湿ったパラディア錠剤に直接触れないようにしてください。 すべての廃棄物をビニール袋に入れ、密閉してから一般廃棄してください。 誤って本剤が目に入った場合は、直ちに水で目を洗い流してください。 万一、人が誤飲した場合は、直ちに医師の診断を受け、添付文書またはラベルを医師に提示してください。 6019><2990>妊娠中の方、妊娠の可能性のある方、授乳中の方は特に注意してください。 (パラディアは、他の同効薬と同様に、腫瘍の新生血管の形成を阻害します。 同様に、パラディアは発育中の胎児の血管形成に影響を与え、胎児に害を及ぼす可能性があります(先天性異常の原因)。
使用上の注意
貧血、高窒素血症、低アルブミン血症、高リン酸血症が同時に発現した場合は、パラディアの使用を一時中止してください。 1~2週間後に数値が改善し、アルブミンが>2.5g/dLになった時点で0.5mg/kgに減量して投与を再開してください。 ヘマトクリット<6990>26%、クレアチニン≧2.0mg/dL、アルブミン<6990>1.5g/dLのいずれかが単独で発生した場合は、一時的な治療中断が必要な場合がある。 その後、ヘマトクリット<303>30%、クレアチニン<6990>2.0mg/dL、アルブミン<303>2.5g/dLになったら0.5mg/kgの減量で治療を再開する。
好中球数が1000/μL以下ならパラディアを一時的に中止してください。 1~2週間後、好中球数が>1000/µLに戻った時点で、0.5mg/kgに減量して投与を再開してください。
治療前に全身性の肥満細胞腫が存在する場合、パラディアで治療すると、重篤な全身性副作用を伴う臨床的に重大な肥満細胞の脱顆粒を起こしやすくなる可能性があります。 パラディアの治療開始前に、全身性肥満細胞腫の除外を試みる必要があります。
パラディアは、迅速な治療を必要とする重度の下痢または消化管出血と関連することがあります。 臨床症状の重症度に応じて、投与量の中断や減量が必要な場合があります。 (
非ステロイド性抗炎症剤は、消化管潰瘍または穿孔のリスクが高いため、パラディアと併用する場合は注意してください。 CYP3A4ファミリーの強力な阻害剤とパラディアを併用すると、パラディアの濃度が上昇する可能性があります。 パラディアの代謝を阻害する可能性のある併用薬の影響については、評価されていません。 6019>
生後24カ月未満または体重5kg未満の犬におけるパラディアの安全な使用は評価されていません。
副作用
6週間のマスク期間と非盲検期間からなる米国の臨床フィールド試験では、PatnaikグレードIIまたはIIIの再発性皮膚肥満細胞腫を有し、局所リンパ節転移の有無を問わず、151頭の顧客所有犬においてPALLADIAの安全性および有効性が評価されました。 また、本試験全体(マスク期間と非盲検期間の合計)で報告された有害事象を表4にまとめました。 マスク期間中の主な副作用のまとめ
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||||
|
Adverse Reaction |
Any Gradeb |
Grade 3 or 4b |
Any Gradeb |
Grade 3 or 4b |
||
|
下痢 |
26.0 Diaferry (Diarrhea) 26.06% |
3.1% |
46.0% |
6.9% |
||
|
Anorexia |
31.3% |
6.0% |
6.3% |
39.1% |
||
|
嗜眠 |
29.9% |
3.9% |
6.9% 3.1% |
3.1% |
35.6% |
4.6% |
|
嘔吐 |
32.8% |
32.2% |
||||
|
Lameness |
9.4% |
17.9% 3.0% |
3.7% |
0.0% |
||
|
体重減少 |
3.1% |
0.0% |
14.9% |
1.1% |
||
|
血便・下血・出血性下痢 |
3.1% |
0.0% |
12.6% |
2.3% |
||
|
筋骨格障害 |
6.3% |
0.0% |
11.5% |
1.1% |
||
|
脱水 |
0% |
0.0% |
9.2% |
2.3% |
||
|
皮膚炎 |
9.4% |
9.2% |
1.2% |
|||
|
そう痒症 |
4.7% |
9.0% |
0.0% |
|||
|
頻呼吸 |
4.0% |
0.0% |
8.0% |
|||
|
局所疼痛 |
8.1% |
8.0%8.1% |
8.1% |
0.0% |
||
|
吐き気 |
3.1% |
0.0% |
8.0% |
1.1% |
||
|
全身疼痛 |
4.7% |
1.6% |
||||
|
Polydipsia |
7.8% |
0.0% |
6.9% |
|||
|
Pyrexia |
3.1% |
0.0% |
5.7% |
2.3% |
||
|
フラットネス |
3.1% |
5.1% |
3.1% |
0.0% |
||
|
色素沈着症 |
1.6% |
0.0% |
5.7% |
0.0% |
||
|
Laboratory Abnormality |
Any Gradec |
Any Gradec |
||||
|
Neutropenia |
6.3% |
0.0% |
46.0% |
0.0% |
||
|
血小板減少症 |
20.3% |
0.0% |
||||
|
アラニンアミノトランスフェラーゼ増加 |
21.9% |
4.0% 4.0% |
4.7% |
24.1% |
||
|
高アルブミン血症 |
7.8% |
0.0% |
||||
|
ヘマトクリットの低下 |
0.0% 0.8% 。0% |
5.7% |
3.4% |
|||
|
高ビリルビン血症 |
1.6% |
1.6% |
5.7% |
0.0% |
||
|
クレアチニン増加 |
4.7% |
5.1% 5.7% |
0.0% |
|||
|
尿路感染症 |
1.6% |
0.0% |
0.0% |
|||
a 仮病期の平均試験期間はPALLADIA投与犬では37.0日(中間値、42.6019>
b 重症度グレードは1、2、3、4(1:最も重度、4:最も重度)で評価されました。
c 臨床検査値異常のグレードは、米国国立がん研究所のCommon Toxicity Criteriaガイドラインを犬用にアレンジしたものに基づいています(1 – 最も重篤;4 – 最も重篤)。 試験期間中の最も一般的な副作用のまとめ(マスキング段階と一般公開段階の組み合わせラベルフェーズ)a
|
PALLADIA (n = 145) a |
|||||
|
有害反応 |
Any Gradeb |
||||
|
Diarrhea |
58.6% |
8.3% |
|||
|
Anorexia |
49.7% |
8.3% |
|||
|
嘔吐 |
47.6% |
9.7% |
|||
|
Lethargy |
39.3% |
6.7% |
|||
|
無気力 |
|||||
|
緘黙 |
22.8% |
0.0% |
|||
|
Weight loss |
21.4% |
2.0% Lamness |
2.7% | 2.0% | |
|
血便・GI出血・出血性下痢 |
18.6% |
2.8% |
|||
|
脱水 |
15.2% |
2.1% |
|||
|
そう痒症 |
12.4% |
0.0% |
|||
|
着色症 |
11.0%.7% |
0.0% |
|||
|
皮膚炎 |
11.0% |
0.0% |
|||
|
筋骨格障害 |
11.0% |
||||
|
一般疼痛 |
8.0% |
||||
|
1.3% |
0.0% |
||||
|
外耳炎 |
8.3% |
0.0% |
|||
|
頻呼吸 |
0.0% |
||||
|
0.0% |
|||||
|
Nausea |
7.6% |
1.4% |
|||
|
Polydipsia |
7.6% |
||||
|
6.0% |
Polydipsia |
2.8% |
|||
|
関節炎 |
6.2% |
0.0% |
6.0% | ||
| Laboric6.0% |
6.0% |
||||
|
Laboric6.0% |
|||||
|
関節炎 |
0.0% |
||||
|
細菌性皮膚炎 |
5.5% |
||||
|
5.5%.5% |
0.0% |
||||
|
検査異常 |
Grade 3又は4c |
||||
|
神経弛緩 |
44.0% 0.0% |
1.4% |
|||
|
高アルブミン血症 |
28.3% |
1.0% |
|||
|
低アルブミン血症 |
|||||
|
血小板減少症 |
28.3% |
2.0% 3.1% |
|||
|
アラニンアミノトランスフェラーゼ増加 |
27.6% |
4.0% 4.1% |
|||
|
ヘマトクリット減少 |
11.0% |
2.0%減。8% |
|||
|
クレアチニン増加 |
13.8% |
1.4% |
|||
|
高ビリルビン血症 |
6.9% |
0.9% 0.0% |
|||
|
尿路感染症 |
7.6% |
0.0% |
|||
a PALLADIA投与期間は2~812日間(平均144日間、中央値68日間)でありました。
b 重度グレードは1、2、3、4(1:最も軽度、4:最も高度)としました。
c 実験値異常のグレードは、米国国立がん研究所のCommon Toxicity Criteriaガイドラインを犬用にアレンジしたもの(1:最も軽度、4:最も高度)<その他の有害事象は報告されていますが、犬の5%に発現しています。
本試験では、薬剤に関連していると思われる死亡例が5例ありました。 病理所見では、肺血栓塞栓症(術後)、血管炎および血栓症を伴う多臓器不全、播種性血管内凝固症候群(DIC)および膵炎を伴う血管血栓症、およびDICを伴う血管炎を含む血管機能不全の証拠が一般的に明らかにされました。 パラディアの投与期間は221日であり、剖検では肥満細胞腫の所見は認められませんでした。 これらの死亡は肉眼的疾患の有無にかかわらず発生し、治療期間は18~221日であった。
以下の死亡例の薬剤との関連は不明である。 プラセボで3週間治療した犬1頭は、パラディア治療開始7日後に原因不明で死亡した。 もう1頭はPALLADIA投与開始92日後に原因不明で死亡した。 2990】27頭の犬に何らかの消化管出血が認められ、そのうち2.8%は重篤な出血であった。 1頭は薬物関連と思われる胃潰瘍を発症した。 試験期間中に胃穿孔(1頭),十二指腸穿孔(2頭)で死亡した犬は3頭であった。
投与開始後数週間以内に7頭に鼻の色素脱失が認められた。 11頭の犬が試験中に毛色または皮膚の変化を起こした。 このうち2頭は子鹿から白に、深紅から金髪に毛色が完全に変化しました。
体重に対する薬物関連作用:20.0%の犬は、薬物に起因する>13%の体重減少をマスク+オープンラベルの段階で経験した。 このうち、5頭で303%未満の体重減少がみられた。
試験薬投与中に3頭で発作様の活動がみられた。
血小板減少症とは関係なく鼻出血を起こした犬が2頭いた。
安全性データシート(SDS)のコピーまたは有害事象の報告については、Zoetis(1-888-963-8471)にお電話ください。
犬の飼い主様への情報:
常に処方箋とともに顧客情報シートを渡し、飼い主様と一緒に確認してください。 飼い主は、起こりうる副作用と、いつ薬を中止して獣医師に連絡すればよいかを説明する必要があります。
臨床薬理
作用機序。 Toceranib phosphateは、直接的な抗腫瘍活性と血管新生活性の両方を有する低分子化合物です。 非臨床薬理試験において、トセラニブは、腫瘍の成長、病的な血管新生、がんの転移性進行に関与するいくつかの分割キナーゼ受容体チロシンキナーゼ(RTK)ファミリーのメンバーのチロシンキナーゼ活性を選択的に阻害することが示された。 トセラニブは、生化学的および細胞アッセイにおいて、Flk-1/KDRチロシンキナーゼ(血管内皮増殖因子受容体、VEGFR2)、血小板由来増殖因子受容体(PDGFR)、幹細胞因子受容体(Kit)の活性を阻害することが確認された。 トセラニブは、in vitroで内皮細胞に対して抗増殖作用を示すことが示されている。 トセラニブ投与は、スプリットキナーゼRTKであるckitの活性化変異を発現する腫瘍細胞株において、細胞周期停止とそれに続くアポトーシスを誘導することができる。 犬の肥満細胞腫瘍の成長は、しばしばc-kitの活性化変異によって引き起こされます1,2
抗悪性腫瘍剤の血管新生クラスの他の化合物は、胚死亡率および胎児異常の増加をもたらすことが知られています。 血管新生は胚および胎児の発達に重要な要素であるため、PALLADIAの投与後に血管新生を阻害すると、雌犬の妊娠に悪影響を及ぼすと予想されます。
薬物動態
静脈内投与後のトセラニブの薬物動態は、非常に大きな分布容積(>20 L/kg、組織への分配を示す)、約16時間の終末排出半減期、>1 L/時/kgのクリアランスにより特徴づけられる。 トセラニブとして3.25mg(fbe)/kgを隔日に経口投与し、2週間(7回)投与したときの健康なビーグル犬(7.2~12.5kg)におけるトセラニブの血漿中薬物動態パラメータは下表のとおりであった。
表5: 薬物動態パラメータ
|
薬物動態パラメータ(平均+1SD) |
合計(n=11;6M、5F) |
Total (n=10; 5M, 5F) |
|
消失半減期 t1/2 (h) |
16.0時間。4 ± 3.6 |
17.2 ± 3.9 |
|
最大血漿濃度までの時間、Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
最大血漿中濃度Cmax(ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin(ng/mL)α、β |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Area under the plasma concentration time-curve, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
a dose-normalized value (adjusted to 3.).25mg/kg投与)
b Cminは投与間隔に相当する投与後48時間の濃度
toceranibの経口バイオアベイラビリティは77%であった。 パラディアは91%から93%と高タンパク質結合です。
この試験に含まれる被験者の均質性にもかかわらず、大きな被験者間変動が観察されたことに注意する必要があります。 投与経路に関係なく、1日2回、5 mg/kgまでの用量で線形な薬物動態が観察されています。 In vitroの肝細胞および肝ミクロソーム試験系を用いて、イヌ、ヒト、ネコおよびラットにおいて、Z異性体はトセラニブのN-オキシド誘導体に代謝されることが確認されました。 in vitro試験においてわずかな性差が認められましたが(雄犬81%、雌犬56%)、in vivoでのトセラニブの薬物動態に差は認められませんでした。 腎障害、肝障害、品種がトセラニブの薬物動態に及ぼす影響は検討されていません。
効果
肥満細胞腫に対するPALLADIA経口錠の有効性と安全性は、無作為プラセボ対照、ダブルマスク、多施設臨床フィールド試験で評価されました。 本試験は、手術後に測定可能な病変を再発した犬の肥満細胞腫に対するPALLADIAの有効性と安全性、および客観的奏効(完全奏効または部分奏効)を評価することを目的としています。 PALLADIA投与は、6週間のマスク期間終了時の奏効率でプラセボ投与と比較されました。
115頭の犬を無作為に割り付け、PALLADIA 3.25 mg/kg(n=88)またはプラセボ(n=65)を隔日に6週間、あるいは病勢進行または他の原因による試験からの離脱まで経口投与した後、PALLADIAを投与しました。 プラセボを投与された犬には、パラディアのオープンラベルへのクロスオーバーが提案され、パラディアを投与された犬は試験から除外されました。 犬は、Patnaik grade IIまたはIIIの再発性皮膚肥満細胞腫を有し、局所リンパ節転移を有するか否かを条件としました。 少なくとも1つの腫瘍の直径が20mm以上であることが必要でした。 放射線治療は1回まで、全身化学療法は1回までとした。 全身性肥満細胞腫の証拠がある犬は除外された。 試験中または試験開始前14日以内の全身性コルチコステロイドによる治療は許可されなかった。
有効性解析では、主要評価項目である6週間のマスク期間終了時の客観的奏効において、PALLADIAがプラセボに対して統計的に有意に優れていることが示されました。 客観的奏効とは、完全奏効+部分奏効のことです。 部分奏効とは、ベースラインを基準として、標的病変の最長径の合計が30%以上減少し、非標的病変が進行せず、新たな病変の出現がないことを指します。
肥満細胞腫-主要評価項目結果
|
効果パラメーター |
Placebo(n=63) |
PALLADIA(n=86) |
P-(P)の項参照。値 |
|
目的別奏効率 * |
7.9% |
37.2% |
< 0.001 |
* 群間の客観的奏効率の差は、腫瘍負担(局所リンパ節転移の有無)または腫瘍グレードとは有意に関連していなかった(P > 0.05).
試験中、PALLADIAは、抗菌薬、H-2受容体遮断薬、抗ヒスタミン薬、制吐薬、非ステロイド性抗炎症薬、局所作用性抗潰瘍薬、アヘン消化管運動調節薬、オピオイド、ワクチン、駆虫薬、抗寄生虫薬および局所/眼/口腔用コルチコステロイド製剤等の他の薬剤とともに併用して投与されました。 動物用医薬品安全性試験:
以下に示す動物用医薬品安全性試験において、PALLADIAは安全性の幅が狭いことが実証されました。PALLADIAで治療中の犬は、用量調節が必要であることを示す副作用を監視する必要があります。 6019】<2990>ビーグル成犬雄20頭、雌20頭(約2歳)に0 mg/kg(プラセボ、12頭)、2 mg/kg(0.5倍、8頭)、4 mg/kg(1倍、12頭)、6 mg/kg(1.5倍、8頭)を1日おきに13週間連日経口投与し、投与間隔の延長を認めず、投与量に応じ投与量を増減させた。 6019><2990>飼料消費量はプラセボと比較して6 mg/kg群で減少し,平均値の差が最も大きかったのは35日目であった。 体重の減少は、プラセボと比較して4mg/kg群では31日目に、6mg/kg群では15日目に認められ、試験期間中継続した。 投与量に関連した跛行(ほとんど後肢にのみ認められる)および肢痛は、プラセボと比較してすべての投与群で大きく、6 mg/kg群では最も高い発生率を示した。 また、硬直と脱力はほとんど6 mg/kg群にのみ認められた。 口腔粘膜の発赤は全投与群にみられた。 4mg/kg群の1頭に口腔内潰瘍、6mg/kg群の1頭に皮膚潰瘍が認められ、いずれも細菌感染が認められた。
血液学的解析では、ヘマトクリット、ヘモグロビン、赤血球数の減少、4および6mg/kg群での網状赤血球数の減少が認められたが、赤血球数の減少をさらに抑えるために十分回復する傾向があった。 白血球数は、プラセボと比較して、すべての投与群で試験期間中に有意に減少し、主に好中球の減少が原因であった。 リンパ球は、特に低用量において、より少ない程度で減少しました。 好酸球と好塩基球は、顕著で持続的な減少を示しました。 単球は影響を受けなかった。
血小板数は4mg/kg群および6mg/kg群でわずかに増加した。 フィブリノゲンは4及び6mg/kg群で増加が認められた。
アスパラギン酸アミノトランスフェラーゼ、クレアチンキナーゼ及び血清リンの濃度は4及び6mg/kg群で増加が認められた。 アルカリホスファターゼの増加が6mg/kg群でみられた。 アミラーゼの増加が各投与群1頭ずつにみられた。 血清カリウムの増加が6 mg/kg群の1頭にみられた。 乳酸脱水素酵素及びグロブリンの増加が6mg/kg群で認められた。
治療に関連した顕微鏡的変化として、胸骨及び大腿骨骨髄の細胞性が軽度から顕著に減少した。 脾臓では赤血球造血を中心とする軽度の髄外造血がみられた。 膵臓では,線量に関連した軽度から中等度の腺房脱顆粒がみられ,酵素顆粒のびまん性消失が特徴的であった. 副腎では、すべての用量で最小限の皮質の鬱血/出血が発生し、用量相関が示唆された。 副腎皮質空胞化は全群で低頻度に認められた。 男女の生殖器に用量に関連した変化が認められた。 男性では、生殖細胞の減少、尿細管空胞化、成熟精子数の減少が用量に関係なく認められた。 雌では,卵巣で成熟/退行性黄体の減少および小卵胞の増加が認められた。
6mg/kg群の2頭(雄1頭,雌1頭)は,それぞれ試験開始23日目と27日目に治療関連の臨床毒性により安楽死させられた。 終末期症候群の発症は,著しい飼料摂取量の低下と下血としてみられた。 その後9日間にわたり、飼料摂取量の減少はほぼ完全な食欲不振に進行し、血便が出現した。 体重減少、嗜眠、後肢の跛行、衰弱が認められた。 以下の臨床病理結果は、6mg/kg群の他の犬で見られた変化や、安楽死直前の犬の衰弱状態による変化と一致するものである。 両犬とも総蛋白、グロブリン、リン、コレステロール、トリグリセリド、フィブリノーゲンが増加した。 1頭では汎血球減少、ヘマトクリット、ヘモグロビン、網状赤血球、アルブミン、PTの低下とバンドの上昇がみられた。 血尿もみられた。 もう1頭はリンパ球、好酸球、塩化物、ナトリウムが減少し、赤血球、ヘマトクリット、ヘモグロビン、血小板、ALP、アミラーゼ、クレアチニン、BUN、マグネシウム、カリウム、総ビリルビンが増加した。 凝固プロファイルでは,両犬ともPTが低下し,PTTが上昇した. 両犬ともリンパ節,胸腺,腸管関連リンパ組織のリンパ球減少がみられ,試験終了まで生存した動物にみられた顕微鏡所見に加え,軽度から顕著な消化管病変がみられた. また、この2頭には、消化管、腎臓、膵臓、下垂体、副腎に病変がみられました。
保管条件について。
投与方法
パラディア錠は、1錠あたりトセラニブリン酸塩として10mg、15mg、50mgを含有する。 30錠入りのボトルです。
1 London CA, Hannah AL, Zadovoskaya R, et al. 小分子受容体チロシンキナーゼ阻害剤SU11654の自然悪性腫瘍の犬における第1相用量漸増試験。 また、このような場合にも、「震災で被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」「被災された方々へのお見舞い」。 Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured:製造元。 Pfizer Inc, Ascoli, Italy
Distributed by: Zoetis Inc., Kalamazoo, MI 49007
改訂されました。 2015年8月
より