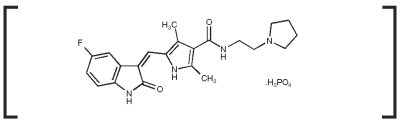
Palladia Indicaties
PALLADIA tabletten zijn geïndiceerd voor de behandeling van Patnaik graad II of III, recidiverende, cutane mastceltumoren met of zonder regionale lymfeklierbetrokkenheid bij honden.
Dosering en toedieningGeef altijd een informatieblad voor de klant bij het recept. Dien een aanvangsdosis van 3,25 mg/kg (1,48 mg/lb) lichaamsgewicht toe, oraal om de andere dag (zie tabel 1). Dosisreducties van 0,5 mg/kg (tot een minimumdosis van 2,2 mg/kg om de dag) en dosisonderbrekingen (onderbreking van de toediening van PALLADIA gedurende maximaal twee weken) kunnen, indien nodig, worden toegepast om bijwerkingen te beheersen (zie tabel 2 en Waarschuwingen en Voorzorgsmaatregelen). Pas de dosis aan op basis van ongeveer wekelijkse beoordelingen door de dierenarts gedurende de eerste 6 weken en ongeveer elke 6 weken daarna. PALLADIA kan met of zonder voedsel worden toegediend. Tabletten niet splitsen.
Tabel 1. 3.25 mg/kg Doseer tabel
|
Lichaamsgewicht hond |
Aantal tabletten |
||||
|
Pond |
Kilogrammen |
Dosis |
10 mg |
15 mg |
50 mg |
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
|||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
|||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
|||
|
18.6 – 22.0 |
8.5 – 10.0 |
30 mg |
|||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
|||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
|||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
|||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||
|
38.9 – 42.3 |
17.7 – 19.2 |
60 mg |
|||
|
42.4 – 45.6 |
19,3 – 20,7 |
65 mg |
|||
|
45,7 – 50.7 |
20.8 – 23.0 |
70 mg |
|||
|
50.8 – 59.3 |
23.1 – 26,9 |
80 mg |
|||
|
59,4 – 65,9 |
27.0 – 29.9 |
95 mg |
|||
|
66.0 – 71.2 |
30.0 – 32.3 |
100 mg |
|||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||
|
76.4 – 79.6 |
34.7 – 36.1 |
115 mg |
|||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
|||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
|||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
|||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
|||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
|||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
|||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||
|
139.0 – 144.0 |
63.1 – 65.3 |
210 mg |
|||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
|||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
|||
|
173,1 |
|||||
|
78,6 – 80,7 |
260 mg |
||||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
|||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
|||
Tabel 2: Dosisaanpassing op basis van waargenomen toxiciteit
|
Toxiciteit |
Dosisaanpassing |
|
Neutropenie |
|
|
>1000/µL |
Dosisniveau handhaven |
|
≤1000/µL of neutropene koorts of infectie |
Stop geneesmiddel totdat >1000/µL en klinische verschijnselen normaal zijn; verminder dan de dosis met 0.5 mg/kg |
|
Renale toxiciteit (creatinine) |
|
|
<2.0 mg/dL |
Behoud doseringsniveau |
|
≥2,0 mg/dL |
Stop geneesmiddel tot <2.0 mg/dL en verlaag de dosis dan met 0,5 mg/kg |
|
Albumine |
|
|
<1,5 g/dL |
Stop het geneesmiddel tot >2.5 g/dL dan dosis verlagen met 0,5 mg/kg |
|
Hematocriet |
|
|
<26% |
Stop medicijn tot >30% dan dosis verlagen met 0.5 mg/kg |
|
Diarree |
|
|
<4 waterige ontlasting/dag gedurende minder dan 2 dagen |
Dosis op peil houden en ondersteunende zorg instellen |
|
≥4 waterige ontlasting/dag of ≥ 2 dagen |
Stop medicatie tot gevormde ontlasting en stel ondersteunende zorg in. Wanneer de dosering wordt hervat, de dosis verlagen met 0,5 mg/kg |
|
GI Bloedingen |
|
|
Vers bloed in ontlasting of zwarte teerachtige ontlasting gedurende > 2 dagen of openlijke bloedingen of bloedstolsels in ontlasting. |
Stoppen met toedienen van het geneesmiddel en instellen van ondersteunende zorg totdat alle klinische verschijnselen van bloed in de ontlasting zijn verdwenen; vervolgens de dosis verlagen met 0,5 mg/kg.5 mg/kg. |
Contra-indicaties
Niet gebruiken bij honden die voor de fokkerij worden gebruikt, of bij drachtige of zogende teven (zie Klinische farmacologie).
Waarschuwingen
PALLADIA kan vasculaire disfunctie veroorzaken die kan leiden tot oedeem en trombo-embolie, inclusief pulmonale trombo-embolie. Stop het geneesmiddel totdat de klinische verschijnselen en de klinische pathologie zijn genormaliseerd. Om de homeostase van de vasculatuur te verzekeren, minstens 3 dagen na het stoppen van het geneesmiddel wachten alvorens een operatie uit te voeren (zie Bijwerkingen).
Ernstige en soms fatale gastro-intestinale complicaties, waaronder gastro-intestinale perforatie, zijn zelden voorgekomen bij honden die met PALLADIA werden behandeld (zie Bijwerkingen). Bij vermoeden van gastro-intestinale ulceratie de toediening van het geneesmiddel staken en adequaat behandelen.
Waarschuwingen voor mensen:
NIET VOOR GEBRUIK BIJ MENSEN. HOUD DIT EN ALLE GENEESMIDDELEN BUITEN HET BEREIK VAN KINDEREN. Kinderen mogen niet in contact komen met PALLADIA. Houd kinderen uit de buurt van uitwerpselen, urine of braaksel van behandelde honden. Om blootstelling aan het geneesmiddel te voorkomen, dient u na toediening van PALLADIA de handen met water en zeep te wassen en beschermende handschoenen te dragen om direct contact met ontlasting, urine, braaksel en gebroken of bevochtigde PALLADIA-tabletten te voorkomen. Doe al het afvalmateriaal in een plastic zak en sluit deze af voordat het algemeen wordt weggegooid. Indien de ogen per ongeluk aan het geneesmiddel worden blootgesteld, de ogen onmiddellijk met water spoelen. In geval van accidentele inname door een persoon, onmiddellijk een arts raadplegen en de bijsluiter of het etiket aan de arts tonen. Maagdarmklachten zoals braken of diarree kunnen optreden als dit geneesmiddel per ongeluk wordt ingenomen.
Zwangere vrouwen, vrouwen die zwanger kunnen worden, of zogende moeders moeten speciale aandacht besteden aan deze voorzorgsmaatregelen bij het hanteren. (Zie de behandelingsinstructies hierboven.) PALLADIA voorkomt, net als andere geneesmiddelen in zijn klasse, de vorming van nieuwe bloedvaten in tumoren. Op soortgelijke wijze kan PALLADIA de vorming van bloedvaten in de zich ontwikkelende foetus beïnvloeden en kan het een ongeboren baby schaden (aangeboren afwijkingen veroorzaken). Voor zwangere vrouwen kan accidentele inname van PALLADIA nadelige gevolgen hebben voor de zwangerschap.
Voorzorgsmaatregelen
Stop het gebruik van PALLADIA tijdelijk wanneer anemie, azotemie, hypoalbuminemie, en hyperfosfatemie gelijktijdig optreden. Hervat de behandeling met een dosisverlaging van 0,5 mg/kg na 1 tot 2 weken wanneer de waarden verbeterd zijn en het albumine >2,5 g/dL is. Tijdelijke onderbreking van de behandeling kan nodig zijn als een van de volgende situaties zich alleen voordoet: hematocriet <26%, creatinine ≥2,0 mg/dL of albumine <1,5 g/dL. Hervat vervolgens de behandeling met een dosisverlaging van 0,5 mg/kg zodra het hematocriet >30% is, het creatinine <2,0 mg/dL is, en het albumine >2,5 g/dL is.
Staak tijdelijk het gebruik van PALLADIA wanneer het aantal neutrofielen ≤1000/µL is. Hervat de behandeling na 1 tot 2 weken met een dosisverlaging van 0,5 mg/kg, wanneer het aantal neutrofielen is teruggekeerd tot >1000/µL. Verdere dosisreducties kunnen nodig zijn als ernstige neutropenie opnieuw optreedt.
De aanwezigheid van systemische mestceltumor voorafgaand aan de behandeling kan een hond predisponeren tot klinisch significante mestceldegranulatie met mogelijk ernstige systemische bijwerkingen wanneer hij met PALLADIA wordt behandeld. Er dient getracht te worden systemische mastocytose uit te sluiten vóór aanvang van de behandeling met PALLADIA.
PALLADIA is in verband gebracht met ernstige diarree of GI-bloedingen die onmiddellijke behandeling vereisen. Dosisonderbrekingen en dosisverlagingen kunnen nodig zijn, afhankelijk van de ernst van de klinische verschijnselen. (Zie tabel 2 in Dosering en toediening.)
Gebruik niet-steroïde anti-inflammatoire geneesmiddelen met voorzichtigheid in combinatie met PALLADIA vanwege een verhoogd risico op gastro-intestinale ulceratie of perforatie.
PALLADIA wordt gemetaboliseerd in de lever. Gelijktijdige toediening van PALLADIA met sterke remmers van de CYP3A4-familie kan de PALLADIA-concentraties verhogen. Het effect van gelijktijdige toediening van geneesmiddelen die het metabolisme van PALLADIA kunnen remmen, is niet geëvalueerd. De verenigbaarheid van geneesmiddelen dient te worden gecontroleerd bij patiënten die gelijktijdige medicatie nodig hebben.
Het veilige gebruik van PALLADIA is niet geëvalueerd bij honden jonger dan 24 maanden of met een gewicht van minder dan 5 kg.
Bijwerkingen
In een Amerikaans klinisch veldonderzoek, bestaande uit een gemaskeerde fase van 6 weken, gevolgd door een open-label fase, werden de veiligheid en werkzaamheid van PALLADIA geëvalueerd bij 151 honden van cliënten die Patnaik graad II of III, recidiverende, cutane mastceltumoren hadden met of zonder regionale betrokkenheid van lymfeklieren. De meest voorkomende bijwerkingen die tijdens de gemaskeerde fase werden gemeld, zijn samengevat in Tabel 3; de bijwerkingen die tijdens de gehele studie (gemaskeerde fase gecombineerd met de open-label fase) werden gemeld, zijn samengevat in Tabel 4.
Tabel 3. Overzicht van de meest voorkomende bijwerkingen tijdens de gemaskeerde fase
|
Placebo (n = 64) |
PALLADIA (n = 87) |
||||||
|
Gewenste bijwerking |
|||||||
|
Gewenste bijwerking Gewenste bijwerking Reaction |
Any Gradeb |
Grade 3 of 4b |
Any Gradeb |
Grade 3 of 4b |
|||
|
Diarree |
26.6% |
3.1% |
46.0% |
6,9% |
|||
|
Anorexia |
31,3% |
6.3% |
39,1% |
6,9% |
|||
|
Lethargie |
29.7% |
3.1% |
35.6% |
4.6% |
|||
|
Vermoeden |
32,8% |
6,3% |
32,2% |
9.2% |
|||
|
Lamheid |
9,4% |
0,0% |
17,4% |
17,2% |
.2% |
0.0% |
|
|
gewichtsverlies |
3.1% |
0.0% |
0.0% |
0.0% |
14,9% |
1,1% |
|
|
Bloed in ontlasting/GI bloeding/hemorragische diarree |
3,1% |
3,1% |
|||||
|
0.0% |
12.6% |
2.3% |
|||||
|
Musculoskeletale aandoening |
6,3% |
0.0% |
11,5% |
1,1% |
|||
|
Dehydratie |
4.7% |
0.0% |
9.2% |
2.3% |
|||
|
Dermatitis |
9,4% |
1,6% |
9,2% |
0,4% |
0,2% |
||
|
Pruritus |
4,7% |
0,0% |
9.2% |
0.0% |
|||
|
Tachypneu |
4.7% |
0,0% |
8,0% |
1,1% |
|||
|
Gelokaliseerde pijn |
4,7% |
0,0% |
8,1% |
.0% |
0.0% |
||
|
Nausea |
3.1% |
0.0% |
0.0% |
0.0% |
8,0% |
1,1% |
|
|
Algemene pijn |
4,7% |
4,1% |
|||||
|
1.6% |
6.9% |
0.0% |
|||||
|
Polydipsie |
7.8% |
0.0% |
0.0% |
||||
|
6,9% |
0,0% |
||||||
|
Pyrexia |
3.1% |
0.0% |
5.7% |
2.3% |
|||
|
Flatulentie |
3,1% |
0,0% |
5.7% |
0,0% |
|||
|
Pigmentatiestoornis |
1.6% |
0.0% |
5.7% |
0.0% |
|||
|
Laboratoriumafwijking |
Gradec |
Grade 3 of 4c |
Any Gradec |
Grade 3 of 4c |
|||
|
Neutropenie |
6.3% |
0.0% |
46.0% |
0.0% |
|||
|
Thrombocytopenie |
20.3% |
0.0% |
24.1% |
0.0% |
0.0% |
0.0% |
0.0% |
|
Verhoogd alanine aminotransferase |
21,9% |
4.7% |
24,1% |
1,1% |
|||
|
Hypoalbuminemie |
7.8% |
0.0% |
12.6% |
0.0% |
|||
|
Verlaagd hematocriet |
7.8% |
0.0% |
0.0% |
||||
|
.0% |
5,7% |
3,4% |
|||||
|
Hyperbilirubinemie |
1.6% |
1.6% |
5.7% |
0.0% |
|||
|
Verhoogd creatinine |
4,7% |
0,0% |
5.7% |
0,0% |
|||
|
Infectie van de urinewegen |
1.6% |
0,0% |
5,7% |
0,0% |
|||
a De gemiddelde studietijd tijdens de gemaskeerde fase was 37,0 dagen voor met PALLADIA behandelde honden (mediaan, 42.0 dagen) en 27,6 dagen voor met placebo behandelde honden (mediaan, 21,0 dagen); in de statistische vergelijkingen werden geen correcties aangebracht voor dit verschil.
b Onderzoekers kenden een ernstgraad toe van 1, 2, 3 of 4 (1 – minst ernstig; 4 – meest ernstig).
c Indeling van laboratoriumafwijkingen was gebaseerd op de Common Toxicity Criteria-richtlijn van het National Cancer Institute, aangepast voor hoektanden (1 – minst ernstig; 4 – meest ernstig).
Tabel 4. Samenvatting van de meest voorkomende bijwerkingen tijdens de studie (gemaskeerde fase gecombineerd met de open-label fase)a
|
PALLADIA (n = 145) a |
||||
|
Bijwerkingen |
Graad b |
Graad 3 of 4b |
||
|
Diarree |
58.6% |
8,3% |
||
|
Anorexia |
49.7% |
8,3% |
||
|
Vermoeden |
47.6% |
9,7% |
||
|
Lethargie |
39,3% |
4.1% |
||
|
Lamheid |
22,8% |
0,0% |
||
|
Gewichtsverlies |
21,4% |
2.8% |
||
|
Bloed in ontlasting/GI bloeding/hemorragische diarree |
18.6% |
2,8% |
||
|
Dehydratie |
15,2% |
2.1% |
||
|
Pruritus |
12,4% |
0,0% |
||
|
Pigmentatiestoornis |
11.7% |
0.0% |
||
|
Dermatitis |
11.0% |
0.0% |
||
|
Musculoskeletale aandoening |
11.0% |
0.0% |
||
|
Algemene pijn |
8.3% |
0.0% |
||
|
Otitis externa |
8.3% |
0,0% |
||
|
Tachypneu |
8,3% |
0,0% |
||
|
Tachypneu |
0.0% |
|||
|
Nausea |
7,6% |
1.4% |
||
|
Polydipsie |
7,6% |
0,0% |
||
|
Pyrexie |
6.9% |
2,8% |
||
|
Arthritis |
6,2% |
0,0% |
||
|
Gelokaliseerd oedeem |
6.2% |
0,0% |
||
|
Bacteriële huidinfectie |
5,5% |
0,0% |
||
|
Conjunctivitis |
5,5% |
5,0% |
||
|
Conjunctivitis |
5,0% |
0.0% |
||
|
Laboratoriumafwijking |
Any Gradec |
Grade 3 of 4c |
||
|
Neutropenie |
44.8% |
1,4% |
||
|
Hypoalbuminemie |
28,3% |
1.4% |
||
|
Thrombocytopenie |
28,3% |
2.1% |
||
|
Verhoogd alanine aminotransferase |
27,6% |
4.1% |
||
|
Verlaagd hematocriet |
11,0% |
2.8% |
||
|
Verhoogd creatinine |
13,8% |
1,4% |
||
|
Hyperbilirubinemie |
6,9% |
0,0% |
0,0% |
.0% |
|
Infectie van de urinewegen |
7,6% |
0,0% |
||
a De duur van de behandeling met PALLADIA varieerde van 2 tot 812 dagen (gemiddelde, 144 dagen; mediaan, 68 dagen). Alle honden kregen ten minste 1 dosis PALLADIA.
b Onderzoekers kenden een ernstgraad toe van 1, 2, 3 of 4 (1 – minst ernstig; 4 – meest ernstig).
c De classificatie van laboratoriumafwijkingen was gebaseerd op de richtlijn Common Toxicity Criteria van het National Cancer Institute, aangepast voor honden (1 – minst ernstig; 4 – meest ernstig).
Overige bijwerkingen werden gemeld, maar traden op bij < 5% van de honden. Elke individuele hond kan meerdere bijwerkingen hebben gehad.
Er waren 5 sterfgevallen tijdens deze studie die mogelijk verband hielden met het geneesmiddel. Pathologische bevindingen toonden over het algemeen bewijs van vasculaire dysfunctie, waaronder pulmonale trombo-embolie (postoperatief); multi-orgaanfalen geassocieerd met vasculitis en trombose; vasculaire trombose met gedissemineerde intravasculaire coagulopathie (DIC) en pancreatitis; en vasculitis met DIC. Eén hond overleed als gevolg van maagperforatie; de duur van de behandeling met PALLADIA was 221 dagen en bij autopsie waren er geen aanwijzingen voor mastceltumoren. Deze sterfgevallen traden op in de aanwezigheid of afwezigheid van bruto-disease; de duur van de behandeling varieerde van 18 tot 221 dagen.
Het verband van de volgende sterfgevallen met het geneesmiddel is onbekend. Eén hond, die eerst 3 weken werd behandeld met een placebo, stierf aan een onbekende oorzaak 7 dagen na het begin van de PALLADIA-behandeling. Een andere hond stierf aan een onbekende oorzaak 92 dagen na het begin van de PALLADIA-therapie. Bij geen van beide honden werd necropsie verricht.
Zevenentwintig honden ontwikkelden een vorm van gastro-intestinale bloeding, waarbij 2,8% van de honden een ernstige bloeding had. Eén hond ontwikkelde een maagzweer die mogelijk verband hield met het geneesmiddel. Drie honden stierven aan gastrische (1 hond) of duodenale (2 honden) perforaties tijdens de studie. Eén hond met een perforatie van de twaalfvingerige darm kreeg slechts één dosis van het studiegeneesmiddel en werd daarom niet beschouwd als geneesmiddelgerelateerd.
Zeven honden ontwikkelden depigmentatie van de neus binnen de eerste paar weken van de behandeling. Elf honden ontwikkelden vachtkleur- of huidveranderingen tijdens de studie. Twee van deze honden hadden volledige vachtkleurveranderingen van vaalros naar wit en van dieprood naar blond. Zeven honden ondervonden alopecia.
Er is een geneesmiddel gerelateerd effect op het lichaamsgewicht: 20,0% van de honden had >13% gewichtsverlies in de gemaskeerde plus open-label fase toe te schrijven aan het geneesmiddel. Hiervan hadden 5 honden >25% gewichtsverlies.
Drie honden hadden aanvalsgewijze activiteit terwijl ze studiemedicatie kregen. Het kan niet worden vastgesteld of deze drug gerelateerd waren.
Twee honden ontwikkelden epistaxis die niet geassocieerd was met trombocytopenie. Een andere hond ontwikkelde epistaxis met gelijktijdige gedissemineerde intravasculaire coagulopathie.
Voor een kopie van het veiligheidsinformatieblad (SDS) of om bijwerkingen te melden bel Zoetis op 1-888-963-8471.
Informatie voor hondeneigenaren:
Breng altijd een informatieblad mee met het recept en lees dit door met de eigenaars. Eigenaren moeten worden geadviseerd over mogelijke bijwerkingen en wanneer te stoppen met het geneesmiddel en de dierenarts te bellen. Eigenaren moeten op de hoogte worden gebracht van de gebruiksinstructies.
Clinische farmacologie
Werkingsmechanisme: Toceranib fosfaat is een kleine molecule die zowel directe antitumor- als antiangiogene activiteit heeft. In niet-klinische farmacologische studies remde toceranib selectief de tyrosinekinaseactiviteit van verschillende leden van de gespleten kinase-receptor tyrosinekinase (RTK)-familie, waarvan sommige betrokken zijn bij tumorgroei, pathologische angiogenese en metastatische progressie van kanker. Toceranib remt de activiteit van het tyrosinekinase Flk-1/KDR (vasculaire endotheliale groeifactorreceptor, VEGFR2), de receptor van de bloedplaatjesafgeleide groeifactor (PDGFR), en de stamcelfactorreceptor (Kit) in zowel biochemische als cellulaire tests. Van toceranib is aangetoond dat het een antiproliferatief effect heeft op endotheelcellen in vitro. Behandeling met toceranib kan celcyclusstilstand en daaropvolgende apoptose induceren in tumorcellijnen die activerende mutaties in het split kinase RTK, ckit, tot expressie brengen. Tumorgroei van mestceltumoren bij honden wordt vaak gestimuleerd door activerende mutaties in c-kit.1,2
Andere verbindingen in de klasse van antiangiogenese antineoplastica staan erom bekend dat ze embryonale sterfte en foetale afwijkingen doen toenemen. Aangezien angiogenese een essentieel onderdeel is van de embryonale en foetale ontwikkeling, moet worden verwacht dat remming van angiogenese na toediening van PALLADIA zal leiden tot nadelige gevolgen voor de zwangerschap bij de teef.
Farmacokinetiek
Na intraveneuze toediening wordt de farmacokinetiek van toceranib gekenmerkt door een zeer groot verdelingsvolume (>20 L/kg, wat wijst op partitionering in weefsels), een terminale eliminatiehalfwaardetijd van ongeveer 16 uur, en een klaring van >1 L/uur/kg. Met een regime van 3,25 mg vrije base-equivalent (fbe)/kg doses toceranib, om de dag oraal toegediend per tablet gedurende 2 weken (7 doses), worden de farmacokinetische parameters van toceranib in plasma bij gezonde Beagle-honden (tussen 7,2 – 12,5 kg) in de onderstaande tabel weergegeven.
Tabel 5: Farmacokinetische parameters
|
Pharmacokinetische parameters (gemiddelde + 1SD) |
Totaal (n=11;6M, 5F) |
Totaal (n=10; 5M, 5F) |
|
Eliminatiehalfwaardetijd, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Tijd tot maximale plasmaconcentratie, Tmax (u) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Maximale plasmaconcentratie, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Area under the plasma concentration time-curve, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Dosis-genormaliseerde waarde (aangepast aan 3.25 mg/kg dosis)
b Cmin is de concentratie op 48 uur na de dosis, die overeenkomt met het dosisinterval.
Orale biologische beschikbaarheid van toceranib is 77%. PALLADIA is in hoge mate eiwitgebonden met 91% tot 93%.
Opgemerkt moet worden dat ondanks de homogeniteit van de proefpersonen in deze studie, grote variabiliteit tussen proefpersonen werd waargenomen. Ongeacht de wijze van toediening is een lineaire farmacokinetiek waargenomen bij doses tot 5 mg/kg tweemaal daags. Met behulp van een in vitro hepatocyten- en levermicrosomen-testsysteem bleek dat het Z-isomeer werd gemetaboliseerd tot het N-oxide derivaat van toceranib bij honden, mensen, katten en ratten. Hoewel er een klein verschil tussen de geslachten werd waargenomen in de in vitro studie (81% conversie bij mannelijke honden, 56% conversie bij vrouwelijke honden) werden er geen verschillen in de farmacokinetiek van toceranib in vivo waargenomen. De effecten van nierfunctiestoornissen, leverfunctiestoornissen of ras op de farmacokinetiek van toceranib zijn niet onderzocht.
Effectiviteit
De effectiviteit en veiligheid van PALLADIA orale tabletten voor de behandeling van mastceltumoren werd geëvalueerd in een gerandomiseerd, placebogecontroleerd, dubbel gemaskeerd, multicenter klinisch veldonderzoek. Het doel van deze studie was het evalueren van de effectiviteit en veiligheid van PALLADIA bij de behandeling van mastceltumoren bij honden met recidiverende meetbare ziekte na chirurgie en het evalueren van objectieve respons (complete of gedeeltelijke respons). PALLADIA-behandeling werd vergeleken met placebobehandeling aan de hand van responspercentages aan het einde van de 6 weken durende gemaskeerde fase. Responspercentages werden bepaald met behulp van de Response Evaluation Criteria in Solid Tumors Guideline3 van het National Cancer Institute, die specifiek werd aangepast voor de evaluatie van mastceltumoren bij honden.
Eenhonderddrieënveertig honden werden willekeurig toegewezen aan behandeling met 3,25 mg/kg PALLADIA (n = 88) of placebo (n = 65) oraal, om de dag gedurende 6 weken, of tot progressie van de ziekte of terugtrekking uit de studie om een andere reden. De behandeling werd ontmaskerd op het moment van ziekteprogressie: honden die placebo kregen, kregen vervolgens een cross-over aangeboden naar open-label PALLADIA; honden die PALLADIA kregen, werden uit de studie verwijderd. Honden moesten Patnaik graad II of III, recidiverende, cutane mastceltumoren hebben met of zonder betrokkenheid van regionale lymfeklieren. Tenminste 1 tumor moest tenminste 20 mm in diameter zijn. Honden hadden een limiet van 1 afgerond bestralingsprotocol en een limiet van 1 voorafgaande systemische chemotherapiebehandeling. Honden met aanwijzingen voor een systemische mastceltumor werden uitgesloten. Behandeling met systemische corticosteroïden tijdens de studie of binnen 14 dagen voorafgaand aan het begin van de studie was niet toegestaan. Indien nodig om bijwerkingen te beheersen, werden dosisonderbrekingen (staken van PALLADIA gedurende maximaal 2 weken) voorgeschreven en/of werd de dosering verlaagd tot zo laag als 2,2 mg/kg.
De effectiviteitsanalyse toonde een statistisch significant voordeel voor PALLADIA boven placebo op het primaire effectiviteitseindpunt van objectieve respons aan het einde van de gemaskeerde fase van zes weken. Objectieve respons is complete respons + partiële respons. Partiële respons is ≥ 30% afname in de som van de langste diameter van de doelwitlaesies, met als referentie de som bij de uitgangswaarde, geen progressie van niet-doelwitlaesies en het ontstaan van geen nieuwe laesies.
Mastceltumor – Primaire effectiviteitseindpuntresultaten
|
Effectiviteitsparameter |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-waarde |
|
Objectief Responspercentage * |
7.9% |
37.2% |
< 0.001 |
* Het verschil in objectieve respons tussen de groepen was niet significant geassocieerd met tumorlast (aanwezigheid vs. afwezigheid van regionale lymfeklierbetrokkenheid) of tumorgraad (P > 0,05).
Tijdens de studie werd PALLADIA gelijktijdig toegediend met andere geneesmiddelen zoals antimicrobiële middelen, H-2 receptor blokkers, antihistaminica, anti-emetica, niet-steroïde anti-inflammatoire geneesmiddelen, lokaal werkende anti-ulcermedicijnen, opiaat gastro-intestinale motiliteits-modifiers, opioïden, vaccins, anthelmintica, antiparasitica, en topische/ophthalmische/otic corticosteroïd preparaten. Alleen tijdens de open-label fase kregen 5 honden een korte kuur kortwerkende corticosteroïden.
Dierveiligheid:
In het hieronder gepresenteerde onderzoek naar de veiligheid bij dieren bleek PALLADIA een smalle veiligheidsmarge te hebben; honden die met PALLADIA worden behandeld, moeten worden gecontroleerd op bijwerkingen die erop kunnen wijzen dat een dosisaanpassing nodig is. Twee honden in de 6 mg/kg groep werden geëuthanaseerd vanwege klinische toxiciteiten op respectievelijk dag 23 en dag 27 van de studie.
Toceranib werd oraal toegediend aan 20 volwassen mannelijke en 20 vrouwelijke Beagle honden (ongeveer 2 jaar oud) in doses van 0 mg/kg (placebo, 12 honden), 2 mg/kg (0,5X, 8 honden), 4 mg/kg (1X, 12 honden), of 6 mg/kg (1,5X, 8 honden) eenmaal om de andere dag gedurende 13 opeenvolgende weken zonder onderbreking van de dosis. Toceranib veroorzaakte gewichtsverlies, verminderde voerconsumptie, pancreas-, gonadale, bijnier-, spier- en hematopoietische veranderingen.
Voerconsumptie was verminderd in de 6 mg/kg groep in vergelijking met placebo, met het grootste verschil in middelen op dag 35. Een afname van het lichaamsgewicht in de 4 mg/kg-groep werd waargenomen op dag 31 en in de 6 mg/kg-groep op dag 15 in vergelijking met placebo, en zette zich voort gedurende het onderzoek. Dosisgerelateerde kreupelheid, vrijwel uitsluitend waargenomen in de achterpoten, en pijn in de ledematen waren in alle behandelingsgroepen groter dan in de placebogroep, waarbij de 6 mg/kg-groep de hoogste incidentie vertoonde. Stijfheid en zwakte kwamen vrijwel uitsluitend voor in de 6 mg/kg groep. Roodheid van mondslijmvlies werd waargenomen in alle behandelingsgroepen. Eén hond in de 4 mg/kg-groep had zweren in de mond en één hond in de 6 mg/kg-groep had zweren op de huid, waarbij in beide gevallen bacteriële infecties aanwezig waren. Diarree of zachte ontlasting werden waargenomen in alle vier groepen.
Hematologische analyses toonden dalingen in hematocriet, hemoglobine en erytrocytenaantallen en een daling in reticulocytenaantallen in de 4 en 6 mg/kg groepen die de neiging vertoonden voldoende te herstellen om verdere dalingen in erytrocytenaantallen te beperken. Het aantal witte bloedcellen was significant lager gedurende het onderzoek in alle behandelde groepen vergeleken met placebo, voornamelijk als gevolg van een afname van neutrofielen. Lymfocyten daalden in mindere mate, vooral bij de lage dosis. Eosinofielen en basofielen vertoonden duidelijke, aanhoudende dalingen. Monocyten werden niet beïnvloed.
Het aantal bloedplaatjes nam licht toe in de 4 en 6 mg/kg groepen. Er werden toenames waargenomen in fibrinogeen in de 4 en 6 mg/kg groep.
Er werden toenames waargenomen in aspartaataminotransferase, creatinekinase, en serumfosforconcentraties in de 4 en 6 mg/kg groepen. In de 6 mg/kg-groep werd een stijging van alkalische fosfatase waargenomen. Een stijging van amylase werd waargenomen bij één hond in elk van de behandelingsgroepen. Een stijging van het serumkalium werd waargenomen bij één hond in de 6 mg/kg-groep. Stijgingen in lactaatdehydrogenase en globulinen werden waargenomen in de 6 mg/kg groep.
Microscopische veranderingen als gevolg van de behandeling omvatten een lichte tot duidelijke vermindering van de cellulariteit van het sternale en femorale beenmerg. Er was een overeenkomstige lichte extramedullaire hematopoëse, voornamelijk erytropoëse, in de milt. In de pancreas trad dosis-gerelateerde lichte tot matige acinar degranulatie op, gekenmerkt door diffuus verlies van zymogene korrels. In de bijnieren traden minimale corticale congestie/bloeding op bij alle doses, met een suggestieve dosis-relatie. Bijnierschorsvacuolatie werd met lage frequentie waargenomen in alle groepen. Dosisgerelateerde veranderingen werden waargenomen in voortplantingsorganen van beide geslachten. Mannetjes vertoonden een dosis-gerelateerde kiemceluitputting, tubulaire vacuolatie en reducties in aantallen rijpe spermatozoa. Bij vrouwtjes vertoonden de eierstokken een verminderde incidentie van rijpe/terugtrekkende corpora lutea en een verhoogde incidentie van kleine follikels.
Twee honden (een mannetje, een vrouwtje) in de 6 mg/kg groep werden geëuthanaseerd vanwege behandelingsgerelateerde klinische toxiciteiten op respectievelijk 23 en 27 dagen van de studie. Het begin van het terminale syndroom werd gezien als duidelijk verminderde voeropname en melena. Gedurende de volgende 9 dagen ging de verminderde voeropname over in bijna volledige anorexie en verscheen hematochezia. Gewichtsverlies, lusteloosheid, kreupelheid aan de achterpoten en zwakte werden waargenomen. De volgende klinische pathologische resultaten komen overeen met veranderingen die werden waargenomen bij de andere honden in de 6 mg/kg groep, alsmede met veranderingen die te wijten waren aan de verzwakte toestand van de honden vlak voor de euthanasie. Beide honden hadden een verhoging van het totaal eiwit, globulinen, fosfor, cholesterol, triglyceriden en fibrinogeen. Eén hond had pancytopenie, verlaagde hematocriet, hemoglobine, reticulocyten, albumine, en PT en verhoogde banden. Hematurie was ook aanwezig. De andere hond had ook verlaagde lymfocyten, eosinofielen, chloride, en natrium en verhogingen in RBC, hematocriet, hemoglobine, bloedplaatjes, ALP, amylase, creatinine, BUN, magnesium, kalium, en totaal bilirubine. Het stollingsprofiel toonde een verlaagde PT en een verhoogde PTT bij beide honden. Deze honden vertoonden lymfoïde depletie in lymfeklieren, thymus, en darm-geassocieerd lymfatisch weefsel en milde tot duidelijke gastro-intestinale laesies in aanvulling op de microscopische bevindingen beschreven bij dieren die overleefden tot het einde van de studie. Deze twee honden hadden ook laesies in het maagdarmkanaal, de nieren, de pancreas, de hypofyse en de bijnieren.
Opbergcondities: Bewaren bij gecontroleerde kamertemperatuur 20° tot 25° C (68° tot 77° F).
Hoe geleverd
PALLADIA-tabletten bevatten 10 mg, 15 mg, of 50 mg toceranib als toceranibfosfaat per tablet. De tabletten zijn verpakt in flesjes van 30 stuks.
1 London CA, Hannah AL, Zadovoskaya R, et al. Fase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured by: Pfizer Inc, Ascoli, Italy
Distributed by: Zoetis Inc, Kalamazoo, MI 49007
herzien: Augustus 2015