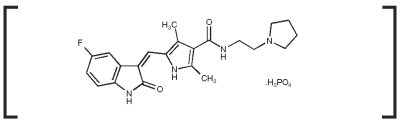
Palladia Indikationer
PALLADIA-tabletter är indicerade för behandling av Patnaik grad II eller III, recidiverande, kutana mastcellstumörer med eller utan regional lymfkörtelpåverkan hos hundar.
Dosering och administreringFörse alltid informationsbladet med recept. Administrera en initial dos på 3,25 mg/kg (1,48 mg/lb) kroppsvikt, oralt varannan dag (se tabell 1). Dosminskningar på 0,5 mg/kg (till en lägsta dos på 2,2 mg/kg (1,0 mg/lb) varannan dag) och dosavbrott (upphörande av PALLADIA i upp till två veckor) kan användas vid behov för att hantera biverkningar (se tabell 2 samt Varningar och försiktighet). Justera dosen baserat på ungefär veckovisa veterinärbedömningar under de första 6 veckorna och ungefär var 6:e vecka därefter. PALLADIA kan administreras med eller utan foder. Dela inte tabletterna.
Tabell 1. 3.Doseringstabell för 25 mg/kg
|
Hundens kroppsvikt |
Antal tabletter |
||||||
|
Pund |
Kilogram |
Dos |
10 mg |
15 mg |
50 mg |
||
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
|||||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
|||||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
|||||
|
18.6 – 22,0 |
8,5 – 10,0 |
30 mg |
|||||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
|||||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
|||||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
|||||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
|||||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
|||||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
|||||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
|||||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
|||||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
|||||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
|||||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
|||||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
|||||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
|||||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
|||||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
|||||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
|||||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||||
|
139.0 – 144.0 |
63.1 – 65.3 |
210 mg |
|||||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
|||||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
|||||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
|||||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
|||||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
|||||
Tabell 2: Dosändring baserat på observerad toxicitet
|
Toxicitet |
Dosjustering |
|
Neutropeni |
|
|
>1000/µL |
Håller dosnivån |
|
≤1000/µL eller neutropenisk feber eller infektion |
Stoppa läkemedlet tills >1000/µL och kliniska tecken är normala; Sänk sedan dosen med 0.5 mg/kg |
|
Renala toxiciteter (kreatinin) |
|
|
<2.0 mg/dL |
Behåll dosnivån |
|
≥2,0 mg/dL |
Stoppa läkemedlet tills <2.0 mg/dL minska sedan dosen med 0,5 mg/kg |
|
Albumin |
|
|
<1,5 g/dL |
Stoppa läkemedlet tills >2.5 g/dL och minska sedan dosen med 0,5 mg/kg |
|
Hematokrit |
|
|
<26% |
Stoppa läkemedlet tills >30% och minska sedan dosen med 0.5 mg/kg |
|
Diarré |
|
|
<4 vattniga avföringar/dag i mindre än 2 dagar |
Håller dosnivån och institute supportive care |
|
≥4 vattniga avföringar/dag eller ≥ 2 dagar |
Stoppa läkemedlet tills det bildats avföring och institute supportive care. När doseringen återupptas, minska dosen med 0,5 mg/kg |
|
GI Blödning |
|
|
Färsk blod i avföringen eller svart tjärig avföring under > 2 dygn eller öppen blödning eller blodproppar i avföringen. |
Stoppa läkemedlet och inled understödjande vård tills alla kliniska tecken på blod i avföringen har upphört, minska sedan dosen med 0.5 mg/kg. |
Kontraindikationer
Använd inte till hundar som används för avel eller till dräktiga eller ammande tikar (se Klinisk Farmakologi).
Varningar
PALLADIA kan orsaka vaskulär dysfunktion som kan leda till ödem och tromboembolism, inklusive pulmonell tromboembolism. Avbryt läkemedlet tills kliniska tecken och klinisk patologi har normaliserats. För att säkerställa kärlhomeostas, vänta minst 3 dagar efter avslutad behandling med läkemedlet innan du utför en operation (se Biverkningar).
Seriösa och ibland dödliga gastrointestinala komplikationer inklusive gastrointestinal perforation har sällan inträffat hos hundar som behandlats med PALLADIA (se Biverkningar). Om gastrointestinal ulceration misstänks, stoppa läkemedelsadministrationen och behandla på lämpligt sätt.
Varningar för människor:
Inte för användning hos människor. FÖRVARA DETTA OCH ALLA LÄKEMEDEL UTOM RÄCKHÅLL FÖR BARN. Barn får inte komma i kontakt med PALLADIA. Håll barn borta från avföring, urin eller kräkningar från behandlade hundar. För att undvika exponering för läkemedlet, tvätta händerna med tvål och vatten efter administrering av PALLADIA och bär skyddshandskar för att förhindra direktkontakt med avföring, urin, kräkningar och trasiga eller fuktade PALLADIA-tabletter. Placera allt avfallsmaterial i en plastpåse och försegla den före allmänt bortskaffande. Om ögonen oavsiktligt exponeras för läkemedlet ska ögonen omedelbart sköljas med vatten. Vid oavsiktligt intag av en person, sök omedelbart läkare, visa bipacksedeln eller etiketten för läkaren. Gastrointestinala obehag såsom kräkningar eller diarré kan uppstå om detta läkemedel oavsiktligt intas.
Gravida kvinnor, kvinnor som kan bli gravida eller ammande mödrar bör ägna särskild uppmärksamhet åt dessa försiktighetsåtgärder vid hantering. (Se hanteringsanvisningar ovan.) PALLADIA, liksom andra läkemedel i sin klass, förhindrar bildandet av nya blodkärl i tumörer. På liknande sätt kan PALLADIA påverka blodkärlsbildningen hos foster under utveckling och kan skada ett ofött barn (orsaka fosterskador). För gravida kvinnor kan ett oavsiktligt intag av PALLADIA ha negativa effekter på graviditeten.
Försiktighetsåtgärder
Sluta tillfälligt att använda PALLADIA om anemi, azotemi, hypoalbuminemi och hyperfosfatemi uppträder samtidigt. Återuppta behandlingen med en dosreduktion på 0,5 mg/kg efter 1 till 2 veckor när värdena har förbättrats och albuminet är >2,5 g/dL. Tillfälliga behandlingsavbrott kan behövas om något av dessa inträffar ensamt: hematokrit <26 %, kreatinin ≥2,0 mg/dL eller albumin <1,5 g/dL. Återuppta sedan behandlingen med en dosreduktion på 0,5 mg/kg när hematokriten är >30 %, kreatininet är <2,0 mg/dL och albuminet är >2,5 g/dL.
Temporärt avbryta användningen av PALLADIA om neutrofilantalet är ≤1000/µL. Återuppta behandlingen efter 1 till 2 veckor med en dosreduktion på 0,5 mg/kg, när antalet neutrofiler har återgått till >1000/µL. Ytterligare dosreduktioner kan behövas om allvarlig neutropeni återkommer.
Närvaro av systemisk mastcellstumör före behandling kan predisponera en hund för kliniskt signifikant mastcellsdegranulering med möjliga allvarliga systemiska biverkningar vid behandling med PALLADIA. Försök ska göras för att utesluta systemisk mastocytos innan behandling med PALLADIA inleds.
PALLADIA har förknippats med svår diarré eller gastrointestinala blödningar som kräver snabb behandling. Dosavbrott och dosminskningar kan behövas beroende på de kliniska tecknens svårighetsgrad. (Se tabell 2 i Dosering och administrering.)
Använd icke-steroida antiinflammatoriska läkemedel med försiktighet tillsammans med PALLADIA på grund av en ökad risk för gastrointestinal ulceration eller perforation.
PALLADIA metaboliseras i levern. Samtidig administrering av PALLADIA med starka hämmare av CYP3A4-familjen kan öka PALLADIA-koncentrationerna. Effekten av samtidiga läkemedel som kan hämma metabolismen av PALLADIA har inte utvärderats. Läkemedelskompatibilitet bör övervakas hos patienter som kräver samtidig medicinering.
Den säkra användningen av PALLADIA har inte utvärderats hos hundar som är yngre än 24 månader eller väger mindre än 5 kg.
Biverkningar
En amerikansk klinisk fältstudie som bestod av en 6 veckors maskerad fas, följt av en öppen fas, utvärderade säkerheten och effektiviteten av PALLADIA hos 151 kundägda hundar som hade Patnaik-grad II eller III, recidiverande, kutana mastcellstumörer med eller utan regional lymfkörtelpåverkan. De vanligaste biverkningarna som rapporterades under den maskerade fasen sammanfattas i tabell 3; de som rapporterades under hela studien (den maskerade fasen kombinerad med den öppna fasen) sammanfattas i tabell 4.
Tabell 3. Sammanfattning av de vanligaste biverkningarna under den maskerade fasena
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Biverkningar. Reaction |
Any Gradeb |
Grade 3 eller 4b |
Any Gradeb |
Grade 3 eller 4b |
|
Diarré |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anorexia |
31,3% |
6.3% |
39,1% |
6,9% |
|
Letargi |
29.7% |
3.1% |
35.6% |
4.6% |
|
Kräkningar |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lamslighet |
9,4% |
0,0% |
17.2% |
0.0% |
|
Viktminskning |
3.1% |
0.0% |
14,9% |
1,1% |
|
Blod i avföringen/GI blödning/hemorragisk diarré |
3.1% |
0.0% |
12.6% |
2.3% |
|
Muskuloskeletala sjukdomar |
6,3% |
0.0% |
11,5% |
1,1% |
|
Dehydrering |
4.7% |
0.0% |
9.2% |
2.3% |
|
Dermatit |
9,4% |
1,6% |
9,2% |
0.0% |
|
Pruritus |
4,7% |
0,0% |
9.2% |
0,0% |
|
Takypné |
4.7% |
0,0% |
8,0% |
1,1% |
|
Lokaliserad smärta |
4,7% |
0,0% |
8.0% |
0.0% |
|
Nausea |
3.1% |
0.0% |
8,0% |
1,1% |
|
Allmän smärta |
4.7% |
1,6% |
6,9% |
0,0% |
|
Polydipsi |
7,8% |
0.0% |
6,9% |
0,0% |
|
Pyrexi |
3.1% |
0.0% |
5.7% |
2.3% |
|
Flatulens |
3,1% |
0,0% |
5.7% |
0,0% |
|
Pigmenteringsstörning |
1.6% |
0.0% |
5.7% |
0.0% |
|
Laboratorieavvikelse |
Någon gradering |
Grad 3 eller 4c |
Alla Gradec |
Grad 3 eller 4c |
|
Neutropeni |
6.3% |
0.0% |
46.0% |
0.0% |
|
Thrombocytopeni |
20.3% |
0.0% |
24.1% |
0.0% |
|
Ökat alaninaminotransferas |
21,9% |
4.7% |
24,1% |
1,1% |
|
Hypoalbuminemi |
7.8% |
0,0% |
12,6% |
0,0% |
|
Förminskad hematokrit |
7,8% |
0.0% |
5,7% |
3,4% |
|
Hyperbilirubinemi |
1.6% |
1.6% |
5.7% |
0.0% |
|
Ökat kreatinin |
4,7% |
0,0% |
5.7% |
0,0% |
|
Urinvägsinfektion |
1.6% |
0,0% |
5,7% |
0,0% |
a Den genomsnittliga studietiden under den maskerade fasen var 37,0 dagar för PALLADIA-behandlade hundar (median, 42.0 dagar) och 27,6 dagar för placebobehandlade hundar (median, 21,0 dagar); inga justeringar gjordes i de statistiska jämförelserna för denna skillnad.
b Utredarna tilldelade allvarlighetsgraden 1, 2, 3 eller 4 (1 – minst allvarlig; 4 – svårast).
c Gradering av laboratorieavvikelser baserades på National Cancer Institutes riktlinjer för Common Toxicity Criteria anpassade för hundar (1 – minst allvarlig; 4 – mest allvarlig).
Tabell 4. Sammanfattning av de vanligaste biverkningarna under studien (maskerad fas i kombination med öppen fas).label-fasen)a
|
PALLADIA (n = 145) a |
||
|
Biverkningar |
Alla graderb |
Grad 3 eller 4b |
|
Diarré |
58.6% |
8,3% |
|
Anorexi |
49.7% |
8,3% |
|
Kräkningar |
47.6% |
9,7% |
|
Letargi |
39,3% |
4.1% |
|
Lamhet |
22,8% |
0,0% |
|
Viktminskning |
21,4% |
2.8% |
|
Blod i avföringen/GI blödning/hemorragisk diarré |
18.6% |
2,8% |
|
Dehydrering |
15,2% |
2.1% |
|
Pruritus |
12,4% |
0,0% |
|
Pigmentationsstörning |
11.7% |
0.0% |
|
Dermatit |
11.0% |
0.0% |
|
Muskuloskeletala sjukdomar |
11.0% |
0.0% |
|
Allmän smärta |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0,0% |
|
Takypné |
8,3% |
0.0% |
|
Nausea |
7,6% |
1.4% |
|
Polydipsi |
7,6% |
0,0% |
|
Pyrexi |
6.9% |
2,8% |
|
Artrit |
6,2% |
0,0% |
|
Lokaliserat ödem |
6.2% |
0,0% |
|
Bakteriell hudinfektion |
5,5% |
0,0% |
|
Blodsinflammation |
5.5% |
0.0% |
|
Laboratorieavvikelse |
Något Gradec |
Grad 3 eller 4c |
|
Neutropeni |
44.8% |
1,4% |
|
Hypoalbuminemi |
28,3% |
1.4% |
|
Thrombocytopeni |
28,3% |
2.1% |
|
Förhöjt alaninaminotransferas |
27,6% |
4.1% |
|
Minskad hematokrit |
11,0% |
2.8% |
|
Förhöjt kreatinin |
13,8% |
1,4% |
|
Hyperbilirubinemi |
6,9% |
0.0% |
|
Urinvägsinfektion |
7,6% |
0,0% |
a Behandlingslängden med PALLADIA varierade från 2 till 812 dagar (medelvärde, 144 dagar; medianvärde, 68 dagar). Alla hundar fick minst 1 dos av PALLADIA.
b Utredarna tilldelade allvarlighetsgraden 1, 2, 3 eller 4 (1 – minst allvarlig; 4 – mest allvarlig).
c Gradering av laboratorieavvikelser baserades på National Cancer Institutes riktlinjer för Common Toxicity Criteria som anpassats för hundar (1 – minst allvarlig; 4 – mest allvarlig).
Andra biverkningar rapporterades men inträffade hos < 5% av hundarna. En enskild hund kan ha haft flera biverkningar.
Det förekom 5 dödsfall under denna studie som möjligen var läkemedelsrelaterade. Patologiska fynd visade i allmänhet tecken på vaskulär dysfunktion inklusive pulmonell tromboembolism (postoperativ); multiorgansvikt i samband med vaskulit och trombos; vaskulär trombos med disseminerad intravaskulär koagulopati (DIC) och pankreatit; och vaskulit med DIC. En hund dog sekundärt till magperforation; behandlingstiden med PALLADIA var 221 dagar och det fanns inga tecken på mastcellstumör vid obduktionen. Dessa dödsfall inträffade i närvaro eller frånvaro av grov sjukdom; behandlingstiden varierade från 18 till 221 dagar.
Sambandet mellan följande dödsfall och läkemedlet är okänt. En hund, som först behandlades i 3 veckor med placebo, dog av okänd orsak 7 dagar efter att PALLADIA-behandlingen inletts. En annan hund dog av okänd orsak 92 dagar efter att PALLADIA-behandlingen inletts. Ingen obduktion utfördes på någon av hundarna.
Tjugosju hundar utvecklade någon form av gastrointestinal blödning där 2,8 % av hundarna hade allvarliga blödningar. En hund utvecklade magsår som möjligen var läkemedelsrelaterat. Tre hundar dog av perforationer i magsäcken (1 hund) eller tolvfingertarmen (2 hundar) under studien. En hund med duodenalperforation fick endast 1 dos av studieläkemedlet och ansågs därför inte vara läkemedelsrelaterad.
Sju hundar utvecklade nasal depigmentering inom de första veckorna av behandlingen. Elva hundar utvecklade pälsfärgs- eller hudförändringar under studien. Två av dessa hundar hade fullständiga pälsfärgsförändringar från falurött till vitt och från djuprött till blont. Sju hundar drabbades av alopeci.
Det finns en läkemedelsrelaterad effekt på kroppsvikten: 20,0 % av hundarna hade >13 % viktminskning i den maskerade plus öppna fasen som kan tillskrivas läkemedlet. Av dessa hade 5 hundar >25 % viktminskning.
Tre hundar hade anfallsliknande aktivitet under behandling med studieläkemedel. Det kan inte fastställas om dessa var läkemedelsrelaterade.
Två hundar utvecklade epistaxis som inte var associerad med trombocytopeni. En annan hund utvecklade epistaxis med samtidig disseminerad intravaskulär koagulopati.
För en kopia av säkerhetsdatabladet (SDS) eller för att rapportera biverkningar ring Zoetis på 1-888-963-8471.
Information för hundägare:
Förmedla alltid klientinformationsbladet tillsammans med receptet och gå igenom med ägarna. Ägarna ska informeras om möjliga biverkningar och när de ska sluta med läkemedlet och ringa veterinären. Ägarna bör informeras om hanteringsanvisningarna.
Klinisk farmakologi
Aktionsmekanism: Toceranibfosfat är en liten molekyl som har både direkt antitumör- och antiangiogen aktivitet. I icke-kliniska farmakologiska studier hämmade toceranib selektivt tyrosinkinasaktiviteten hos flera medlemmar av den delade kinasreceptortyrosinkinasfamiljen (RTK), av vilka några är inblandade i tumörtillväxt, patologisk angiogenes och metastatisk progression av cancer. Toceranib hämmade aktiviteten hos Flk-1/KDR tyrosinkinas (receptorn för vaskulär endotelial tillväxtfaktor, VEGFR2), receptorn för trombocytavledd tillväxtfaktor (PDGFR) och receptorn för stamcellsfaktor (Kit) i både biokemiska och cellulära analyser. Toceranib har visat sig utöva en antiproliferativ effekt på endotelceller in vitro. Toceranibbehandling kan inducera cellcykelstopp och efterföljande apoptos i tumörcellinjer som uttrycker aktiverande mutationer i splitkinas-RTK, ckit. Tumörtillväxt av mastcellstumörer hos hundar drivs ofta av aktiverande mutationer i c-kit.1,2
Andra föreningar i klassen av antineoplastiska medel mot angiogenes är kända för att öka embryoletaliteten och fosterabnormaliteter. Eftersom angiogenes är en kritisk komponent i embryonal- och fosterutvecklingen bör hämning av angiogenes efter administrering av PALLADIA förväntas resultera i negativa effekter på graviditeten hos tiken.
Farmakokinetik
Efter intravenös administrering kännetecknas toceranibs farmakokinetik av en mycket stor distributionsvolym (>20 L/kg, vilket tyder på fördelning i vävnader), en terminal elimineringshalveringstid på cirka 16 timmar och ett clearance på >1 L/hr/kg. Med en regim av 3,25 mg fria basekvivalenter (fbe)/kg doser toceranib som administreras via tablett oralt varannan dag i 2 veckor (7 doser), visas de farmakokinetiska parametrarna för toceranib i plasma hos friska Beagle-hundar (mellan 7,2 – 12,5 kg) i tabellen nedan.
Tabell 5: Farmakokinetiska parametrar
|
Farmakokinetiska parametrar (medelvärde + 1SD) |
Total (n=11;6M, 5F) |
Total (n=10; 5M, 5F) |
|
Halveringstid för eliminering, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Tid till maximal plasmakoncentration, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Maximal plasmakoncentration, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Area under plasmakoncentrationens tidskurva, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Dosenormaliserat värde (justerat till 3.25 mg/kg dos)
b Cmin är koncentrationen vid 48 timmar efter dosering, vilket motsvarar dosintervallet.
Oral biotillgänglighet av toceranib är 77 %. PALLADIA är starkt proteinbundet till 91 % till 93 %.
Det bör noteras att trots homogeniteten hos de försökspersoner som ingick i denna studie observerades en stor variabilitet mellan försökspersonerna. Oavsett administreringsväg har linjär farmakokinetik observerats vid doser upp till 5 mg/kg två gånger dagligen. Med hjälp av ett in vitro-testsystem för hepatocyter och levermikrosomer visade det sig att Z-isomeren metaboliserades till N-oxidderivatet av toceranib hos hundar, människor, katter och råttor. Även om en liten könsskillnad observerades i in vitro-studien (81 % omvandling hos hanhundar, 56 % omvandling hos tikar) observerades inga skillnader i toceranibs farmakokinetik in vivo. Effekterna av nedsatt njurfunktion, nedsatt leverfunktion eller ras på toceranibs farmakokinetik har inte undersökts.
Effektivitet
Effektiviteten och säkerheten hos PALLADIA orala tabletter för behandling av mastcellstumörer utvärderades i en randomiserad, placebokontrollerad, dubbelmaskerad, multicenter klinisk fältstudie. Syftet med denna studie var att utvärdera effektiviteten och säkerheten hos PALLADIA vid behandling av mastcellstumörer hos hundar som hade återkommande mätbar sjukdom efter kirurgi och att utvärdera objektivt svar (fullständigt eller partiellt svar). PALLADIA-behandlingen jämfördes med placebobehandling med hjälp av svarsfrekvenser i slutet av den 6 veckor långa maskerade fasen. Svarsfrekvensen fastställdes med hjälp av National Cancer Institutes riktlinjer för responsutvärderingskriterier för solida tumörer3 som modifierades specifikt för utvärdering av mastcellstumörer hos hundar.
Etthundrafemtiotre hundar tilldelades slumpmässigt behandling med antingen 3,25 mg/kg PALLADIA (n = 88) eller placebo (n = 65) oralt, varannan dag i 6 veckor, eller till dess att sjukdomen progredierat eller studien avbrutits av annan orsak. Behandlingen avmaskerades vid tidpunkten för sjukdomsprogression: hundar som fick placebo erbjöds då övergång till öppen PALLADIA; hundar som fick PALLADIA avbröts från studien. Hundar måste ha Patnaik grad II eller III, återkommande, kutana mastcellstumörer med eller utan regional lymfkörtelpåverkan. Minst en tumör måste vara minst 20 mm i diameter. Hundar fick ha högst ett avslutat strålningsprotokoll och högst en tidigare systemisk kemoterapi. Hundar med tecken på systemisk mastcellstumör uteslöts. Behandling med systemiska kortikosteroider under studien eller inom 14 dagar före studiens början var inte tillåten. Om det behövdes för att hantera biverkningar ordinerades dosavbrott (upphörande av PALLADIA i upp till 2 veckor) och/eller doseringen minskades till så lågt som 2,2 mg/kg.
Effektivitetsanalysen visade en statistiskt signifikant fördel för PALLADIA jämfört med placebo i det primära effektmåttet objektivt svar i slutet av den sex veckor långa maskerade fasen. Objektivt svar är fullständigt svar + partiellt svar. Partiellt svar är ≥ 30 % minskning av summan av den längsta diametern av mållesioner, med utgångspunkt i summan vid baslinjen, icke-progression av icke-mållesioner och uppkomst av inga nya lesioner.
Mastcellstumör – Primärt effektmåttresultat
|
Effektivitetsparameter |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-.värde |
|
Objektiv svarsfrekvens * |
7.9% |
37.2% |
< 0.001 |
* Skillnaden i objektiv svarsfrekvens mellan grupperna var inte signifikant förknippad med tumörbörda (närvaro vs. avsaknad av regional lymfkörtelinblandning) eller tumörgrad (P > 0,05).
Under studien administrerades PALLADIA samtidigt med andra läkemedel såsom antimikrobiella läkemedel, H-2-receptorblockerare, antihistaminer, antiemetika, icke-steroida antiinflammatoriska läkemedel, lokalt verkande antiulcermediciner, opiatiska gastrointestinala motilitetsmodifierare, opioider, vacciner, anthelmintika, antiparasitära medel och topiska/oftalmiska/otiska kortikosteroidpreparat. Endast under den öppna fasen fick 5 hundar en kortvarig behandling med kortverkande kortikosteroider.
Djurens säkerhet:
I den säkerhetsstudie på måldjur som presenteras nedan visades PALLADIA ha en snäv säkerhetsmarginal; hundar som behandlas med PALLADIA bör övervakas för biverkningar som kan tyda på att en dosjustering är nödvändig. Två hundar i 6 mg/kg-gruppen avlivades på grund av kliniska toxiciteter dag 23 respektive 27 i studien.
Toceranib administrerades oralt till 20 vuxna Beagle-hundar av hankön och 20 vuxna Beagle-honor av honkön (cirka 2 år gamla) i doserna 0 mg/kg (placebo, 12 hundar), 2 mg/kg (0,5X, 8 hundar), 4 mg/kg (1X, 12 hundar) eller 6 mg/kg (1,5X, 8 hundar) en gång varannan dag i 13 på varandra följande veckor utan dosavbrott. Toceranib orsakade viktminskning, minskad foderkonsumtion, förändringar i bukspottkörteln, gonaderna, binjurarna, musklerna och hematopoetiska förändringar.
Foderkonsumtionen minskade i 6 mg/kg-gruppen jämfört med placebo, med den största skillnaden i medelvärde vid dag 35. Minskning av kroppsvikten i 4 mg/kg-gruppen sågs vid dag 31 och i 6 mg/kg-gruppen vid dag 15 jämfört med placebo och fortsatte under hela studien. Dosrelaterad hälta, som nästan uteslutande observerades i bakbenen, och smärta i extremiteterna var större i alla behandlingsgrupper jämfört med placebo, där 6 mg/kg-gruppen uppvisade den högsta förekomsten. Stelhet och svaghet noterades förekomma nästan uteslutande i 6 mg/kg-gruppen. Rödhet på munslemhinnan observerades i alla behandlingsgrupper. En hund i 4 mg/kg-gruppen hade ulcerationer i munnen och en hund i 6 mg/kg-gruppen hade hudulcerationer, båda med bakteriella infektioner närvarande. Diarré eller mjuk avföring sågs i alla fyra grupperna.
Hematologiska analyser visade minskningar av hematokrit, hemoglobin och erytrocytantal samt en minskning av retikulocytantalet i 4 och 6 mg/kg-grupperna som tenderade att återhämta sig tillräckligt för att begränsa ytterligare minskningar av erytrocytantalet. Antalet vita blodkroppar var signifikant lägre under hela studien i alla behandlade grupper jämfört med placebo, främst på grund av en minskning av neutrofiler. Lymfocyterna minskade i mindre utsträckning, särskilt vid den låga dosen. Eosinofiler och basofiler uppvisade markanta, ihållande minskningar. Monocyter påverkades inte.
Plättantalet ökade något i 4 och 6 mg/kg-grupperna. Ökningar observerades i fibrinogen i 4 och 6 mg/kg-gruppen.
Ökningar observerades i aspartataminotransferas, kreatinkinas och serumfosforkoncentrationer i 4 och 6 mg/kg-gruppen. Ökningar av alkaliskt fosfatas sågs i 6 mg/kg-gruppen. En ökning av amylas sågs hos en hund i var och en av behandlingsgrupperna. En ökning av serumkalium sågs hos en hund i 6 mg/kg-gruppen. Ökningar av laktatdehydrogenas och globuliner observerades i 6 mg/kg-gruppen.
Behandlingsrelaterade mikroskopiska förändringar inkluderade en lätt till markant minskning av cellulariteten i sternal och femoral benmärg. Det fanns en motsvarande mild extramedullär hematopoesi, huvudsakligen erytropoesi, i mjälten. I bukspottkörteln förekom dosrelaterad lätt till måttlig acinar degranulering, kännetecknad av diffus förlust av zymogengranuler. I binjurarna förekom minimal kortikal överbelastning/blödning vid alla doser, med ett suggestivt dosförhållande. Vakuolering av binjurebarken noterades med låg frekvens i alla grupper. Dosrelaterade förändringar noterades i reproduktionsorganen hos båda könen. Hos männen uppvisades en dosrelaterad utarmning av könsceller, tubulär vakuolering och minskningar av antalet mogna spermatozoer. Hos honor visade äggstockarna en minskad förekomst av mogna/regresserande corpora lutea och en ökad förekomst av små folliklar.
Två hundar (en hane, en hona) i 6 mg/kg-gruppen avlivades på grund av behandlingsrelaterade kliniska toxiciteter på dag 23 respektive 27 i studien. Start av det terminala syndromet sågs som markant minskat foderintag och melena. Under de följande 9 dagarna utvecklades det minskade foderintaget till nästan fullständig anorexi och hematochezia uppträdde. Viktförlust, slöhet, hälta och svaghet i bakbenen observerades. Följande kliniska patologiska resultat stämmer överens med de förändringar som sågs hos de andra hundarna i 6 mg/kg-gruppen samt förändringar som beror på hundarnas försvagade tillstånd strax före avlivning. Båda hundarna hade ökningar av totalprotein, globuliner, fosfor, kolesterol, triglycerider och fibrinogen. Den ena hunden hade pancytopeni, minskad hematokrit, hemoglobin, retikulocyter, albumin och PT samt ökade band. Hematuri förekom också. Den andra hunden hade också minskade lymfocyter, eosinofiler, klorid och natrium samt ökningar av RBC, hematokrit, hemoglobin, trombocyter, ALP, amylas, kreatinin, BUN, magnesium, kalium och totalt bilirubin. Koagulationsprofilen visade en minskad PT och ökad PTT hos båda hundarna. Dessa hundar uppvisade lymfoid utarmning i lymfkörtlar, thymus och tarmassocierade lymfatiska vävnader och milda till markerade gastrointestinala lesioner utöver de mikroskopiska fynd som beskrivs hos djur som överlevde till slutet av studien. Dessa två hundar hade också skador i mag-tarmkanalen, njurarna, bukspottkörteln, hypofysen och binjurarna.
Lagringsförhållanden: Förvaring: Förvaras vid kontrollerad rumstemperatur 20° till 25° C (68° till 77° F).
Som tillhandahålls
PALLADIA tabletter innehåller 10 mg, 15 mg eller 50 mg toceranib som toceranibfosfat per tablett. Tabletterna är förpackade i flaskor om 30 stycken.
1 London CA, Hannah AL, Zadovoskaya R, et al. Fas I doseskalerande studie av SU11654, en småmolekylär receptor tyrosinkinashämmare, hos hundar med spontana maligniteter. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured by: Pfizer Inc, Ascoli, Italien
Distribueras av: Zoetis Inc, Kalamazoo, MI 49007
Reviderad: Augusti 2015