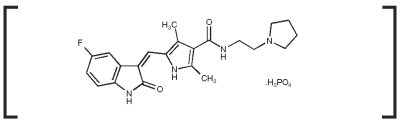
Palladia Käyttöaiheet
PALLADIA-tabletit on tarkoitettu Patnaik-luokan II tai III, toistuvien, ihonalaisten mastosolukasvainten hoitoon koirilla, joissa on tai ei ole mukana alueellisia imusolmukkeita.
ANNOSTELU JA KÄYTTÖÖNOTTO
Lähettäkää lääkemääräyksen mukana aina asiakastietolomake. Anna aloitusannos 3,25 mg/kg (1,48 mg/lb) ruumiinpainoa, suun kautta joka toinen päivä (ks. taulukko 1). Annoksen pienentämistä 0,5 mg/kg (minimiannokseen 2,2 mg/kg (1,0 mg/lb) joka toinen päivä) ja annoksen keskeyttämistä (PALLADIAn käytön lopettaminen enintään kahdeksi viikoksi) voidaan tarvittaessa käyttää haittavaikutusten hallitsemiseksi (ks. taulukko 2 sekä Varoitukset ja varotoimet). Säädä annosta noin viikoittaisten eläinlääkärin arvioiden perusteella ensimmäisten 6 viikon ajan ja sen jälkeen noin 6 viikon välein. PALLADIA voidaan antaa ruoan kanssa tai ilman ruokaa. Älä jaa tabletteja.
Taulukko 1. 3.25 mg/kg annostaulukko
|
Koiran ruumiinpaino |
Tablettien lukumäärä |
|||||
|
Kiloa |
Kiloa |
annos |
10 mg |
15 mg |
50 mg |
|
|
11.0 – 11.8 |
5.0 – 5.3 |
15 mg |
||||
|
11.9 – 15.2 |
5.4 – 6.9 |
20 mg |
||||
|
15.3 – 18.5 |
7.0 – 8.4 |
25 mg |
||||
|
18.6 – 22.0 |
8.5 – 10.0 |
30 mg |
||||
|
22.1 – 25.4 |
10.1 – 11.5 |
35 mg |
||||
|
25.5 – 28.7 |
11.6 – 13.0 |
40 mg |
||||
|
28.8 – 32.2 |
13.1 – 14.6 |
45 mg |
||||
|
32.3 – 35.5 |
14.7 – 16.1 |
50 mg |
||||
|
35.6 – 38.8 |
16.2 – 17.6 |
55 mg |
||||
|
38.9 – 42.3 |
17.7 – 19.2 |
60 mg |
||||
|
42.4 – 45.6 |
19.3 – 20.7 |
65 mg |
||||
|
45.7 – 50.1 – 26.9 |
80 mg |
|||||
|
59.4 – 65.9 |
27.0 – 29.9 |
95 mg |
||||
|
66.0 – 71.2 |
30.0 – 32.3 |
100 mg |
||||
|
71.3 – 76.3 |
32.4 – 34.6 |
110 mg |
||||
|
76.4 – 79.6 |
34.7 – 36.1 |
115 mg |
||||
|
79.7 – 84.7 |
36.2 – 38.4 |
120 mg |
||||
|
84.8 – 94.8 |
38.5 – 43.0 |
130 mg |
||||
|
94.9 – 105.0 |
43.1 – 47.6 |
150 mg |
||||
|
105.1 – 110.0 |
47.7 – 49.9 |
160 mg |
||||
|
110.1 – 113.5 |
50.0 – 51.5 |
165 mg |
||||
|
113.6 – 118.6 |
51.6 – 53.8 |
170 mg |
||||
|
118.7 – 128.8 |
53.9 – 58.4 |
180 mg |
||||
|
128.9 – 138.9 |
58.5 – 63.0 |
200 mg |
||||
|
139.0 – 144.0 |
63.1 – 65.3 |
210 mg |
||||
|
144.1 – 157.6 |
65.4 – 71.5 |
215 mg |
||||
|
157.7 – 173.1 |
71.6 – 78.5 |
250 mg |
||||
|
173.2 – 177.9 |
78.6 – 80.7 |
260 mg |
||||
|
178.0 – 191.6 |
80.8 – 86.9 |
265 mg |
||||
|
191.7 – 220.5 |
87.0 – 100.0 |
300 mg |
||||
TAULUKKO 2: Annoksen muuttaminen havaitun toksisuuden perusteella
|
Toksisuus |
annoksen mukauttaminen |
|
Uutropenia |
|
|
Neutropenia |
|
|
>1000/µl |
Pidetään annostaso |
|
≤1000/µl tai neutropeeninen kuume tai infektio |
Lääke lopetetaan, kunnes >1000/µl ja kliiniset oireet ovat normaalit; pienennä sitten annosta 0.5 mg/kg |
|
Munuaistoksisuus (kreatiniini) |
|
|
<2.0 mg/dl |
Pitäydy annostasolla |
|
≥2,0 mg/dl |
Pysäytä lääke, kunnes <2.0 mg/dl, vähennä sitten annosta 0,5 mg/kg |
|
Albumin |
|
|
<1,5 g/dl |
Lääke lopetetaan, kunnes >2.5 g/dl, vähennä sitten annosta 0,5 mg/kg |
|
Hematokriitti |
|
|
<26 % |
Pysäytä lääke, kunnes >30 %, vähennä sitten annosta 0.5 mg/kg |
|
Ripuli |
|
|
<4 vetistä ulostetta/vrk alle 2 vrk:n ajan |
Pidetään annostaso ja aloita tukihoito |
|
≥4 vetistä ulostetta/vrk tai ≥ 2 vrk |
Pysäytä lääkitys, kunnes muodostuu ulosteita ja aloita tukihoito. Kun annostelua jatketaan, pienennä annosta 0,5 mg/kg |
|
GI Verenvuoto |
|
|
Tuoretta verta ulosteessa tai mustaa tervamaista ulostetta > 2 vuorokauden ajan tai avointa verenvuotoa tai verihyytymiä ulosteessa. |
Pysäytä lääke ja aloita tukihoito, kunnes kaikki kliiniset merkit verestä ulosteessa ovat hävinneet, pienennä sitten annosta 0.5 mg/kg. |
Vasta-aiheet
Ei saa käyttää jalostukseen käytettäville koirille eikä tiineille tai imettäville nartuille (ks. Kliininen farmakologia).
Varoitukset
PALLADIA voi aiheuttaa verisuonten toimintahäiriöitä, jotka voivat johtaa turvotukseen ja tromboemboliaan, mukaan lukien keuhkoverisuonten tromboembolia. Lopeta lääkkeen käyttö, kunnes kliiniset oireet ja kliininen patologia ovat normalisoituneet. Verisuoniston homeostaasin varmistamiseksi odota vähintään 3 vuorokautta lääkkeen lopettamisen jälkeen ennen leikkauksen suorittamista (ks. Haittavaikutukset).
PALLADIAlla hoidetuilla koirilla on esiintynyt harvoin vakavia ja joskus kuolemaan johtaneita ruoansulatuskanavan komplikaatioita, mukaan lukien ruoansulatuskanavan perforaatio (ks. Haittavaikutukset). Jos ruoansulatuskanavan haavaumia epäillään, lopeta lääkkeen anto ja hoida asianmukaisesti.
Henkilökohtaiset varoitukset:
Ei saa käyttää ihmisillä. PIDÄ TÄMÄ JA KAIKKI LÄÄKKEET POISSA LASTEN ULOTTUVILTA. Lapset eivät saa joutua kosketuksiin PALLADIAn kanssa. Pidä lapset erossa hoidettujen koirien ulosteista, virtsasta tai oksennuksesta. Välttääksesi altistumisen lääkkeelle, pese kädet saippualla ja vedellä PALLADIAn antamisen jälkeen ja käytä suojakäsineitä, jotta vältät suoran kosketuksen ulosteeseen, virtsaan, oksennukseen ja rikkinäisiin tai kostutettuihin PALLADIA-tabletteihin. Laita kaikki jätemateriaalit muovipussiin ja sulje ennen yleistä hävittämistä. Jos silmät joutuvat vahingossa alttiiksi lääkkeelle, huuhtele silmät vedellä välittömästi. Jos henkilö on vahingossa niellyt lääkettä, hakeudu välittömästi lääkärin hoitoon, näytä pakkausseloste tai etiketti lääkärille. Ruoansulatuskanavan vaivoja, kuten oksentelua tai ripulia, voi esiintyä, jos tätä lääkettä niellään vahingossa.
Raskaana olevien naisten, naisten, jotka voivat tulla raskaaksi, tai imettävien äitien on kiinnitettävä erityistä huomiota näihin käsittelyä koskeviin varotoimiin. (Katso käsittelyohjeet edellä.) PALLADIA, kuten muutkin luokkansa lääkkeet, estää uusien verisuonten muodostumista kasvaimissa. Vastaavalla tavalla PALLADIA voi vaikuttaa verisuonten muodostumiseen kehittyvässä sikiössä ja voi vahingoittaa syntymätöntä lasta (aiheuttaa synnynnäisiä epämuodostumia). Raskaana oleville naisille PALLADIAn tahaton nauttiminen voi vaikuttaa haitallisesti raskauteen.
Varoitukset
PALLADIAn käyttö on keskeytettävä tilapäisesti, jos anemiaa, atsotemiaa, hypoalbuminemiaa ja hyperfosfatemiaa esiintyy samanaikaisesti. Jatka hoitoa pienentämällä annosta 0,5 mg/kg 1-2 viikon kuluttua, kun arvot ovat parantuneet ja albumiini on >2,5 g/dl. Hoidon tilapäinen keskeyttäminen voi olla tarpeen, jos jokin näistä esiintyy yksinään: hematokriitti <26 %, kreatiniini ≥2,0 mg/dl tai albumiini <1,5 g/dl. Jatka sitten hoitoa 0,5 mg/kg:n annosvähennyksellä, kun hematokriitti on >30 %, kreatiniini on <2,0 mg/dl ja albumiini on >2,5 g/dl.
Keskeytä PALLADIAn käyttö väliaikaisesti, jos neutrofiilien määrä on ≤1000/µl. Jatka hoitoa 1-2 viikon kuluttua annosta pienentämällä 0,5 mg/kg, kun neutrofiilien määrä on palautunut arvoon >1000/µl. Lisävähennyksiä voi olla tarpeen tehdä, jos vakava neutropenia uusiutuu.
Systeemisen syöttösolukasvaimen esiintyminen ennen hoitoa voi altistaa koiran kliinisesti merkittävälle syöttösolujen degranulaatiolle, johon voi liittyä vakavia systeemisiä haittavaikutuksia, kun koiraa hoidetaan PALLADIAlla. Systeeminen mastosytoosi on pyrittävä sulkemaan pois ennen PALLADIA-hoidon aloittamista.
PALLADIAan on liittynyt vakavaa ripulia tai ruoansulatuskanavan verenvuotoa, jotka vaativat pikaista hoitoa. Annoksen keskeyttäminen ja annoksen pienentäminen voi olla tarpeen kliinisten oireiden vakavuudesta riippuen. (Ks. taulukko 2 kohdassa Annostus ja antotapa.)
Käytä ei-steroidisia tulehduskipulääkkeitä varoen yhdessä PALLADIAn kanssa ruoansulatuskanavan haavauman tai perforaation lisääntyneen riskin vuoksi.
PALLADIA metaboloituu maksassa. PALLADIAn samanaikainen anto CYP3A4-perheen voimakkaiden estäjien kanssa saattaa suurentaa PALLADIA-pitoisuuksia. PALLADIAn metaboliaa mahdollisesti estävien samanaikaisten lääkkeiden vaikutusta ei ole arvioitu. Lääkkeiden yhteensopivuutta on seurattava potilailla, jotka tarvitsevat samanaikaista lääkitystä.
PALLADIAn turvallista käyttöä ei ole arvioitu alle 24 kuukauden ikäisille tai alle 5 kg painaville koirille.
Haittavaikutukset
Yhdysvaltalaisessa kliinisessä kenttätutkimuksessa, joka koostui 6 viikon maskeeratusta vaiheesta ja sitä seuranneesta avoimesta vaiheesta, arvioitiin PALLADIAn turvallisuutta ja tehoa 151:llä asiakkaan omistamalla koiralla, joilla oli Patnaikin asteen II tai III, toistuvia, ihon mastosolukasvaimia, joissa oli tai ei ollut alueellisia imusolmukkeita. Taulukossa 3 on yhteenveto peitetyn vaiheen aikana raportoiduista yleisimmistä haittavaikutuksista; koko tutkimuksen aikana (peitetty vaihe yhdistettynä avoimeen vaiheeseen) raportoiduista haittavaikutuksista on yhteenveto taulukossa 4.
Taulukko 3. Yhteenveto yleisimmistä haittavaikutuksista peitetyn vaiheen aikanaa
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Haittavaikutukset. Reaktio |
Jokainen aste |
Luokka 3 tai 4b |
Jokainen aste |
Luokka 3 tai 4b |
|
Ripuli |
||||
|
Ripuli |
26.6% |
3.1% |
46.0% |
6.9% |
|
Anoreksia |
31.3% |
6.3% |
39.1% |
6.9% |
|
Letargia |
29.7% |
3.1% |
35.6% |
4.2 % |
|
Lameus |
9.4 % |
0.0 % |
17.2 % |
0.0 % |
|
Painonpudotus |
3.1 % |
0.0 % |
14.9 % |
1.1 % |
|
Verta jakkarassa/ GI-verenvuoto/verenvuotoripuli |
3.1% |
0.0% |
12.6% |
2.3% |
|
Musculoskeletaalinen häiriö |
6.3% |
0.0% |
11.5% |
1.1% |
|
Dehydraatio |
4.7% |
0.0% |
9.2% |
2.0% |
|
Pruritus |
4.7% |
0.0% |
9.2 % |
0.0 % |
|
Takypnea |
4.0% |
0.0% |
||
|
Nausea |
3.1% |
0.0% |
8.0% |
1.1% |
|
Yleinen kipu |
4.7% |
1.6% |
6.9% |
0.0% |
|
Polydipsia |
7.8% |
0.0% |
6.9% |
0.0% |
|
Pyrexia |
3.1% |
0.0% |
5.7% |
2.3 % |
|
Flatulenssi |
3.1 % |
0.0 % |
5.7% |
0.0% |
|
Pigmentoitumishäiriö |
1.6% |
0.0% |
5.7% |
0.0 % |
|
Laboratorion poikkeavuus |
Mikä tahansa luokka |
Luokka 3 tai 4c |
Jokainen Gradec |
Luokka 3 tai 4c |
|
Neutropenia |
6.3% |
0.0% |
46.0% |
|
|
Lisääntynyt alaniiniaminotransferaasi |
21.9% |
4.7 % |
24.1 % |
1.1 % |
|
Hypoalbuminemia |
7.8 % |
0.0 % |
12.6 % |
0.0 % |
|
Vähentynyt hematokriitti |
7.8 % |
|||
|
Vähentyneenhematokriitti |
7.8 % |
|||
|
.0 % |
5.7 % |
3.4 % |
||
|
Hyperbilirubinemia |
1.6% |
1.6% |
5.7% |
0.0% |
|
Lisääntynyt kreatiniini |
4.7% |
0.0% |
5.7% |
0.0% |
|
Virtsatieinfektio |
1.6 % |
0.0 % |
5.7 % |
0.0 % |
a Keskimääräinen tutkimusaika naamioidun vaiheen aikana oli 37,0 vuorokautta PALLADIAa saaneilla koirilla (mediaani, 42.0 päivää) ja 27,6 päivää lumelääkkeellä hoidetuilla koirilla (mediaani, 21,0 päivää); tätä eroa ei korjattu tilastollisissa vertailuissa.
b Tutkijat antoivat vakavuusasteen 1, 2, 3 tai 4 (1 – vähiten vakava; 4 – vakavin).
c Laboratoriopoikkeavuuksien luokittelu perustui National Cancer Institute’s Common Toxicity Criteria -ohjeeseen, joka on mukautettu koiraeläimille (1 – vähiten vakava; 4 – vakavin).
Taulukko 4. Laboratoriotutkimusten tulokset. Yhteenveto yleisimmistä haittavaikutuksista tutkimuksen aikana (naamioitu vaihe yhdistettynä avoimeen-label-vaihe)a
|
PALLADIA (n = 145) a |
|||
|
Haittavaikutukset |
Mikä tahansa asteeb |
Aste 3 tai 4b |
|
|
Ripuli |
58.6 % |
8.3 % |
|
|
Anoreksia |
49.7% |
8.3% |
|
|
Yksentely |
47.6% |
9.7% |
|
|
Letargia |
39.3% |
4.8 % |
|
|
Verta ulosteessa/ GI-verenvuoto/hemorraginen ripuli |
18.6 % |
2.8 % |
|
|
Dehydraatio |
15.2 % |
2.1 % |
|
|
Pruritus |
12.4 % |
0.0 % |
|
|
Pigmentaatiohäiriö |
11.7% |
0.0% |
|
|
Dermatiitti |
11.0% |
0.0% |
|
|
Muskuloskeletaalinen häiriö |
11.0% |
0.0% |
|
|
Yleinen kipu |
8.3% |
0.0% |
|
|
Otitis externa |
8.3% |
0.0% |
|
|
Takypnea |
8.3% |
0.0% |
|
|
Nausea |
7.6% |
1.9 % |
2.8 % |
|
Niveltulehdus |
6.2 % |
0.0 % |
|
|
Lokalisoitunut ödeema |
|||
|
Lokaalinen turvotus |
0.0% |
||
|
Laboratorion poikkeavuus |
Mikä tahansa astec |
Luokka 3 tai 4c |
|
|
Neutropenia |
44.8 % |
1.4 % |
|
|
Hypoalbuminemia |
28.3 % |
1.4 % |
|
|
Trombosytopenia |
28.3 % |
2.1 % |
|
|
Lisääntynyt alaniiniaminotransferaasi |
27,6 % |
4.1 % |
|
|
Alentunut hematokriitti |
11,0 % |
2.0 % |
|
|
Virtsatieinfektio |
7,6 % |
0,0 % |
|
a PALLADIA-hoidon kesto vaihteli 2-812 vuorokautta (keskiarvo 144 vuorokautta; mediaani 68 vuorokautta). Kaikki koirat saivat vähintään yhden PALLADIA-annoksen.
b Tutkijat antoivat vakavuusasteen 1, 2, 3 tai 4 (1 – vähiten vakava; 4 – vakavin).
c Laboratoriopoikkeavuuksien luokittelu perustui National Cancer Institute’s Common Toxicity Criteria -ohjeistukseen, joka on mukautettu koiraeläimille soveltuvaksi (1 – vähiten vakava; 4 – vakavin).
Muita haittatapahtumia raportoitiin, mutta niitä esiintyi < 5 %:ssa koirista. Kullakin yksittäisellä koiralla saattoi olla useita haittatapahtumia.
Tässä tutkimuksessa oli 5 kuolemantapausta, jotka mahdollisesti liittyivät lääkkeeseen. Patologiset löydökset paljastivat yleensä viitteitä verisuonten toimintahäiriöstä, mukaan lukien keuhkotromboembolia (postoperatiivinen); monielinelinten vajaatoiminta, joka liittyi vaskuliittiin ja tromboosiin; verisuonitromboosi, johon liittyi disseminoitunut intravaskulaarinen hyytymiskoagulopatia (DIC) ja haimatulehdus; ja vaskuliitti, johon liittyi DIC. Yksi koira kuoli mahalaukun perforaation seurauksena; PALLADIA-hoidon kesto oli 221 päivää, eikä ruumiinavauksessa ollut viitteitä mastosolukasvaimesta. Nämä kuolemantapaukset tapahtuivat karkean sairauden esiintyessä tai puuttuessa; hoidon kesto vaihteli 18 ja 221 päivän välillä.
Seuraavien kuolemantapausten yhteyttä lääkkeeseen ei tiedetä. Yksi koira, jota hoidettiin ensin 3 viikon ajan lumelääkkeellä, kuoli tuntemattomasta syystä 7 päivää PALLADIA-hoidon aloittamisen jälkeen. Toinen koira kuoli tuntemattomasta syystä 92 päivää PALLADIA-hoidon aloittamisen jälkeen. Kummallekaan koiralle ei tehty ruumiinavausta.
27 koiralle kehittyi jonkinlainen ruoansulatuskanavan verenvuoto, ja 2,8 %:lla koirista oli vakava verenvuoto. Yhdelle koiralle kehittyi mahahaava, joka mahdollisesti liittyi lääkkeeseen. Kolme koiraa kuoli mahalaukun (1 koira) tai pohjukaissuolen (2 koiraa) puhkeamiseen tutkimuksen aikana. Yksi koira, jolla oli pohjukaissuolen perforaatio, sai vain yhden annoksen tutkimuslääkettä, eikä sitä siksi pidetty lääkkeeseen liittyvänä.
Seitsemälle koiralle kehittyi nenän depigmentaatio ensimmäisten hoitoviikkojen aikana. Yhdelletoista koiralle kehittyi turkin väri- tai ihomuutoksia tutkimuksen aikana. Kahdella näistä koirista turkin väri muuttui kokonaan fawnista valkoiseksi ja syvänpunaisesta vaaleaksi. Seitsemällä koiralla esiintyi hiustenlähtöä.
Lääkkeellä on lääkkeeseen liittyvä vaikutus ruumiinpainoon: 20,0 %:lla koirista oli >13 %:n painonpudotus naamioidussa ja avoimessa vaiheessa, joka johtui lääkkeestä. Näistä 5 koiralla oli >25 %:n painonlasku.
Kolme koiraa sai kouristuksia muistuttavaa toimintaa tutkimuslääkkeen käytön aikana. Ei voida määrittää, liittyivätkö nämä lääkkeeseen.
Kahdelle koiralle kehittyi epistaxis, joka ei liittynyt trombosytopeniaan. Toiselle koiralle kehittyi epistaxis, johon liittyi samanaikainen disseminoitunut intravaskulaarinen koagulopatia.
Kopiota käyttöturvallisuustiedotteesta (SDS) varten tai haittavaikutusten ilmoittamiseksi soita Zoetisille numeroon 1-888-963-8471.
Tietoa koiranomistajille:
Lähettäkää aina asiakastietolomake reseptin mukana ja käykää se läpi omistajien kanssa. Omistajille on kerrottava mahdollisista haittavaikutuksista ja siitä, milloin lääke on lopetettava ja soitettava eläinlääkärille. Omistajille on kerrottava käsittelyohjeet.
Kliininen farmakologia
Vaikutusmekanismi: Toceranibifosfaatti on pieni molekyyli, jolla on sekä suora kasvainvastainen että antiangiogeeninen vaikutus. Ei-kliinisissä farmakologisissa tutkimuksissa toseranibi esti selektiivisesti useiden jaetun reseptorityrosiinikinaasiperheen (RTK) useiden jäsenten tyrosiinikinaasiaktiivisuutta, joista osa on osallisena syövän kasvussa, patologisessa angiogeneesissä ja metastaattisessa etenemisessä. Toceranib esti Flk-1/KDR-tyrosiinikinaasin (verisuonten endoteelikasvutekijän reseptori, VEGFR2), verihiutaleista peräisin olevan kasvutekijän reseptorin (PDGFR) ja kantasolutekijän reseptorin (Kit) aktiivisuutta sekä biokemiallisissa että solumaisissa määrityksissä. Toceranibilla on osoitettu olevan antiproliferatiivinen vaikutus endoteelisoluihin in vitro. Toceranibihoito voi indusoida solusyklin pysähtymisen ja sitä seuraavan apoptoosin kasvainsolulinjoissa, jotka ilmentävät aktivoivia mutaatioita jaetussa kinaasi-RTK:ssa, ckitissä. Koiran syöttösolukasvainten kasvua ohjaavat usein c-kitin aktivoivat mutaatiot.1,2
Muut antineoplastisten aineiden antiangiogeneesiluokkaan kuuluvat yhdisteet lisäävät tunnetusti alkion kuolleisuutta ja sikiöpoikkeavuuksia. Koska angiogeneesi on kriittinen osa alkion ja sikiön kehitystä, angiogeneesin estämisen PALLADIAn antamisen jälkeen on odotettava johtavan haitallisiin vaikutuksiin nartun raskauteen.
Farmakokinetiikka
Venensisäisen annostelun jälkeen toseranibin farmakokinetiikalle on ominaista hyvin suuri jakautumistilavuus (>20 L/kg, mikä viittaa jakautumiseen kudoksiin), eliminaation terminaalinen puoliintumisaika on noin 16 tuntia ja puhdistuma >1 L/h/kg. Kun toseranibia annettiin 3,25 mg vapaata emäsekvivalenttia (fbe)/kg tabletteina suun kautta joka toinen päivä 2 viikon ajan (7 annosta), toseranibin farmakokineettiset parametrit plasmassa terveillä beagle-koirilla (välillä 7,2 – 12,5 kg) on esitetty alla olevassa taulukossa.
Taulukko 5: Farmakokineettiset parametrit
|
Farmakokineettiset parametrit (keskiarvo + 1SD) |
Total (n=11;6M, 5F) |
yhteensä (n=10; 5M, 5F) |
|
|
Eliminoitumisen puoliintumisaika, t1/2 (h) |
16.4 ± 3.6 |
17.2 ± 3.9 |
|
|
Aika maksimipitoisuuteen plasmassa, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.7 ± 6.0 |
18.7 ± 8.3 |
|
Plasmapitoisuuden aikakäyrän alapuolinen pinta-ala, AUC0-48 (ng-h/ml) a |
1833 ± 508 |
2635 ± 939 |
a Annosnormeerattu arvo (oikaistuna 3.25 mg/kg annos)
b Cmin on pitoisuus 48 h annoksen jälkeen, mikä vastaa annosväliä.
Toseranibin oraalinen hyötyosuus on 77 %. PALLADIA sitoutuu hyvin proteiineihin, 91-93 %.
On huomattava, että huolimatta tähän tutkimukseen osallistuneiden koehenkilöiden homogeenisuudesta havaittiin suurta koehenkilöiden välistä vaihtelua. Antotavasta riippumatta lineaarista farmakokinetiikkaa on havaittu annoksilla, jotka ovat enintään 5 mg/kg kahdesti vuorokaudessa. Käyttämällä in vitro -hepatosyytti- ja maksamikrosomitestijärjestelmää todettiin Z-isomeerin metaboloituvan toseranibin N-oksidijohdannaiseksi koirilla, ihmisillä, kissoilla ja rotilla. Vaikka in vitro -tutkimuksessa havaittiin pientä sukupuolieroa (uroskoirilla 81 %:n konversio, nartuilla 56 %:n konversio), toseranibin farmakokinetiikassa ei havaittu eroja in vivo. Munuaisten vajaatoiminnan, maksan vajaatoiminnan tai rodun vaikutusta toseranibin farmakokinetiikkaan ei ole tutkittu.
Tehokkuus
PALLADIA-oraalitablettien tehoa ja turvallisuutta syöttösolukasvainten hoidossa arvioitiin satunnaistetussa, lumekontrolloidussa, kaksoismaksukontrolloidussa, monikeskuksisessa kliinisessä kenttätutkimuksessa. Tämän tutkimuksen tarkoituksena oli arvioida PALLADIAn tehokkuutta ja turvallisuutta mastosolukasvainten hoidossa koirilla, joilla oli leikkauksen jälkeen uusiutunut mitattavissa oleva tauti, ja arvioida objektiivista vastetta (täydellinen tai osittainen vaste). PALLADIA-hoitoa verrattiin lumelääkehoitoon käyttämällä vasteosuuksia 6 viikon maskeeratun vaiheen lopussa. Vasteet määritettiin käyttäen National Cancer Institute’s Response Evaluation Criteria in Solid Tumors Guideline3 -ohjeistusta, joka oli muokattu erityisesti koirien syöttösolukasvainten arviointia varten.
Sataaviisikymmentäkolme koiraa satunnaistettiin saamaan joko 3,25 mg/kg PALLADIAa (n = 88) tai lumelääkettä (n = 65) suun kautta joka toinen päivä kuuden viikon ajan tai siihen asti, kunnes tauti eteni tai kunnes koira vetäytyi pois tutkimuksesta muusta syystä. Hoito lopetettiin, kun tauti eteni: lumelääkettä saaneille koirille tarjottiin sen jälkeen avointa PALLADIA-hoitoa; PALLADIAa saaneet koirat lopetettiin tutkimuksesta. Koirilla täytyi olla Patnaikin asteen II tai III, uusiutuva, ihon mastosolukasvain, jossa oli tai ei ollut alueellisia imusolmukkeita. Vähintään yhden kasvaimen halkaisijan oli oltava vähintään 20 mm. Koirilla sai olla enintään yksi suoritettu sädehoitoprotokolla ja enintään yksi aiempi systeeminen kemoterapiahoito. Koirat, joilla oli näyttöä systeemisestä mastosolukasvaimesta, suljettiin pois. Systeemistä kortikosteroidihoitoa ei sallittu tutkimuksen aikana tai 14 päivän kuluessa ennen tutkimuksen aloittamista. Tarvittaessa haittavaikutusten hallitsemiseksi määrättiin annoksen keskeyttämistä (PALLADIAn lopettaminen enintään kahdeksi viikoksi) ja/tai annosta pienennettiin jopa 2,2 mg/kg:aan.
Tehokkuusanalyysi osoitti PALLADIAn tilastollisesti merkitsevän edun lumelääkkeeseen verrattuna ensisijaisessa tehokkuuden päätetapahtumassa, joka oli objektiivinen vaste kuuden viikon maskeeratun vaiheen lopussa. Objektiivinen vaste on täydellinen vaste + osittainen vaste. Osittainen vaste on ≥ 30 %:n vähennys kohdeleesioiden pisimmän halkaisijan summassa, kun vertailukohtana pidetään lähtötilanteen summaa, muiden kuin kohdeleesioiden etenemättömyys ja uusien leesioiden puuttuminen.
Mastosolukasvain – Ensisijaisen vaikuttavuuden päätetapahtuman tulokset
|
vaikuttavuusparametri |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-arvo |
|
Objektiivinen vastausprosentti * |
7.9% |
37.2% |
< 0.001 |
* Ryhmien välinen ero objektiivisessa vasteosuudessa ei liittynyt merkitsevästi kasvaimen taakkaan (alueellisen imusolmukkeen osallistumisen esiintyminen vs. puuttuminen) tai kasvaimen asteeseen (P > 0,05).
Tutkimuksen aikana PALLADIAa annettiin samanaikaisesti muiden lääkkeiden, kuten mikrobilääkkeiden, H-2-reseptorin salpaajien, antihistamiinien, antiemeettisten lääkkeiden, steroideihin kuulumattomien tulehduskipulääkkeiden, paikallisesti vaikuttavien haavaumalääkkeiden, opiaattisten ruoansulatuskanavan motiliteettiä muuntavien lääkkeiden, opioidien, rokotteiden, matolääkkeiden, loislääkkeiden, parasiittien torjunta-aineiden ja paikallisesti käytettävien/silmäterveydellisten/otsalpaattisten kortikosteroidivalmisteiden, kanssa. Ainoastaan avoimen vaiheen aikana 5 koiraa sai lyhyen kuurin lyhytvaikutteisia kortikosteroideja.
Turvallisuus eläimille:
Alempana esitetyssä kohde-eläinten turvallisuustutkimuksessa PALLADIAlla osoitettiin olevan kapea turvallisuusmarginaali; PALLADIAlla hoidettavia koiria on seurattava sellaisten haittavaikutusten varalta, jotka voivat viitata annoksen säätämisen tarpeeseen. Kaksi koiraa 6 mg/kg ryhmässä lopetettiin kliinisten toksisuuksien vuoksi tutkimuksen päivinä 23 ja 27.
Toceranibia annettiin suun kautta 20 urokselle ja 20 nartulle aikuisille beagle-koirille (noin 2-vuotiaille) annoksina 0 mg/kg (lumelääke, 12 koiraa), 2 mg/kg (0,5X, 8 koiraa), 4 mg/kg (1X, 12 koiraa) tai 6 mg/kg (1,5X, 8 koiraa) kerran kahdessa eri vuorokaudessa 13:na peräkkäisenä viikkona ilman annostelukatkoa. Toceranib aiheutti painonpudotusta, vähentynyttä rehunkulutusta, haima-, sukurauhas-, lisämunuais-, lihas- ja verenkiertomuutoksia.
Rehunkulutus väheni 6 mg/kg:n ryhmässä lumelääkkeeseen verrattuna, suurimman keskiarvoeron esiintyessä päivänä 35. Ruumiinpainon vähenemistä havaittiin 4 mg/kg:n ryhmässä 31. päivänä ja 6 mg/kg:n ryhmässä 15. päivänä lumelääkkeeseen verrattuna, ja se jatkui koko tutkimuksen ajan. Annokseen liittyvää ontumista, jota havaittiin lähes yksinomaan takaraajoissa, ja raajakipua esiintyi enemmän kaikissa hoitoryhmissä lumelääkkeeseen verrattuna, ja eniten sitä esiintyi 6 mg/kg-ryhmässä. Jäykkyyttä ja heikkoutta todettiin esiintyvän lähes yksinomaan 6 mg/kg-ryhmässä. Kaikissa hoitoryhmissä havaittiin suun limakalvojen punoitusta. Yhdellä koiralla 4 mg/kg-ryhmässä oli suun haavaumia ja yhdellä koiralla 6 mg/kg-ryhmässä ihohaavaumia, molemmissa esiintyi bakteeri-infektioita. Kaikissa neljässä ryhmässä havaittiin ripulia tai pehmeää ulostetta.
Hematologiset analyysit osoittivat hematokriitin, hemoglobiinin ja erytrosyyttien lukumäärän vähenemistä sekä retikulosyyttien lukumäärän vähenemistä 4 ja 6 mg/kg-ryhmissä, jotka pyrkivät toipumaan riittävästi rajoittaakseen erytrosyyttien lukumäärän pienenemistä edelleen. Valkosolujen määrä laski merkittävästi koko tutkimuksen ajan kaikissa hoidetuissa ryhmissä lumelääkkeeseen verrattuna, mikä johtui pääasiassa neutrofiilien vähenemisestä. Lymfosyytit vähenivät vähäisemmässä määrin, erityisesti pienellä annoksella. Eosinofiilien ja basofiilien määrä väheni selvästi ja pysyvästi. Monosyytit eivät vaikuttaneet.
Hiutaleiden määrä kasvoi hieman 4 ja 6 mg/kg ryhmissä. Fibrinogeenin pitoisuudessa havaittiin nousua 4 ja 6 mg/kg:n ryhmässä.
Aspartaattiaminotransferaasin, kreatiinikinaasin ja seerumin fosforipitoisuuksien nousua havaittiin 4 ja 6 mg/kg:n ryhmissä. Alkalisen fosfataasin nousua havaittiin 6 mg/kg-ryhmässä. Amylaasin nousua havaittiin yhdellä koiralla kussakin hoitoryhmässä. Seerumin kaliumpitoisuuden nousua havaittiin yhdellä koiralla 6 mg/kg:n ryhmässä. Laktaattidehydrogenaasin ja globuliinien pitoisuuksien nousua havaittiin 6 mg/kg:n ryhmässä.
Hoitoon liittyviin mikroskooppisiin muutoksiin kuului rintalastan ja reisiluun luuytimen solujen vähäinen tai huomattava väheneminen. Vastaavasti pernassa oli lievää ekstramedullaarista hematopoieesia, pääasiassa erytropoieesia. Haimassa esiintyi annokseen liittyvää lievää tai kohtalaista akinaarista degranulaatiota, jolle oli ominaista zymogeenirakeiden diffuusi häviäminen. Lisämunuaisissa esiintyi kaikilla annoksilla vähäistä kortikaalista kongestiota/verenvuotoa, jolla oli viitteellinen annossuhde. Lisämunuaisen kuorikerroksen tyhjenemistä havaittiin harvoin kaikissa ryhmissä. Molempien sukupuolten sukuelimissä havaittiin annokseen liittyviä muutoksia. Miehillä havaittiin annokseen liittyvää sukusolujen vähenemistä, tubulaarista vakuolaatiota ja kypsien siittiöiden määrän vähenemistä. Naarailla munasarjoissa esiintyi vähemmän kypsiä/kehittymässä olevia keltarauhasia ja enemmän pieniä follikkeleita.
Kaksi koiraa (yksi uros ja yksi narttu) ryhmässä 6 mg/kg lopetettiin hoitoon liittyvien kliinisten toksisuuksien vuoksi tutkimuksen 23. ja 27. päivänä. Terminaalisen oireyhtymän alkaminen näkyi selvästi vähentyneenä rehun syönnin ja melenan esiintymisenä. Seuraavien 9 päivän aikana vähentynyt rehun syönti muuttui lähes täydelliseksi anoreksiaksi ja ilmeni hematochesiaa. Laihtumista, velttoutta, takaraajojen ontumista ja heikkoutta havaittiin. Seuraavat kliinisen patologian tulokset ovat yhdenmukaisia muissa 6 mg/kg:n ryhmän koirissa havaittujen muutosten kanssa sekä muutosten kanssa, jotka johtuivat koirien heikentyneestä tilasta juuri ennen eutanasiaa. Molemmilla koirilla kokonaisproteiinin, globuliinien, fosforin, kolesterolin, triglyseridien ja fibrinogeenin pitoisuudet kasvoivat. Toisella koiralla oli pansytopeniaa, hematokriitin, hemoglobiinin, retikulosyyttien, albumiinin ja PT:n vähenemistä sekä lisääntyneitä bändejä. Myös hematuriaa esiintyi. Toisella koiralla oli myös vähentyneitä lymfosyyttejä, eosinofiilejä, kloridia ja natriumia ja lisääntyneitä RBC:tä, hematokriittia, hemoglobiinia, verihiutaleita, ALP:tä, amylaasia, kreatiniinia, BUN:a, magnesiumia, kaliumia ja kokonaisbilirubiinia. Hyytymisprofiili osoitti PT:n laskua ja PTT:n nousua molemmilla koirilla. Näillä koirilla todettiin imusolmukkeiden, kateenkorvan ja suolistoon liittyvien imukudosten lymfaattisten kudosten lymfaattinen köyhtyminen ja lieviä tai selviä ruoansulatuskanavan vaurioita niiden mikroskooppisten löydösten lisäksi, jotka kuvattiin tutkimuksen loppuun asti elossa olleilla eläimillä. Näillä kahdella koiralla oli myös vaurioita ruoansulatuskanavassa, munuaisissa, haimassa, aivolisäkkeessä ja lisämunuaisissa.
Varastointiolosuhteet: Säilytä valvotussa huoneenlämmössä 20°-25° C (68°-77° F).
Miten valmistetaan
PALLADIA-tabletit sisältävät 10 mg, 15 mg tai 50 mg toseranibia toseranibifosfaattina tablettia kohti. Tabletit on pakattu 30 kappaleen pulloihin.
1 London CA, Hannah AL, Zadovoskaya R, et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured by: Pfizer Inc, Ascoli, Italia
Valmistanut: Pfizer Inc, Ascoli, Italia
Jakelija: Pfizer Inc, Ascoli, Italia: Zoetis Inc., Kalamazoo, MI 49007
Tarkistettu: Elokuu 2015