Palladia Indications
Les comprimés de PALLADIA sont indiqués pour le traitement des tumeurs mastocytaires cutanées de grade II ou III de Patnaik, récurrentes, avec ou sans atteinte ganglionnaire régionale chez le chien.
Dosage et administration
Toujours fournir la fiche de renseignements sur le client avec l’ordonnance. Administrer une dose initiale de 3,25 mg/kg (1,48 mg/lb) de poids corporel, par voie orale tous les deux jours (voir tableau 1). Des réductions de dose de 0,5 mg/kg (jusqu’à une dose minimale de 2,2 mg/kg (1,0 mg/lb) tous les deux jours) et des interruptions de dose (arrêt de PALLADIA pendant une période pouvant aller jusqu’à deux semaines) peuvent être utilisées, si nécessaire, pour gérer les effets indésirables (voir le tableau 2 ainsi que la rubrique Mises en garde et précautions). Ajuster la dose sur la base d’évaluations vétérinaires approximativement hebdomadaires pendant les 6 premières semaines, puis environ toutes les 6 semaines par la suite. PALLADIA peut être administré avec ou sans nourriture. Ne pas fractionner les comprimés.
Tableau 1. 3.Tableau des doses de 25 mg/kg
|
Poids corporel du chien |
Nombre de comprimés |
|||||
|
Livres |
Kilogrammes |
Dose |
10 mg |
15 mg |
50 mg |
|
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
||||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
||||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
||||
|
18.6 – 22,0 |
8,5 – 10,0 |
30 mg |
||||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
||||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
||||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
||||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
||||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
||||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
||||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
||||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
||||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
||||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
||||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
||||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
||||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
||||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
||||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
||||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
||||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
||||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
||||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
||||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
||||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
||||
|
139.0 – 144,0 |
63,1 – 65,3 |
210 mg |
||||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
||||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
||||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
||||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
||||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
||||
Tableau 2 : Modification de la dose en fonction de la toxicité observée
|
Toxicité |
Ajustement de la dose |
|
Neutropénie |
|
|
>1000/µL |
Maintien du niveau de dose |
|
≤1000/µL ou fièvre neutropénique ou infection |
Arrêter le médicament jusqu’à ce que >1000/µL et les signes cliniques soient normaux ; puis diminuer la dose de 0.5 mg/kg |
|
Toxicités rénales (créatinine) |
|
|
<2.0 mg/dL |
Maintien du niveau de dose |
|
≥2,0 mg/dL |
Arrêt du médicament jusqu’à <2.0 mg/dL puis diminuer la dose de 0,5 mg/kg |
|
Albumine |
|
|
<1,5 g/dL |
Arrêter le médicament jusqu’à >2.5 g/dL puis diminuer la dose de 0,5 mg/kg |
|
Hématocrite |
|
|
<26% |
Arrêter le traitement jusqu’à >30% puis diminuer la dose de 0.5 mg/kg |
|
Diarrhée |
|
|
<4 selles liquides/jour pendant moins de 2 jours |
Maintenir le niveau de dose et instituer des soins de soutien |
|
≥4 selles liquides/jour ou ≥ 2 jours |
Arrêter le médicament jusqu’à la formation de selles et instituer des soins de soutien. A la reprise du traitement, diminuer la dose de 0,5 mg/kg |
|
GI Saignement |
|
|
Sang frais dans les selles ou selles noires goudronneuses pendant > 2 jours ou hémorragie franche ou caillots sanguins dans les selles. |
Arrêter le médicament et instituer des soins de soutien jusqu’à la résolution de tous les signes cliniques de sang dans les selles, puis diminuer la dose de 0.5 mg/kg. |
Contra-indications
Ne pas utiliser chez les chiens utilisés pour la reproduction, ni chez les chiennes en gestation ou en lactation (voir Pharmacologie clinique).
Avertissements
PALLADIA peut provoquer un dysfonctionnement vasculaire pouvant entraîner un œdème et une thromboembolie, y compris une thromboembolie pulmonaire. Arrêter le traitement jusqu’à ce que les signes cliniques et la pathologie clinique se soient normalisés. Pour assurer l’homéostasie de la vascularisation, attendre au moins 3 jours après l’arrêt du médicament avant de pratiquer une intervention chirurgicale (voir rubrique Effets indésirables).
Des complications gastro-intestinales graves et parfois fatales, y compris une perforation gastro-intestinale, sont survenues rarement chez des chiens traités par PALLADIA (voir rubrique Effets indésirables). En cas de suspicion d’ulcération gastro-intestinale, arrêter l’administration du médicament et traiter de manière appropriée.
Mises en garde pour l’homme :
Non utilisable chez l’homme. GARDER CE MÉDICAMENT ET TOUS LES MÉDICAMENTS HORS DE LA PORTÉE DES ENFANTS. Les enfants ne doivent pas entrer en contact avec PALLADIA. Tenir les enfants à l’écart des excréments, de l’urine ou des vomissures des chiens traités. Pour éviter toute exposition au médicament, se laver les mains à l’eau et au savon après avoir administré PALLADIA et porter des gants de protection pour éviter tout contact direct avec les excréments, l’urine, le vomi et les comprimés de PALLADIA brisés ou humidifiés. Placez tous les déchets dans un sac en plastique et fermez le sac avant de les éliminer. En cas d’exposition accidentelle des yeux au médicament, rincez-les immédiatement à l’eau. En cas d’ingestion accidentelle par une personne, consulter immédiatement un médecin, lui montrer la notice ou l’étiquette. Des troubles gastro-intestinaux tels que des vomissements ou des diarrhées peuvent survenir en cas d’ingestion accidentelle de ce médicament.
Les femmes enceintes, les femmes susceptibles de le devenir ou les mères allaitantes doivent porter une attention particulière à ces précautions de manipulation. (Voir les instructions de manipulation ci-dessus.) PALLADIA, comme d’autres médicaments de sa classe, empêche la formation de nouveaux vaisseaux sanguins dans les tumeurs. De la même manière, PALLADIA peut affecter la formation des vaisseaux sanguins chez le ftus en développement et peut nuire au futur bébé (provoquer des malformations congénitales). Pour les femmes enceintes, l’ingestion accidentelle de PALLADIA peut avoir des effets indésirables sur la grossesse.
Précautions
Cesser immédiatement l’utilisation de PALLADIA si une anémie, une azotémie, une hypoalbuminémie et une hyperphosphatémie apparaissent simultanément. Reprendre le traitement en réduisant la dose de 0,5 mg/kg après 1 à 2 semaines lorsque les valeurs se sont améliorées et que l’albumine est >2,5 g/dl. Des interruptions temporaires du traitement peuvent être nécessaires si l’un des cas suivants survient seul : hématocrite <26%, créatinine ≥2,0 mg/dL ou albumine <1,5 g/dL. Puis reprendre le traitement en réduisant la dose de 0,5 mg/kg dès que l’hématocrite est >30%, la créatinine est <2,0 mg/dL et l’albumine est >2,5 g/dL.
Arrêter temporairement l’utilisation de PALLADIA si le nombre de neutrophiles est ≤1000/µL. Reprendre le traitement après 1 à 2 semaines à une réduction de dose de 0,5 mg/kg, lorsque le nombre de neutrophiles est revenu à >1000/µL. D’autres réductions de dose peuvent être nécessaires si une neutropénie sévère réapparaît.
La présence d’une tumeur mastocytaire systémique avant le traitement peut prédisposer un chien à une dégranulation mastocytaire cliniquement significative avec d’éventuelles réactions indésirables systémiques sévères lors du traitement par PALLADIA. Il faut essayer d’exclure une mastocytose systémique avant d’initier le traitement par PALLADIA.
PALLADIA a été associé à des diarrhées sévères ou des saignements gastro-intestinaux qui nécessitent un traitement rapide. Des interruptions et des réductions de dose peuvent être nécessaires en fonction de la sévérité des signes cliniques. (Voir le tableau 2 de la rubrique Posologie et mode d’administration.)
Utiliser avec prudence les anti-inflammatoires non stéroïdiens en association avec PALLADIA en raison d’un risque accru d’ulcération ou de perforation gastro-intestinale.
PALLADIA est métabolisé dans le foie. L’administration concomitante de PALLADIA avec des inhibiteurs puissants de la famille CYP3A4 peut augmenter les concentrations de PALLADIA. L’effet des médicaments concomitants pouvant inhiber le métabolisme de PALLADIA n’a pas été évalué. La compatibilité médicamenteuse doit être surveillée chez les patients nécessitant des médicaments concomitants.
La sécurité d’emploi de PALLADIA n’a pas été évaluée chez les chiens âgés de moins de 24 mois ou pesant moins de 5 kg.
Réactions indésirables
Une étude clinique américaine sur le terrain comprenant une phase masquée de 6 semaines, suivie d’une phase ouverte, a évalué la sécurité et l’efficacité de PALLADIA chez 151 chiens appartenant à des clients qui présentaient des tumeurs mastocytaires cutanées de grade II ou III de Patnaik, récurrentes, avec ou sans atteinte ganglionnaire régionale. Les réactions indésirables les plus fréquentes rapportées pendant la phase masquée sont résumées dans le tableau 3 ; celles rapportées pendant toute l’étude (phase masquée combinée à la phase ouverte) sont résumées dans le tableau 4.
Tableau 3. Résumé des effets indésirables les plus fréquents pendant la phase masquéea
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Effet indésirable. Réaction |
Tout gradeb |
Grade 3 ou 4b |
Tout gradeb |
Grade 3 ou 4b |
|
Diarrhée |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anorexie |
31,3% |
6.3% |
39,1% |
6,9% |
|
Léthargie |
29.7% |
3.1% |
35.6% |
4.6% |
|
Vomissements |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lampe |
9.4% |
0.0% |
17.2% |
0.0% |
|
Perte de poids |
3.1% |
0.0% |
14,9% |
1,1% |
|
Sang dans les selles/Saignement GI/diarrhée hémorragique |
3.1% |
0.0% |
12.6% |
2.3% |
|
Trouble musculo-squelettique |
6,3% |
0.0% |
11,5% |
1,1% |
|
Déshydratation |
4.7% |
0.0% |
9.2% |
2.3% |
|
Dermatite |
9,4% |
1,6% |
9,2% |
0.0% |
|
Prurit |
4,7% |
0,0% |
9.2% |
0,0% |
|
Tachypnée |
4.7% |
0,0% |
8,0% |
1,1% |
|
Douleur localisée |
4,7% |
0,0% |
8.0% |
0.0% |
|
Nausea |
3.1% |
0.0% |
8,0% |
1,1% |
|
Douleurs générales |
4.7% |
1,6% |
6,9% |
0,0% |
|
Polydipsie |
7,8% |
0.0% |
6,9% |
0,0% |
|
Pyrexie |
3.1% |
0.0% |
5.7% |
2.3% |
|
Flatulence |
3.1% |
0.0% |
5.7% |
0,0% |
|
Trouble de la pigmentation |
1.6% |
0.0% |
5.7% |
0.0% |
|
Anomalie de laboratoire |
Tout grade |
Grade 3 ou 4c |
Tout grade |
Grade 3 ou 4c |
|
Neutropénie |
6.3% |
0.0% |
46.0% |
0.0% |
|
Thrombocytopénie |
0.0% |
24.1% |
0.0% |
|
|
Augmentation de l’alanine aminotransférase |
21,9% |
4.7% |
24,1% |
1,1% |
|
Hypoalbuminémie |
7.8% |
0.0% |
12.6% |
0.0% |
|
Diminution de l’hématocrite |
7.8% |
0.0% |
5,7% |
3,4% |
|
Hyperbilirubinémie |
1.6% |
1.6% |
5.7% |
0.0% |
|
Augmentation de la créatinine |
4,7% |
0,0% |
5.7% |
0,0% |
|
Infection des voies urinaires |
1.6% |
0,0% |
5,7% |
0,0% |
a La durée moyenne de l’étude pendant la phase masquée était de 37,0 jours pour les chiens traités par PALLADIA (médiane, 42.0 jours) et 27,6 jours pour les chiens traités par placebo (médiane, 21,0 jours) ; aucun ajustement n’a été effectué dans les comparaisons statistiques pour cette disparité.
b Les investigateurs ont attribué un grade de sévérité de 1, 2, 3 ou 4 (1 – le moins sévère ; 4 – le plus sévère).
c Le classement des anomalies de laboratoire était basé sur la ligne directrice des critères communs de toxicité du National Cancer Institute adaptée aux chiens (1 – le moins grave ; 4 – le plus grave).
Tableau 4. Résumé des effets indésirables les plus fréquents au cours de l’étude (phase masquée combinée à la phase open-ouverte)a
|
PALLADIA (n = 145) a |
||
|
Réactions indésirables |
Tout gradeb |
Grade 3 ou 4b |
|
Diarrhée |
58.6% |
8,3% |
|
Anorexie |
49.7% |
8,3% |
|
Vomissements |
47.6% |
9.7% |
|
Léthargie |
39.3% |
4.1% |
|
La maigreur |
22,8% |
0,0% |
|
Perte de poids |
21,4% |
2.8% |
|
Sang dans les selles/Saignement GI/diarrhée hémorragique |
18.6% |
2,8% |
|
Déshydratation |
15,2% |
2.1% |
|
Prurit |
12,4% |
0,0% |
|
Trouble de la pigmentation |
11.7% |
0,0% |
|
Dermatite |
11.0% |
0.0% |
|
Trouble musculo-squelettique |
11.0% |
0.0% |
|
Douleurs générales |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0.0% |
|
Tachypnée |
8.3% |
0.0% |
|
Nausea |
7,6% |
1.4% |
|
Polydipsie |
7,6% |
0,0% |
|
Pyrexie |
6.9% |
2,8% |
|
Arthrite |
6,2% |
0,0% |
|
Oedème localisé |
6.2% |
0.0% |
|
Infection cutanée bactérienne |
5.5% |
0.0% |
|
Conjonctivite |
5.5% |
0.0% |
|
Anomalie de laboratoire |
Tout grade |
Grade 3 ou 4c |
|
Neutropénie |
44.8% |
1,4% |
|
Hypoalbuminémie |
28,3% |
1.4% |
|
Thrombocytopénie |
28,3% |
2.1% |
|
Augmentation de l’alanine aminotransférase |
27,6% |
4.1% |
|
Diminution de l’hématocrite |
11,0% |
2.8% |
|
Augmentation de la créatinine |
13,8% |
1,4% |
|
Hyperbilirubinémie |
6,9% |
0.0% |
|
Infection des voies urinaires |
7,6% |
0,0% |
a La durée du traitement par PALLADIA a varié de 2 à 812 jours (moyenne, 144 jours ; médiane, 68 jours). Tous les chiens ont reçu au moins une dose de PALLADIA.
b Les investigateurs ont attribué un grade de sévérité de 1, 2, 3 ou 4 (1 – le moins sévère ; 4 – le plus sévère).
c Le classement des anomalies de laboratoire était basé sur la directive Common Toxicity Criteria du National Cancer Institute adaptée aux chiens (1 – le moins sévère ; 4 – le plus sévère).
D’autres effets indésirables ont été rapportés mais sont survenus chez < 5% des chiens. Tout chien individuel peut avoir eu plusieurs événements indésirables.
Il y a eu 5 décès au cours de cette étude qui étaient probablement liés au médicament. Les résultats pathologiques ont généralement révélé des signes de dysfonctionnement vasculaire, notamment une thromboembolie pulmonaire (postopératoire) ; une défaillance de plusieurs organes associée à une vasculite et à une thrombose ; une thrombose vasculaire avec coagulopathie intravasculaire disséminée (CIVD) et pancréatite ; et une vasculite avec CIVD. Un chien est mort à la suite d’une perforation gastrique ; la durée du traitement par PALLADIA était de 221 jours et l’autopsie n’a révélé aucun signe de tumeur mastocytaire. Ces décès sont survenus en présence ou en l’absence de maladie macroscopique ; les durées de traitement allaient de 18 à 221 jours.
La relation entre les décès suivants et le médicament est inconnue. Un chien, d’abord traité pendant 3 semaines avec un placebo, est mort de cause inconnue 7 jours après le début du traitement par PALLADIA. Un autre chien est mort de cause inconnue 92 jours après le début du traitement par PALLADIA. Aucune autopsie n’a été réalisée chez ces deux chiens.
Vingt-sept chiens ont développé une forme d’hémorragie gastro-intestinale, 2,8 % des chiens présentant une hémorragie sévère. Un chien a développé une ulcération gastrique qui était peut-être liée au médicament. Trois chiens sont morts de perforations gastriques (1 chien) ou duodénales (2 chiens) pendant l’étude. Un chien ayant subi une perforation duodénale n’a reçu qu’une seule dose du médicament à l’étude et, par conséquent, n’a pas été considéré comme lié au médicament.
Sept chiens ont développé une dépigmentation nasale au cours des premières semaines de traitement. Onze chiens ont développé des changements de couleur du pelage ou de la peau au cours de l’étude. Deux de ces chiens ont eu des changements complets de la couleur du pelage, passant du fauve au blanc et du roux profond au blond. Sept chiens ont présenté une alopécie.
Il existe un effet lié au médicament sur le poids corporel : 20,0% des chiens ont présenté une perte de poids >13% dans la phase masquée plus ouverte attribuable au médicament. Parmi ceux-ci, 5 chiens ont eu une perte de poids de >25%.
Trois chiens ont eu une activité de type crise épileptique alors qu’ils étaient sous traitement. Il n’a pas été possible de déterminer si celles-ci étaient liées au médicament.
Deux chiens ont développé une épistaxis qui n’était pas associée à une thrombocytopénie. Un autre chien a développé une épistaxis avec une coagulopathie intravasculaire disséminée concomitante.
Pour obtenir une copie de la fiche de données de sécurité (FDS) ou pour signaler des événements indésirables, appelez Zoetis au 1-888-963-8471.
Information pour les propriétaires de chiens :
Toujours fournir la fiche d’information du client avec la prescription et la passer en revue avec les propriétaires. Les propriétaires doivent être informés des effets indésirables possibles et du moment où il faut arrêter le médicament et appeler le vétérinaire. Les propriétaires doivent être informés des instructions de manipulation.
Pharmacologie clinique
Mécanisme d’action : Le phosphate de toceranib est une petite molécule qui possède à la fois une activité antitumorale et antiangiogénique directe. Dans les études pharmacologiques non cliniques, le tocéranib a inhibé sélectivement l’activité tyrosine kinase de plusieurs membres de la famille des récepteurs tyrosine kinase (RTK) divisés, dont certains sont impliqués dans la croissance tumorale, l’angiogenèse pathologique et la progression métastatique du cancer. Le toceranib a inhibé l’activité de la tyrosine kinase Flk-1/KDR (récepteur du facteur de croissance endothélial vasculaire, VEGFR2), du récepteur du facteur de croissance dérivé des plaquettes (PDGFR) et du récepteur du facteur des cellules souches (Kit) dans des essais biochimiques et cellulaires. Il a été démontré que le toceranib exerce un effet antiprolifératif sur les cellules endothéliales in vitro. Le traitement par le toceranib peut induire un arrêt du cycle cellulaire et une apoptose subséquente dans les lignées cellulaires tumorales exprimant des mutations activatrices dans le RTK à kinase fractionnée, ckit. La croissance des tumeurs mastocs canines est fréquemment dirigée par des mutations activatrices dans c-kit.1,2
Les autres composés de la classe des agents antinéoplasiques antiangiogénèse sont connus pour augmenter l’embryolétalité et les anomalies fœtales. L’angiogenèse étant un élément essentiel du développement embryonnaire et fœtal, il faut s’attendre à ce que l’inhibition de l’angiogenèse après l’administration de PALLADIA entraîne des effets indésirables sur la grossesse de la chienne.
Pharmacocinétique
Après administration intraveineuse, la pharmacocinétique du tocéranib est caractérisée par un volume de distribution très important (>20 L/kg, indiquant une répartition dans les tissus), une demi-vie d’élimination terminale d’environ 16 heures et une clairance de >1 L/h/kg. Avec un régime de doses de 3,25 mg d’équivalent base libre (EBF)/kg de tocéranib administré par comprimé par voie orale tous les deux jours pendant 2 semaines (7 doses), les paramètres pharmacocinétiques du tocéranib dans le plasma chez des chiens Beagle en bonne santé (entre 7,2 et 12,5 kg) sont présentés dans le tableau ci-dessous.
Tableau 5 : Paramètres pharmacocinétiques
|
Paramètres pharmacocinétiques (moyenne + 1SD) |
Total (n=11 ;6M, 5F) |
Total (n=10 ; 5M, 5F) |
|
Demi-vie d’élimination, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Temps jusqu’à la concentration plasmatique maximale, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Concentration plasmatique maximale, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Aire sous la courbe temporelle de la concentration plasmatique, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Valeur normalisée en fonction de la dose (ajustée à 3.25 mg/kg dose)
b Cmin est la concentration à 48 h après la dose, qui correspond à l’intervalle de dose.
La biodisponibilité orale du tocéranib est de 77%. PALLADIA est fortement lié aux protéines avec 91 % à 93 %.
Il faut noter que malgré l’homogénéité des sujets inclus dans cette étude, une grande variabilité entre les sujets a été observée. Quelle que soit la voie d’administration, une pharmacocinétique linéaire a été observée à des doses allant jusqu’à 5 mg/kg deux fois par jour. En utilisant un système de test in vitro sur hépatocytes et microsomes hépatiques, on a constaté que l’isomère Z était métabolisé en dérivé N-oxyde du tocéranib chez les chiens, les humains, les chats et les rats. Bien qu’une petite différence entre les sexes ait été observée dans l’étude in vitro (81 % de conversion chez les chiens mâles, 56 % de conversion chez les chiens femelles), aucune différence dans la pharmacocinétique du tocéranib n’a été observée in vivo. Les effets de l’insuffisance rénale, de l’insuffisance hépatique ou de la race sur la pharmacocinétique du tocéranib n’ont pas été étudiés.
Efficacité
L’efficacité et la sécurité d’emploi de PALLADIA comprimés oraux pour le traitement des tumeurs mastocytaires ont été évaluées dans une étude clinique de terrain multicentrique, randomisée, contrôlée contre placebo et en double aveugle. Le but de cette étude était d’évaluer l’efficacité et la sécurité de PALLADIA dans le traitement des tumeurs à mastocytes chez les chiens présentant une maladie récurrente mesurable après chirurgie et d’évaluer la réponse objective (réponse complète ou partielle). Le traitement par PALLADIA a été comparé au traitement par placebo en utilisant les taux de réponse à la fin de la phase masquée de 6 semaines. Les taux de réponse ont été déterminés à l’aide des critères d’évaluation de la réponse dans les tumeurs solides du National Cancer Institute (National Cancer Institute’s Response Evaluation Criteria in Solid Tumors Guideline3) qui ont été modifiés spécifiquement pour l’évaluation des tumeurs mastocytaires canines.
Cinq cent cinquante-trois chiens ont été répartis au hasard pour recevoir un traitement par 3,25 mg/kg de PALLADIA (n = 88) ou un placebo (n = 65) par voie orale, tous les deux jours pendant 6 semaines, ou jusqu’à la progression de la maladie ou le retrait de l’étude pour une autre cause. Le traitement a été démasqué au moment de la progression de la maladie : les chiens recevant le placebo se sont vus proposer le passage à PALLADIA en ouvert ; les chiens recevant PALLADIA ont été retirés de l’étude. Les chiens devaient présenter des tumeurs mastocytaires cutanées récurrentes de grade II ou III selon Patnaik, avec ou sans atteinte des ganglions lymphatiques régionaux. Au moins une tumeur devait avoir un diamètre d’au moins 20 mm. Les chiens ne devaient pas avoir subi plus d’un protocole de radiothérapie et plus d’un régime de chimiothérapie systémique. Les chiens présentant des signes de tumeur mastocytaire systémique étaient exclus. Le traitement par corticostéroïdes systémiques pendant l’étude ou dans les 14 jours précédant le début de l’étude n’était pas autorisé. Si nécessaire pour gérer les effets indésirables, des interruptions de dose (arrêt de PALLADIA jusqu’à 2 semaines) ont été prescrites et/ou la posologie a été réduite jusqu’à 2,2 mg/kg.
L’analyse d’efficacité a montré un avantage statistiquement significatif pour PALLADIA par rapport au placebo dans le critère d’efficacité primaire de la réponse objective à la fin de la phase masquée de six semaines. La réponse objective correspond à une réponse complète + une réponse partielle. La réponse partielle est une diminution ≥ 30% de la somme du plus long diamètre des lésions cibles, en prenant comme référence la somme de base, la non progression des lésions non cibles et l’apparition d’aucune nouvelle lésion.
Tumeur à cellules mastocs – Résultats du critère primaire d’efficacité
|
Paramètre d’efficacité |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-value |
|
Taux de réponse objective * |
7.9% |
37.2% |
< 0.001 |
* La différence de taux de réponse objective entre les groupes n’était pas significativement associée à la charge tumorale (présence vs absence d’atteinte ganglionnaire régionale) ou au grade de la tumeur (P > 0,05).
Pendant l’étude, PALLADIA a été administré de manière concomitante avec d’autres médicaments tels que des antimicrobiens, des bloqueurs de récepteurs H-2, des antihistaminiques, des antiémétiques, des anti-inflammatoires non stéroïdiens, des anti-ulcéreux à action locale, des modificateurs de la motilité gastro-intestinale opiacés, des opioïdes, des vaccins, des anthelmintiques, des antiparasitaires et des préparations corticostéroïdes topiques/ophtalmiques/otiques. Au cours de la phase ouverte uniquement, 5 chiens ont reçu une brève cure de corticostéroïdes à action brève.
Sécurité animale :
Dans l’étude de sécurité animale cible présentée ci-dessous, il a été démontré que PALLADIA avait une marge de sécurité étroite ; les chiens traités par PALLADIA doivent être surveillés pour détecter les effets indésirables qui peuvent indiquer qu’un ajustement de la dose est nécessaire. Deux chiens du groupe 6 mg/kg ont été euthanasiés pour des toxicités cliniques aux jours 23 et 27 de l’étude, respectivement.
Le toceranib a été administré par voie orale à 20 chiens Beagle adultes mâles et 20 femelles (âgés d’environ 2 ans) à des doses de 0 mg/kg (placebo, 12 chiens), 2 mg/kg (0,5X, 8 chiens), 4 mg/kg (1X, 12 chiens) ou 6 mg/kg (1,5X, 8 chiens) une fois tous les deux jours pendant 13 semaines consécutives sans interruption de dose. Le toceranib a entraîné une perte de poids, une diminution de la consommation alimentaire, des modifications pancréatiques, gonadiques, surrénaliennes, musculaires et hématopoïétiques.
La consommation alimentaire a diminué dans le groupe 6 mg/kg par rapport au placebo, la plus grande différence de moyenne étant observée au jour 35. Une diminution du poids corporel dans le groupe 4 mg/kg a été observée au jour 31 et dans le groupe 6 mg/kg au jour 15 par rapport au placebo et s’est poursuivie tout au long de l’étude. La boiterie liée à la dose, observée presque exclusivement dans les membres postérieurs, et la douleur des membres étaient plus importantes dans tous les groupes de traitement par rapport au placebo, le groupe 6 mg/kg présentant l’incidence la plus élevée. La raideur et la faiblesse ont été observées presque exclusivement dans le groupe 6 mg/kg. Une rougeur de la muqueuse buccale a été observée dans tous les groupes de traitement. Un chien du groupe traité à la dose de 4 mg/kg a présenté des ulcérations buccales et un chien du groupe traité à la dose de 6 mg/kg a présenté des ulcérations cutanées, les deux cas présentant des infections bactériennes. Des diarrhées ou des selles molles ont été observées dans les quatre groupes.
Les analyses hématologiques ont montré des diminutions de l’hématocrite, de l’hémoglobine et de la numération érythrocytaire et une diminution de la numération des réticulocytes dans les groupes 4 et 6 mg/kg qui ont eu tendance à se rétablir suffisamment pour limiter les diminutions supplémentaires de la numération érythrocytaire. Le nombre de globules blancs a été significativement plus faible tout au long de l’étude dans tous les groupes traités par rapport au placebo, principalement en raison d’une diminution des neutrophiles. Les lymphocytes ont diminué à un degré moindre, surtout à la faible dose. Les éosinophiles et les basophiles ont présenté des diminutions marquées et persistantes. Les monocytes n’ont pas été affectés.
La numération plaquettaire a légèrement augmenté dans les groupes à 4 et 6 mg/kg. Des augmentations ont été observées dans le fibrinogène dans le groupe 4 et 6 mg/kg.
Des augmentations ont été observées dans les concentrations d’aspartate aminotransférase, de créatine kinase et de phosphore sérique dans les groupes 4 et 6 mg/kg. Une augmentation de la phosphatase alcaline a été observée dans le groupe de 6 mg/kg. Une augmentation de l’amylase a été observée chez un chien dans chacun des groupes de traitement. Une augmentation du potassium sérique a été observée chez un chien du groupe ayant reçu 6 mg/kg. Des augmentations de la lactate déshydrogénase et des globulines ont été observées dans le groupe 6 mg/kg.
Les changements microscopiques liés au traitement comprenaient une réduction légère à marquée de la cellularité de la moelle osseuse sternale et fémorale. Il y avait une légère hématopoïèse extramédullaire correspondante, principalement une érythropoïèse, dans la rate. Dans le pancréas, une dégranulation acinaire légère à modérée liée à la dose, caractérisée par une perte diffuse de granules de zymogène, s’est produite. Dans les glandes surrénales, une congestion ou une hémorragie corticale minime s’est produite à toutes les doses, avec une relation suggestive avec la dose. Une vacuolisation corticale des glandes surrénales a été notée avec une faible fréquence dans tous les groupes. Des changements liés à la dose ont été notés dans les organes reproducteurs des deux sexes. Les mâles ont présenté une déplétion des cellules germinales, une vacuolisation tubulaire et une réduction du nombre de spermatozoïdes matures liées à la dose. Chez les femelles, les ovaires ont présenté une incidence réduite de corps jaunes matures/en régression et une incidence accrue de petits follicules.
Deux chiens (un mâle, une femelle) du groupe 6 mg/kg ont été euthanasiés pour des toxicités cliniques liées au traitement, respectivement aux jours 23 et 27 de l’étude. L’apparition du syndrome terminal s’est traduite par une diminution marquée de la prise alimentaire et un méléna. Au cours des 9 jours suivants, la diminution de la prise alimentaire a évolué vers une anorexie quasi-complète et une hématochézie est apparue. Une perte de poids, une léthargie, une boiterie et une faiblesse des membres postérieurs ont été observées. Les résultats de pathologie clinique suivants correspondent aux changements observés chez les autres chiens du groupe traité à la dose de 6 mg/kg, ainsi qu’aux changements dus à l’état de faiblesse des chiens juste avant leur euthanasie. Les deux chiens ont présenté une augmentation des protéines totales, des globulines, du phosphore, du cholestérol, des triglycérides et du fibrinogène. Un chien présentait une pancytopénie, une diminution de l’hématocrite, de l’hémoglobine, des réticulocytes, de l’albumine et du TP et une augmentation des bandes. Une hématurie était également présente. L’autre chien présentait également une diminution des lymphocytes, des éosinophiles, du chlorure et du sodium et une augmentation des GR, de l’hématocrite, de l’hémoglobine, des plaquettes, de l’ALP, de l’amylase, de la créatinine, de l’azote uréique sanguin, du magnésium, du potassium et de la bilirubine totale. Le profil de coagulation a montré une diminution du temps de Quick et une augmentation du PTT chez les deux chiens. Ces chiens présentaient une déplétion lymphoïde dans les ganglions lymphatiques, le thymus et les tissus lymphatiques associés à l’intestin, ainsi que des lésions gastro-intestinales légères à marquées, en plus des résultats microscopiques décrits chez les animaux ayant survécu jusqu’à la fin de l’étude. Ces deux chiens présentaient également des lésions du tractus gastro-intestinal, des reins, du pancréas, de l’hypophyse et des glandes surrénales.
Conditions de stockage : Conserver à température ambiante contrôlée de 20° à 25° C (68° à 77° F).
Comment se présenter
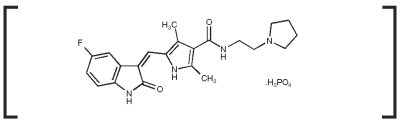
Les comprimés de PALLADIA contiennent 10 mg, 15 mg ou 50 mg de tocéranib sous forme de phosphate de tocéranib par comprimé. Les comprimés sont conditionnés dans des flacons de 30 unités.
1 London CA, Hannah AL, Zadovoskaya R, et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768 ; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654 : Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734 ; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, approuvé par la FDA
Fabriqué par : Pfizer Inc, Ascoli, Italie
Distribué par : Zoetis Inc, Kalamazoo, MI 49007
Révisé : Août 2015