Télécharger ce numéro Retour au sommaire
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
L’ablation au laser endoveineux (EVLA) est une alternative moins invasive au stripping veineux. Les résultats semblent égaux, voire supérieurs, à ceux du stripping, avec de meilleurs scores de qualité de vie en période postopératoire. Il a été démontré que l’ablation endoveineuse corrige ou améliore de manière significative les anomalies hémodynamiques chez les patients souffrant d’insuffisance veineuse chronique (IVC) avec reflux veineux superficiel. Les premiers rapports suggèrent que les techniques d’ablation endoveineuse, contrairement au stripping chirurgical, sont associées à une faible incidence de néovascularisation.
Une variété de longueurs d’onde est utilisée pour réaliser l’EVLA. Alors que le chromophore initial est l’eau ou l’hémoglobine, selon la longueur d’onde utilisée, le carbone semble être un chromophore secondaire mais clé qui est probablement indépendant de la longueur d’onde.
L’application des principes de l’anesthésie tumescente aux traitements veineux, ainsi que le développement des techniques d’ablation endoveineuse, offrent la possibilité de traiter la grande majorité des patients atteints de varices en cabinet sans anesthésie générale ni incision chirurgicale, tout en maximisant les résultats et en minimisant les récidives.
INTRODUCTION
Le reflux de la veine saphène est l’anomalie primaire sous-jacente dans la majorité des cas d’insuffisance veineuse superficielle. Ainsi, les approches pour traiter la jonction saphéno-fémorale et l’incompétence tronculaire saphène ont dominé la réflexion des phlébologues. Dans les années 1890, Trendelenburg a décrit la ligature de la jonction saphéno-fémorale seule, sans stripping de la veine saphène incompétente. Les avantages de la ligature seule par rapport à la ligature et au stripping, qui sont encore vantés aujourd’hui,1 comprennent la préservation du tronc saphène pour une éventuelle utilisation future comme greffon de pontage2 et l’évitement de la lésion du nerf saphène.3 La ligature haute en elle-même est moins invasive, plus rapide et plus simple à réaliser, et associée à une récupération plus facile par rapport au stripping veineux. S’il est vrai qu’elle « épargne » systématiquement le tronc saphène,4 l’utilisation d’une veine saphène malade comme conduit a été associée à un risque accru d’échec de la greffe.5 Plus important encore, il n’y a plus de doute que la ligature haute seule entraîne habituellement un reflux persistant dans le tronc saphène.6,7 La récurrence des varices est significativement réduite7-9 et le taux de réopération est de 60% à 70% inférieur si la veine saphène est strippée par rapport à la ligature seule.10,11 De plus, après la ligature seule, une récurrence ou une communication résiduelle avec la jonction dans l’aine a été trouvée chez 80 % des patients, tandis que 34 % d’entre eux présentaient également une incompétence de la perforation de la cuisse via la grande veine saphène (VGS) non dénudée.12 Comme l’a conclu Neglen, le dénudage de la VGS de la cuisse est essentiel pour minimiser la récurrence causée par le redéveloppement de la communication incompétente avec la confluence saphène-fémorale et par l’incompétence de la perforation de la cuisse.13 En d’autres termes, les inconvénients de la ligature seule l’emportent sur ses avantages.
Il est important de noter que la récidive est fréquente même après la ligature et le stripping de la veine saphène. Si une chirurgie inadéquate de la jonction saphéno-fémorale et la progression de la maladie sont des mécanismes qui expliquent certains cas de récidive, un autre mécanisme important est la néovascularisation autour de la jonction après une chirurgie veineuse.11,14 En fait, la néovascularisation a été signalée comme la principale cause de récidive,9 les canaux néovasculaires de taille, nombre et tortuosité variables étant responsables du reflux vers les varicosités récurrentes dans la majorité des cas.15 Bien que certains aient exprimé des doutes quant à la véracité d’une véritable néovascularisation, il existe des preuves histologiques claires que la néovascularisation est une cause de varices récurrentes.16 Les premiers rapports suggèrent, en revanche, que les techniques d’ablation endoveineuse sont associées à une très faible incidence de néovascularisation. 17 Il se peut que le développement de la néovascularisation soit largement prévenu en évitant la dissection de l’aine et en préservant le drainage veineux dans les affluents jonctionnels normaux.18,19
EVLA, comme l’ablation par radiofréquence et la sclérothérapie à la mousse, est une alternative moins invasive au stripping des veines. L’EVLA est indiqué chez un patient ambulatoire présentant un reflux de la grande, petite ou accessoire saphène avec des varices de surface et/ou des symptômes ou complications liés à une insuffisance veineuse superficielle. L’EVLA est couramment réalisée sous anesthésie locale diluée, avec ou sans anxiolytiques oraux supplémentaires, en cabinet. La durée de la procédure, qui est généralement de 30 à 60 minutes, dépend de la longueur du segment traité, de l’expérience de l’opérateur et de la réalisation éventuelle de procédures auxiliaires, telles que la phlébectomie ambulatoire. Indépendamment de la façon dont l’incompétence saphène sous-jacente est traitée, des traitements auxiliaires sont généralement nécessaires pour traiter les varices résiduelles (Figure 1).
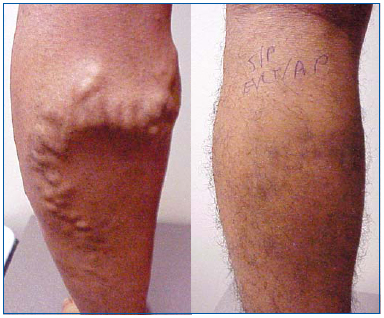
Figure 1. Homme de 26 ans avant et 1 mois après ablation au laser endoveineux de la grande veine saphène et phlébectomie ambulatoire des varices tributaires.
EFFICACITÉ
Les études à court et moyen terme de l’EVLA, quelle que soit la longueur d’onde utilisée, semblent remarquablement cohérentes, rapportant généralement l’ablation des veines saphènes refluantes dans 90% ou plus des cas.18,20-23 Il a été démontré que l’EVLA de la veine saphène corrige ou améliore significativement l’anomalie hémodynamique et les symptômes cliniques de l’insuffisance veineuse chronique (IVC) chez les patients de la classe clinique 3-6 Clinical, Etiological, Anatomical, Pathophysiological (CEAP) présentant un reflux veineux superficiel.24,25 Les résultats semblent égaux ou supérieurs à ceux du stripping, avec de meilleurs scores de qualité de vie dans la période postopératoire par rapport au stripping.20,25-27 Des taux élevés de satisfaction des patients ont été rapportés.18,28,29 Le coût total (coût de la procédure plus coût sociétal) des procédures endoveineuses est probablement égal ou inférieur à celui de la chirurgie.27
Les premières données sur le traitement du GSV avec des dispositifs de 810 nm et 940 nm suggèrent que l’échec du traitement est rare chez les patients traités avec > 70 J/cm.30,31 Un taux de retrait de 2 mm/sec à 14 watts délivre 70 J/cm.
MÉCANISME D’ACTION
Les longueurs d’onde suivantes sont actuellement utilisées pour l’EVLA : 810, 940, 980, 1064, 1319, 1320 et 2068 nm. Il a été postulé que les lésions de la paroi veineuse sont médiées à la fois par un effet direct et indirectement par la vapeur induite par le laser générée par le chauffage de petites quantités de sang dans la veine.32 Certains ont suggéré que le choix de la longueur d’onde a un impact important sur les résultats.23
Le principal chromophore des lasers de 1320 et 2078 nm, du moins initialement, est l’eau, tandis que les autres longueurs d’onde utilisées pour l’EVLA ciblent principalement l’hémoglobine. De toute évidence, il est impératif d’endommager thermiquement la paroi de la veine de manière adéquate afin d’obtenir une ablation efficace. Un certain réchauffement peut se produire par absorption directe de l’énergie photonique (rayonnement) par la paroi de la veine, ainsi que par convection des bulles de vapeur et par conduction du sang chauffé. Cependant, il est peu probable que ces derniers mécanismes représentent la majorité de l’impact sur la veine. La température maximale du sang est de 100°C. On a constaté que le traitement au laser produisait une carbonisation de la paroi veineuse.33 La carbonisation de l’extrémité du laser, qui se produit à environ 300°C, est notée après l’EVLA, et semble se produire quelle que soit la longueur d’onde utilisée.34 La carbonisation de l’extrémité de la fibre laser crée une source de chaleur ponctuelle et réduit essentiellement à zéro la pénétration de la lumière dans les tissus.34,35 Mordon et al ont déclaré : « La vapeur produite par l’absorption de l’énergie laser par le sang est une fraction minuscule de l’énergie nécessaire pour endommager la paroi veineuse et ne peut pas être le principal mécanisme de blessure de la veine avec le laser endoveineux. La carbonisation et le tractus à l’intérieur des parois veineuses observés par histologie après un laser endoveineux ne peuvent être que le résultat d’un contact direct entre l’extrémité de la fibre laser et la paroi veineuse.36 Le Dr Rox Anderson, directeur du Wellman Center for Photomedicine au Massachusetts General Hospital, a signalé que le carbone semble être un chromophore secondaire mais clé qui est probablement indépendant de la longueur d’onde (Figure 2).34 Notez que l’extrémité et la forme de la fibre peuvent avoir un impact sur le développement de la carbonisation.37

Figure 2. Carbonisation de l’extrémité d’une fibre laser de 600 microns secondaire à une ablation laser endoveineuse avec un laser de 1320 nm (Photo courtoisie de Mark Forrestal, MD, FACPh).
ANESTHÈSE TUMESCENTE
L’EVLA doit être réalisée sous anesthésie locale en utilisant de grands volumes d’une solution diluée de lidocaïne et d’épinéphrine (volume moyen de 200 à 400 ml de lidocaïne à 0,1 % avec de l’épinéphrine au 1:1 000 000) qui est tamponnée avec du bicarbonate de sodium. Cette solution doit être délivrée soit manuellement, soit à l’aide d’une pompe à perfusion sous guidage échographique, de sorte que la veine soit entourée du liquide anesthésique sur toute la longueur du segment à traiter (figure 3).
Les avantages de l’anesthésie tumescente pour l’ablation endoveineuse comprennent :
– l’anesthésie,
– la séparation de la veine à traiter des structures environnantes,
– le puits thermique, qui réduit les pics de température dans les tissus périveineux,
– la compression de la veine, qui maximise l’effet du traitement sur la paroi veineuse.
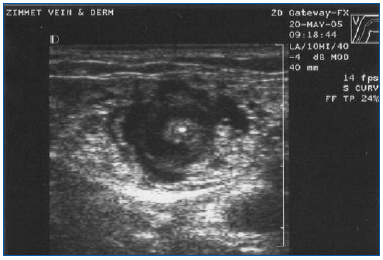
Figure 3. Image échographique transversale du liquide anesthésique tumescent entourant la grande veine saphène située au centre et la fibre/gaine laser.
Bien que la dose maximale sûre de lidocaïne utilisant la technique tumescente pour les procédures veineuses ne soit pas bien étudiée, une dose de 35 mg/kg est une estimation raisonnable.
En utilisant ces paramètres, l’anesthésie tumescente dans le contexte de la liposuccion s’est avérée extraordinairement sûre. De plus amples informations sont disponibles sur http://www.liposuction.com/pharmacology/drug_inter act.php.
CONTREINDICATIONS A L’EVLA
Les contre-indications à la technique EVLA sont estivées dans le tableau I.

Tableau I. Contre-indications au laser endoveineux.
Séquelles indésirables
Des douleurs et des ecchymoses à court terme ont été fréquemment observées après la technique EVLA. Dans une étude rétrospective, on a rapporté que le recul de la fibre laser pulsée de manière intermittente provoquait des niveaux significativement plus élevés de douleur et d’ecchymoses postopératoires, par rapport à un protocole de recul continu.38 L’ajout d’un bandage d’étirement court pendant 3 jours après une EVLA en mode intermittent a considérablement réduit les ecchymoses et la douleur rapportées par les patients. L’ajout d’un bandage à faible élasticité pendant 3 jours après une EVLA en mode intermittent a permis de réduire considérablement les ecchymoses et la douleur signalées par les patients. L’utilisation d’un protocole de retrait en mode continu a permis de réduire davantage l’intensité de la douleur et des ecchymoses à un point tel que les niveaux étaient similaires à ceux signalés par les patients traités par ablation par radiofréquence (tableaux II et III). Des rapports préliminaires suggèrent qu’il pourrait y avoir certaines différences dans l’évolution postopératoire en fonction de la longueur d’onde utilisée pour effectuer l’EVLA.22,39 Cependant, ceci est basé sur des données éparses avec un suivi à court terme.
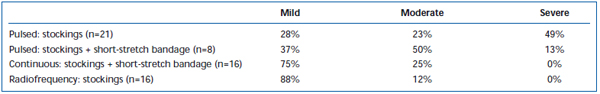
Tableau II. Ecchymoses postopératoires évaluées par les patients 3 à 7 jours après une ablation au laser endoveineux pulsé (EVLA) avec des bas de classe II, une EVLA pulsée avec des bas plus un bandage à étirement court, une EVLA en mode continu avec des bas et un bandage à étirement court, et une ablation par radiofréquence avec des bas.
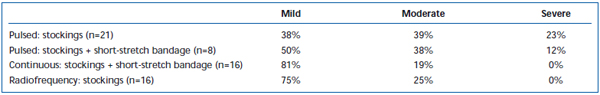
Tableau III. Douleur post-opératoire évaluée par les patients 3 à 7 jours après une ablation par laser endoveineux pulsé (EVLA) avec des bas de classe II, une EVLA pulsée avec des bas plus un bandage à étirement court, une EVLA en mode continu avec des bas et un bandage à étirement court, et une ablation par radiofréquence avec des bas.
Blessure thermique collatérale
Les températures intravasculaires maximales moyennes pendant l’EVLA (veine jugulaire de chèvre, 12 watts, impulsions d’une seconde, intervalles d’une seconde), mesurées au ras de la pointe du laser, étaient en moyenne de 729°C, tandis que celles à 4 mm de la pointe étaient en moyenne de 93°C40. Cependant, le risque de lésion thermique collatérale dépend de l’échauffement du tissu périveineux et non de la température intravasculaire.
On a constaté que le collagène se contracte à environ 50°C, tandis que la nécrose se produit entre 70°C et 100°C.41 L’étendue de la lésion thermique du tissu dépend fortement de la quantité et de la durée de la chaleur à laquelle le tissu est exposé. Henriques et Moritz ont étudié la réponse temps-température des tissus exposés jusqu’à 70°C.42 Ils ont constaté que la peau pouvait supporter des élévations de température pendant des temps d’exposition très courts, et que la réponse semblait être logarithmique à mesure que les temps d’exposition se raccourcissaient. Par exemple, une augmentation de la température corporelle à 58°C entraîne la destruction des cellules si l’exposition dure plus de 10 secondes. Les tissus, en revanche, peuvent supporter des températures allant jusqu’à 70°C si la durée de l’exposition est maintenue pendant moins d’une seconde. Li et al ont rapporté que le chauffage de cellules endothéliales à 48°C pendant 10 minutes n’induisait pas la mort cellulaire.43 Ils ont également constaté que les ostéoblastes, après une exposition de 10 minutes ou moins à 45°C, subissaient des changements transitoires et réversibles. Une autre étude a révélé des dommages tissulaires réversibles au niveau du membre postérieur de souris après une immersion dans un bain-marie à 44°C.44
Une étude récente a mesuré la température de pointe au niveau de la paroi veineuse externe pendant l’EVLA dans une veine d’oreille de porc vivante et dans les veines exposées du membre postérieur.45 Les réglages EVLA variaient de 8 watts (durées d’impulsion de 1 à 2 secondes), 10 watts (durées d’impulsion de 1 à 1,5 seconde), 12 watts (durées d’impulsion de 0,5 à 1,5 seconde) à 15 watts (durées d’impulsion de 0,5 à 1,0 seconde), avec et sans anesthésie tumescente. Les résultats démontrent que les températures de pointe variaient de 34,6°C à 49,1°C en fonction des joules délivrés, avec des températures de pointe plus basses obtenues en présence de liquide tumescent (figure 4).
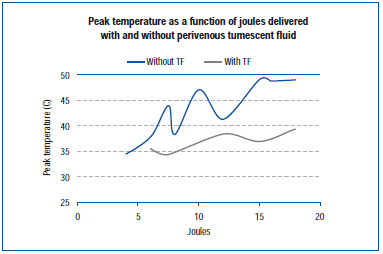
Figure 4. Adapté de Zimmet SE, Min RJ. Changements de température dans le tissu périveineux pendant le traitement au laser endoveineux dans un modèle porcin. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
La température de pointe mesurée pendant l’EVLA (63 patients, 980 nm, 15 watts, impulsions de 1,5 sec) au niveau de la paroi veineuse externe chez l’homme, 3 cm sous la jonction saphéno-fémorale, était de 40,9°C et 49,8°C avec et sans liquide tumescent, respectivement46. Des résultats similaires ont été rapportés dans une autre étude humaine au cours d’une EVLA (12 patients, 810 nm, 12 W, impulsions de 1 seconde, intervalles de 1 seconde, technique tumescente), avec des températures maximales de 43,3°C, 42,0°C et 36,0°C à 3 mm, 5 mm et 10 mm de la VGS, respectivement. 47
Il semble y avoir une chute très rapide de la température sur de courtes distances pendant l’EVLA. Ceci est probablement en contraste avec l’énergie de radiofréquence où le chauffage par micro-ondes se produit autour de l’interface tissu-électrode. Les données animales et humaines suggèrent que les pics de température périveineuse générés pendant le laser endoveineux sont peu susceptibles de causer des dommages permanents au tissu périveineux dans la plupart des situations. Le pic de température généré est réduit avec l’utilisation d’un liquide tumescent périveineux. Ces résultats semblent expliquer la très faible incidence rapportée de lésions nerveuses et de brûlures cutanées à la suite de l’EVLA. Une étude, utilisant un laser Nd : YAG de 1064 nm, a rapporté une incidence très élevée de paresthésie dans 36,5 % des cas et de brûlures cutanées dans 4,8 % des cas.48 Il convient de noter que la quantité d’énergie délivrée était environ trois fois supérieure à ce qui est généralement utilisé et que le traitement a été effectué sans anesthésie tumescente. Malgré les faibles températures périveineuses rapportées avec l’EVLA, il est important de noter qu’une prudence particulière est requise lorsqu’on envisage une intervention endoveineuse dans certains cas tels que les varices du nerf sciatique.49,50
COMPLICATIONS MAJEURES
Des complications majeures suite à l’EVLA ont été rapportées rarement. Les taux de thrombose veineuse profonde (TVP), regroupés à partir de plusieurs séries, sont bien inférieurs à 1 %.17,18,20,28 Un groupe a rapporté une incidence de 7,7 % d’extension du thrombus dans la veine fémorale.51 Cependant, dans cette étude, l’EVLA était pratiquée sous anesthésie générale ou rachidienne. Le fait que les patients n’aient pas pu se déplacer immédiatement après l’opération peut avoir contribué à l’incidence élevée de l’extension du thrombus. Un seul rapport fait état d’une fistule artério-veineuse qui s’est développée à la suite d’une EVLA de la veine saphène externe (VSI).52 Un patient a développé une thrombophlébite septique à la suite d’une EVLA combinée à une ligature ouverte des perforantes et à une phlébectomie en couteau.53 Ceci s’est résolu avec un traitement antibiotique et un débridement.
Approches alternatives
L’EVLA et l’ablation par radiofréquence (RFA)54,55 semblent être des traitements efficaces pour l’incompétence saphène. Les avantages de l’EVLA par rapport à l’ARF sont une durée de procédure plus courte et un coût par traitement plus faible. Les taux d’occlusion rapportés de l’EVLA sont généralement légèrement supérieurs à ceux obtenus avec la RFA.56 Les inconvénients de l’EVLA peuvent inclure plus d’hématomes et d’inconfort dans la période postopératoire précoce, bien que cela puisse dépendre de la technique. Les deux techniques continuent d’être perfectionnées, ce qui améliorera les résultats. Les deux procédures, lorsqu’elles sont réalisées sous anesthésie tumescente, sont associées à de faibles taux de complications.
Un autre traitement émergent du reflux saphène est l’utilisation de sclérosants en mousse délivrés sous contrôle échographique. Un gaz, comme l’air ou le CO2, peut être mélangé à des sclérosants détergents liquides pour créer une mousse, estimée être environ quatre fois plus puissante que la forme liquide du même agent. Les premiers résultats suggèrent qu’il s’agit d’une modalité intéressante, car elle est rapide et peu coûteuse à mettre en œuvre, avec des taux de réussite à court et moyen terme d’environ 75 % à 90 %. Il existe de nombreuses variables concernant la mousse (par exemple, le type et la quantité de gaz, la technique utilisée pour créer la mousse, la concentration et le type de sclérosant utilisé, le volume injecté, etc.) Il peut y avoir un risque plus élevé de thrombose veineuse profonde après une sclérothérapie à la mousse qu’après une sclérothérapie standard. Une technique appropriée est importante pour minimiser le risque de cette complication. D’autres effets secondaires ont été signalés après la sclérothérapie à la mousse, notamment des troubles visuels et neurologiques. Un rapport publié fait état d’un accident vasculaire cérébral à la suite d’une sclérothérapie à la mousse (20 ml de mousse de polidocanol) chez un patient présentant un foramen ovale patent de 1,8 cm.57 Une expérience et des recherches supplémentaires sur cette modalité permettront de mieux délimiter ses risques ainsi que son efficacité à long terme.
CONCLUSION
Les principes actuellement acceptés pour le traitement des varices servent à maximiser les résultats du point de vue hémodynamique et du patient, tout en minimisant le risque de récidive. Le traitement approprié des varices commence par une évaluation précise de la pathologie veineuse sous-jacente et l’identification des sources d’hypertension veineuse. Les objectifs du traitement comprennent l’élimination des connexions incompétentes entre les systèmes profond et superficiel, ainsi que l’oblitération des voies d’incompétence veineuse et des varices incompétentes. Il est évident que la récidive est réduite si le segment incompétent du tronc saphène est ablaté.
L’ablation au laser endoveineux est une alternative moins invasive que le stripping veineux. Les résultats semblent égaux ou supérieurs à ceux du stripping, avec de meilleurs scores de qualité de vie dans la période postopératoire. Il a été démontré que l’ablation endoveineuse au laser corrige ou améliore de manière significative les anomalies hémodynamiques chez les patients souffrant d’insuffisance veineuse chronique avec reflux veineux superficiel. Les premiers rapports suggèrent que les techniques d’ablation endoveineuse, contrairement au stripping chirurgical, sont associées à une faible incidence de néovascularisation.
L’application des principes de l’anesthésie tumescente aux traitements veineux, ainsi que le développement des techniques d’ablation endoveineuse, offrent la possibilité de traiter la grande majorité des patients atteints d’insuffisance veineuse superficielle en cabinet sans anesthésie générale ni incisions chirurgicales, tout en maximisant les résultats et en minimisant les récidives.
Cet article a été soumis le 29 juillet 2006.

2. Large J. Traitement chirurgical des varices saphènes, avec préservation du tronc saphène interne principal. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. La relation anatomique entre la veine saphène interne et le nerf saphène. Relevance for radical varicose vein surgery. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. The fate of residual saphenous vein after partial removal or ligation. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease : an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Evaluation objective de la ligature sans stripping de la veine saphène interne. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Evaluation du stripping de la veine saphène interne dans le traitement des varices primaires. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. To strip or not to strip the long saphenous vein ? A varicose vein trial. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. La néovascularisation est la principale cause de récidive des varices : résultats d’un essai randomisé de stripping de la veine saphène interne. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Stripping the long saphenous vein reduces the rate of reoperation for recurrent varicose veins : five-year results of a randomized trial. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Causes de la récidive variqueuse : résultats tardifs d’un essai contrôlé randomisé de stripping de la veine saphène interne. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Raisons de dénuder la veine saphène interne. Phlébologie. 1988;41:766-769.
13. Neglen P. Traitement des varicosités d’origine saphène : comparaison entre ligature, excision sélective et sclérothérapie. In : Bergan JJ, Goldman MP eds. Varices et télangiectasies : Diagnosis and Treatment. St. Louis, Mo, USA : Quality Medical Publishing ; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Varices récurrentes après chirurgie : une nouvelle évaluation d’un problème commun et complexe en chirurgie vasculaire. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins : more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15 : 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetent saphenous veins : a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Traitement au laser endoveineux du reflux de la veine saphène : résultats à long terme. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Thérapie endoveineuse-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Les 1000 premiers cas du groupe de travail italien sur le laser endoveineux (IEWG). Raison d’être, et résultats à long terme pour la période 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Il y a quinze ans, le laser était censé ouvrir les artères, maintenant il est censé fermer les veines : quelle est la réalité derrière l’outil ? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (discussion 9- 10).
22. Kabnick LS. Résultats de différentes longueurs d’onde de laser endoveineux pour l’ablation de la grande veine saphène. J Vasc Surg. 2006;43 : 88-93.
23. Goldman MP, Maritess M, Rao J. Fermeture intravasculaire au laser de 1320 nm de la grande veine saphène : une étude de suivi de 6 à 12 mois. Dermatol Surg. 2004;30 : 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. L’ablation saphène endoveineuse corrige l’anomalie hémodynamique chez les patients présentant une IVC de classe clinique CEAP 3-6 due à un reflux superficiel. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Comparaison du traitement endoveineux avec un laser de 810 nm par rapport au stripping conventionnel de la grande veine saphène chez les patients atteints de varices primaires. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27 :.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Oblitération au laser endoveineux pour le traitement des varices primaires. Phlébologie. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins : early results from a large single-center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Une plus grande livraison d’énergie améliore le succès du traitement au laser endoveineux des veines saphènes incompétentes. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment : key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;Jun 14 ;.
34. Anderson RR. Laser endoveineux : mécanisme d’action. Document présenté à la réunion annuelle de l’American Academy of Dermatology ; 3-7 mars 2006 ; San Francisco, Californie, USA.
35. Izzo F. Autres techniques d’ablation thermique : ablation par micro-ondes et laser interstitiel des tumeurs hépatiques. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B et Zemmouri J. Modélisation mathématique du traitement laser endoveineux (ELT). BioMedical Engineering OnLine. 2006;5:26. Disponible à : http://www.biomedical-engineeringonline. com/content/5/1/26. Consulté le 19 juillet 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Étude expérimentale de la thermocoagulation induite par le diodélaser sur le tissu hépatique avec une pointe en fibre de scanner. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Douleur, ecchymoses et efficacité à court terme après le traitement au laser endoveineux de la grande veine saphène : l’effet de la technique opératoire et des soins postopératoires. Document présenté au 16e Congrès annuel de l’American College of Phlebology ; 7-10 novembre 2002 ; Fort Lauderdale, Floride, États-Unis.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenous treatment of the great saphenous vein using a 1320 nm Nd:YAG laser causes fewer side effects than using a 940 nm diode laser. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Comparaison entre la radiofréquence endoveineuse et l’occlusion de grandes veines par un laser à diode de 810 nm dans un modèle animal. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Chirurgie incisionnelle au laser. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studies of thermal injury II : the relative importance of time and surface temperature in the causation of cutaneous bums. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Heat shockinduced necrosis and apoptosis in osteoblasts. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Changements histopathologiques dans la peau et les tissus sous-cutanés des pattes de souris après traitement par hyperthermie. Path Res Pract. 1990;186 : 247-253.
45. Zimmet SE, Min RJ. Changements de température dans le tissu périveineux pendant le traitement au laser endoveineux dans un modèle porcin. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Investigations thermométriques de la température périveineuse pendant la thérapie laser endoveineuse des varices. Document présenté au 15e Congrès mondial de l’Union Internationale de Phlébologie ; 2-7 octobre 2005 ; Rio de Janeiro, Brésil.
47. Beale RJ, Mavor AID, Gough MJ. Dissipation de la chaleur pendant le traitement au laser endoveineux des varices – y a-t-il un risque de lésion nerveuse ? Phlébologie. 2006;21:32-35.
48. Chang CJ, Chua JJ. Photocoagulation par laser endoveineux (EVLP) pour les varices. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Varices du nerf sciatique. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Observation échographique du nerf sciatique et de ses branches au creux poplité : toujours visible, jamais vu. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extension du thrombus saphène dans la veine fémorale : une complication potentielle des nouvelles techniques d’ablation endoveineuse. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Fistule artério-veineuse après traitement au laser endoveineux de la veine saphène externe. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuse phlegmonous phlebitis after endovenous laser treatment of the greater saphenous vein. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Oblitération endovasculaire du reflux saphène : une étude multicentrique. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein : analysis of early efficacy and complications. J Vasc Surg. 2005;42 ; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43 : 162-164.