Learning Outcomes
- Descrivere il comportamento e la posizione degli elettroni, e come questi fattori influenzano la formazione dei legami tra gli atomi
Gusci di elettroni e il modello di Bohr

Figura 1. Il modello di Bohr.
Si deve sottolineare che c’è una connessione tra il numero di protoni in un elemento, il numero atomico che distingue un elemento da un altro, e il numero di elettroni che ha. In tutti gli atomi elettricamente neutri, il numero di elettroni è uguale al numero di protoni. Così, ogni elemento, almeno quando è elettricamente neutro, ha un numero caratteristico di elettroni uguale al suo numero atomico.
Un primo modello dell’atomo fu sviluppato nel 1913 dallo scienziato danese Niels Bohr (1885-1962). In questo modello, gli elettroni esistono all’interno di gusci principali. Un elettrone normalmente esiste nel guscio a più bassa energia disponibile, che è quello più vicino al nucleo. L’energia di un fotone di luce può portarlo in un guscio di energia più alta, ma questa situazione è instabile, e l’elettrone decade rapidamente allo stato fondamentale. Nel processo, viene rilasciato un fotone di luce.
Il modello Bohr mostra l’atomo come un nucleo centrale contenente protoni e neutroni, con gli elettroni in orbite circolari a distanze specifiche dal nucleo, come illustrato nella figura 1. Queste orbite formano gusci di elettroni o livelli di energia, che sono un modo di visualizzare il numero di elettroni nei gusci più esterni. Questi livelli di energia sono designati da un numero e dal simbolo “n”. Per esempio, 1n rappresenta il primo livello di energia situato più vicino al nucleo.
Gli elettroni riempiono gli orbitali in un ordine coerente: prima riempiono gli orbitali più vicini al nucleo, poi continuano a riempire orbitali di energia crescente più lontani dal nucleo. Se ci sono più orbitali di uguale energia, saranno riempiti con un elettrone in ogni livello energetico prima che venga aggiunto un secondo elettrone. Gli elettroni del livello energetico più esterno determinano la stabilità energetica dell’atomo e la sua tendenza a formare legami chimici con altri atomi per formare molecole.
In condizioni standard, gli atomi riempiono prima i gusci interni, spesso risultando in un numero variabile di elettroni nel guscio più esterno. Il guscio più interno ha un massimo di due elettroni, ma i due gusci successivi possono avere ciascuno un massimo di otto elettroni. Questo è noto come la regola dell’ottetto, che afferma, con l’eccezione del guscio più interno, che gli atomi sono più stabili energeticamente quando hanno otto elettroni nel loro guscio di valenza, il guscio elettronico più esterno. Esempi di alcuni atomi neutri e delle loro configurazioni elettroniche sono mostrati nella figura 2. Notate che in questa figura, l’elio ha un guscio elettronico esterno completo, con due elettroni che riempiono il suo primo e unico guscio. Allo stesso modo, il neon ha un guscio esterno completo 2n che contiene otto elettroni. Al contrario, il cloro e il sodio hanno rispettivamente sette e uno nei loro gusci esterni, ma teoricamente sarebbero più stabili energeticamente se seguissero la regola dell’ottetto e ne avessero otto.
Domanda pratica
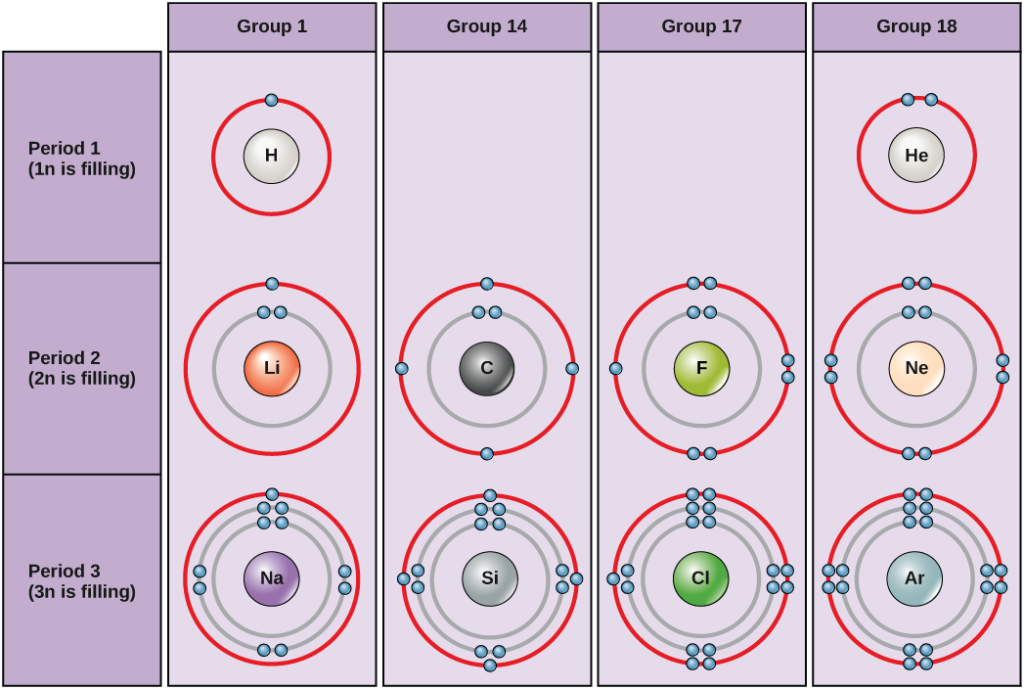
Figura 2. Diagrammi di Bohr per idrogeno, elio, litio, carbonio, fluoro, neon, sodio, silicio, cloro e argon.
I diagrammi di Bohr indicano quanti elettroni riempiono ogni guscio principale. Gli elementi del gruppo 18 (elio, neon e argon sono mostrati nella figura 2) hanno un guscio esterno, o di valenza, pieno. Un guscio di valenza pieno è la configurazione elettronica più stabile. Gli elementi di altri gruppi hanno gusci di valenza parzialmente pieni e guadagnano o perdono elettroni per raggiungere una configurazione elettronica stabile.
Un atomo può dare, prendere o condividere elettroni con un altro atomo per raggiungere un guscio di valenza pieno, la configurazione elettronica più stabile. Guardando questa figura, quanti elettroni devono perdere gli elementi del gruppo 1 per raggiungere una configurazione elettronica stabile? Quanti elettroni devono guadagnare gli elementi dei gruppi 14 e 17 per raggiungere una configurazione stabile?
Capire che l’organizzazione della tavola periodica è basata sul numero totale di protoni (ed elettroni) ci aiuta a sapere come gli elettroni sono distribuiti tra il guscio esterno. La tavola periodica è organizzata in colonne e righe in base al numero di elettroni e a dove questi elettroni sono situati. Dai un’occhiata più da vicino ad alcuni degli elementi nella colonna all’estrema destra della tavola periodica nella figura 3.

Figura 3. La tavola periodica mostra la massa atomica e il numero atomico di ogni elemento. Il numero atomico appare sopra il simbolo dell’elemento e la massa atomica approssimativa appare sotto di esso.
Gli atomi del gruppo 18 elio (He), neon (Ne) e argon (Ar) hanno tutti gusci di elettroni esterni pieni, rendendo inutile la condivisione di elettroni con altri atomi per raggiungere la stabilità; sono altamente stabili come atomi singoli. La loro non reattività li ha portati ad essere chiamati gas inerti (o gas nobili). Confronta questo con gli elementi del gruppo 1 nella colonna di sinistra. Questi elementi, tra cui l’idrogeno (H), il litio (Li) e il sodio (Na), hanno tutti un elettrone nei loro gusci più esterni. Ciò significa che possono ottenere una configurazione stabile e un guscio esterno pieno donando o condividendo un elettrone con un altro atomo o una molecola come l’acqua. L’idrogeno donerà o condividerà il suo elettrone per raggiungere questa configurazione, mentre il litio e il sodio doneranno il loro elettrone per diventare stabili. Come risultato della perdita di un elettrone carico negativamente, diventano ioni carichi positivamente. Gli elementi del gruppo 17, tra cui il fluoro e il cloro, hanno sette elettroni nei loro gusci più esterni, quindi tendono a riempire questo guscio con un elettrone da altri atomi o molecole, rendendoli ioni carichi negativamente. Gli elementi del gruppo 14, di cui il carbonio è il più importante per i sistemi viventi, hanno quattro elettroni nel loro guscio esterno che permette loro di fare diversi legami covalenti (discussi in seguito) con altri atomi. Così, le colonne della tavola periodica rappresentano il potenziale stato condiviso dei gusci elettronici esterni di questi elementi, che è responsabile delle loro caratteristiche chimiche simili.
Orbitali degli elettroni
Anche se è utile per spiegare la reattività e il legame chimico di alcuni elementi, il modello di Bohr dell’atomo non riflette accuratamente come gli elettroni sono distribuiti spazialmente intorno al nucleo. Non circondano il nucleo come la terra orbita intorno al sole, ma si trovano in orbitali di elettroni. Queste forme relativamente complesse derivano dal fatto che gli elettroni si comportano non solo come particelle, ma anche come onde. Le equazioni matematiche della meccanica quantistica, conosciute come funzioni d’onda, possono prevedere con un certo livello di probabilità dove un elettrone potrebbe trovarsi in un dato momento. L’area in cui un elettrone ha più probabilità di trovarsi è chiamata il suo orbitale.

Figura 4. Clicca per un’immagine più grande. I sottogusci s hanno la forma di sfere. Entrambi i gusci principali 1n e 2n hanno un orbitale s, ma la dimensione della sfera è più grande nell’orbitale 2n. Ogni sfera è un singolo orbitale. I sottogusci p sono costituiti da tre orbitali a forma di manubrio. Il guscio principale 2n ha un sottoguscio p, ma il guscio 1 no.
Ricorda che il modello di Bohr rappresenta la configurazione del guscio elettronico di un atomo. All’interno di ogni guscio elettronico ci sono dei sottogusci, e ogni sottoguscio ha un numero specifico di orbitali contenenti elettroni. Mentre è impossibile calcolare esattamente dove si trova un elettrone, gli scienziati sanno che molto probabilmente si trova nel suo percorso orbitale. I sottogusci sono designati dalle lettere s, p, d e f. Il sottoguscio s è di forma sferica e ha un orbitale. Il guscio principale 1n ha un solo orbitale s, che può contenere due elettroni. Il guscio principale 2n ha un sottoguscio s e uno p, e può contenere un totale di otto elettroni. Il sottoguscio p ha tre orbitali a forma di manubrio, come illustrato nella figura 4. I sottogusci d ed f hanno forme più complesse e contengono cinque e sette orbitali, rispettivamente. Questi non sono mostrati nell’illustrazione. Il guscio principale 3n ha sottogusci s, p e d e può contenere 18 elettroni. Il guscio principale 4n ha orbitali s, p, d e f e può contenere 32 elettroni. Allontanandosi dal nucleo, il numero di elettroni e di orbitali che si trovano nei livelli di energia aumenta. Procedendo da un atomo all’altro nella tavola periodica, la struttura elettronica può essere elaborata inserendo un elettrone extra nel prossimo orbitale disponibile.
L’orbitale più vicino al nucleo, chiamato orbitale 1s, può contenere fino a due elettroni. Questo orbitale è equivalente al guscio elettronico più interno del modello Bohr dell’atomo. Si chiama orbitale 1s perché è sferico attorno al nucleo. L’orbitale 1s è l’orbitale più vicino al nucleo e viene sempre riempito per primo, prima che qualsiasi altro orbitale possa essere riempito. L’idrogeno ha un solo elettrone; quindi, ha solo un punto dell’orbitale 1s occupato. Questo è designato come 1s1, dove l’apice 1 si riferisce all’unico elettrone nell’orbitale 1s. L’elio ha due elettroni; quindi, può riempire completamente l’orbitale 1s con i suoi due elettroni. Questo è designato come 1s2, riferendosi ai due elettroni dell’elio nell’orbitale 1s. Nella figura 4 della tavola periodica, l’idrogeno e l’elio sono gli unici due elementi nella prima riga (periodo); questo perché hanno solo elettroni nel loro primo guscio, l’orbitale 1s. L’idrogeno e l’elio sono gli unici due elementi che hanno l’1s e nessun altro orbitale elettronico nello stato elettricamente neutro.
Il secondo guscio elettronico può contenere otto elettroni. Questo guscio contiene un altro orbitale s sferico e tre orbitali p a forma di “manubrio”, ognuno dei quali può contenere due elettroni, come mostrato nella figura 4. Dopo che l’orbitale 1s è riempito, il secondo guscio di elettroni viene riempito, riempiendo prima il suo orbitale 2s e poi i suoi tre orbitali p. Quando si riempiono gli orbitali p, ognuno prende un singolo elettrone; una volta che ogni orbitale p ha un elettrone, un secondo può essere aggiunto. Il litio (Li) contiene tre elettroni che occupano il primo e il secondo guscio. Due elettroni riempiono l’orbitale 1s, e il terzo elettrone riempie l’orbitale 2s. La sua configurazione elettronica è 1s22s1. Il neon (Ne), d’altra parte, ha un totale di dieci elettroni: due sono nel suo orbitale 1s più interno e otto riempiono il suo secondo guscio (due ciascuno negli orbitali 2s e tre p); così, è un gas inerte ed energeticamente stabile come un singolo atomo che raramente formerà un legame chimico con altri atomi. Gli elementi più grandi hanno orbitali aggiuntivi, che costituiscono il terzo guscio elettronico. Mentre i concetti di gusci elettronici e orbitali sono strettamente correlati, gli orbitali forniscono una rappresentazione più accurata della configurazione elettronica di un atomo perché il modello orbitale specifica le diverse forme e gli orientamenti speciali di tutti i posti che gli elettroni possono occupare.
Guarda questa animazione visiva per vedere la disposizione spaziale delle orbite p e s. Nota che questo video non ha audio.
Puoi vedere il testo della descrizione audio per “Orbitali atomici – Configurazione degli elettroni dello scandio” qui (si apre in una nuova finestra).
Rassegna video
Questo video fornisce un’altra panoramica dell’elettrone:
Prova
Contribuisci!
Migliorare questa paginaPer saperne di più