Indicazioni di Palladia
Le compresse di Palladia sono indicate per il trattamento di Patnaik grado II o III, ricorrente, tumori cutanei a mastociti con o senza coinvolgimento dei linfonodi regionali nei cani.
Dosaggio e somministrazione
Forniscono sempre il foglio informativo al cliente con la prescrizione. Somministrare un dosaggio iniziale di 3,25 mg/kg (1,48 mg/lb) di peso corporeo, per via orale a giorni alterni (vedi tabella 1). Riduzioni della dose di 0,5 mg/kg (fino ad una dose minima di 2,2 mg/kg a giorni alterni) e interruzioni della dose (sospensione di PALLADIA per un massimo di due settimane) possono essere utilizzate, se necessario, per gestire le reazioni avverse (vedere la tabella 2 e le avvertenze e precauzioni). Regolare la dose sulla base di valutazioni veterinarie approssimativamente settimanali per le prime 6 settimane e, successivamente, ogni 6 settimane circa. PALLADIA può essere somministrato con o senza cibo. Non dividere le compresse.
Tabella 1. 3.25 mg/kg Tabella delle dosi
|
Peso corporeo del cane |
Numero di compresse |
||||
|
Livelli |
Kilogrammi |
Dose |
10 mg |
15 mg |
50 mg |
|
11.0 – 11.8 |
5.0 – 5.3 |
15 mg |
|||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
|||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
|||
|
18.6 – 22.0 |
8.5 – 10.0 |
30 mg |
|||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
|||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
|||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
|||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
|||
|
42,4 – 45.6 |
19.3 – 20.7 |
65 mg |
|||
|
45.7 – 50.7 |
20.8 – 23.0 |
70 mg |
|||
|
50.8 – 59.3 |
23.1 – 26,9 |
80 mg |
|||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
|||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
|||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||
|
76.4 – 79.6 |
34.7 – 36.1 |
115 mg |
|||
|
79.7 – 84.7 |
36.2 – 38.4 |
120 mg |
|||
|
84.8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||
|
94.9 – 105.0 |
43.1 – 47.6 |
150 mg |
|||
|
105.1 – 110.0 |
47.7 – 49.9 |
160 mg |
|||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
|||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
|||
|
118.7 – 128.8 |
53.9 – 58.4 |
180 mg |
|||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||
|
139.0 – 144.0 |
63.1 – 65.3 |
210 mg |
|||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
|||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
|||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
|||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
|||
|
191.7 – 220.5 |
87.0 – 100.0 |
300 mg |
|||
Tabella 2: Modifica della dose basata sulla tossicità osservata
|
Tossicità |
Adeguamento della dose |
|
Neutropenia |
|
|
>1000/µL |
Mantenere il livello della dose |
|
≤1000/µL o febbre neutropenica o infezione |
Stop del farmaco fino a >1000/µL e segni clinici normali; poi diminuire la dose di 0.5 mg/kg |
|
Tossicità renale (creatinina) |
|
|
<2.0 mg/dL |
Mantenere il livello della dose |
|
≥2.0 mg/dL |
Stop del farmaco fino a <2.0 mg/dL poi diminuire la dose di 0,5 mg/kg |
|
Albumina |
|
|
<1,5 g/dL |
Stop farmaco fino a >2.5 g/dL poi diminuire la dose di 0,5 mg/kg |
|
Ematocrito |
|
|
<26% |
Stop farmaco fino a >30% poi diminuire la dose di 0.5 mg/kg |
|
Diarrea |
|
|
<4 feci acquose/giorno per meno di 2 giorni |
Mantenere il livello della dose e istituire cure di supporto |
|
≥4 feci acquose/giorno o ≥ 2 giorni |
Sospendere il farmaco fino alla formazione di feci e istituire cure di supporto. Quando il dosaggio viene ripreso, diminuire la dose di 0.5 mg/kg |
|
GI Sanguinamento |
|
|
Sangue fresco nelle feci o feci nere catramose per > 2 giorni o franca emorragia o coaguli di sangue nelle feci. |
Interrompere il farmaco e istituire cure di supporto fino alla risoluzione di tutti i segni clinici di sangue nelle feci, quindi diminuire la dose di 0.5 mg/kg. |
Contraindicazioni
Non usare in cani usati per la riproduzione, o per cagne gravide o in allattamento (vedi Farmacologia Clinica).
Avvertenze
PALLADIA può causare disfunzioni vascolari che possono portare a edema e tromboembolia, inclusa tromboembolia polmonare. Sospendere il farmaco fino alla normalizzazione dei segni clinici e della patologia clinica. Per assicurare l’omeostasi vascolare, attendere almeno 3 giorni dopo l’interruzione del farmaco prima di eseguire un intervento chirurgico (vedere Reazioni avverse).
Complicazioni gastrointestinali gravi e talvolta fatali, inclusa la perforazione gastrointestinale, si sono verificate raramente in cani trattati con PALLADIA (vedere Reazioni avverse). Se si sospetta un’ulcerazione gastrointestinale, interrompere la somministrazione del farmaco e trattare adeguatamente.
Avvertenze per gli esseri umani:
NON UTILIZZARE NEGLI UMANI. TENERE QUESTO E TUTTI I FARMACI FUORI DALLA PORTATA DEI BAMBINI. I bambini non devono entrare in contatto con PALLADIA. Tenere i bambini lontani da feci, urina o vomito di cani trattati. Per evitare l’esposizione al farmaco, lavare le mani con acqua e sapone dopo la somministrazione di PALLADIA e indossare guanti protettivi per evitare il contatto diretto con feci, urina, vomito e compresse di PALLADIA rotte o umide. Mettere tutti i materiali di scarto in un sacchetto di plastica e sigillare prima dello smaltimento generale. Se gli occhi sono accidentalmente esposti al farmaco, sciacquare immediatamente gli occhi con acqua. In caso di ingestione accidentale da parte di una persona, consultare immediatamente un medico e mostrargli il foglietto illustrativo o l’etichetta. Malessere gastrointestinale come vomito o diarrea può verificarsi se questo farmaco viene accidentalmente ingerito.
Le donne incinte, le donne che possono diventare incinte, o le madri che allattano devono prestare particolare attenzione a queste precauzioni di trattamento. (PALLADIA, come altri farmaci della sua classe, previene la formazione di nuovi vasi sanguigni nei tumori. In modo simile, PALLADIA può influenzare la formazione di vasi sanguigni nel feto in via di sviluppo e può danneggiare un bambino non ancora nato (causare difetti alla nascita). Per le donne incinte, l’ingestione accidentale di PALLADIA può avere effetti negativi sulla gravidanza.
Precauzioni
Interrompere temporaneamente l’uso di PALLADIA se si verificano contemporaneamente anemia, azotemia, ipoalbuminemia e iperfosfatemia. Riprendere il trattamento con una riduzione della dose di 0,5 mg/kg dopo 1 o 2 settimane quando i valori sono migliorati e l’albumina è >2,5 g/dl. Interruzioni temporanee del trattamento possono essere necessarie se uno qualsiasi di questi si verifica da solo: ematocrito <26%, creatinina ≥2.0 mg/dl o albumina <1.5 g/dl. Quindi riprendere il trattamento con una riduzione della dose di 0,5 mg/kg una volta che l’ematocrito è >30%, la creatinina è <2,0 mg/dl, e l’albumina è >2,5 g/dl.
Interrompere temporaneamente l’uso di PALLADIA se la conta dei neutrofili è ≤1000/µL. Riprendere il trattamento dopo 1 o 2 settimane con una riduzione della dose di 0,5 mg/kg, quando la conta dei neutrofili è tornata a >1000/µL. Ulteriori riduzioni della dose possono essere necessarie se si ripresenta una grave neutropenia.
La presenza di un tumore sistemico dei mastociti prima del trattamento può predisporre un cane a una degranulazione clinicamente significativa dei mastociti con possibili gravi reazioni avverse sistemiche quando viene trattato con PALLADIA. Si dovrebbe tentare di escludere la mastocitosi sistemica prima di iniziare il trattamento con PALLADIA.
PALLADIA è stato associato a diarrea grave o emorragia GI che richiede un trattamento tempestivo. Possono essere necessarie interruzioni e riduzioni della dose a seconda della gravità dei segni clinici. (Vedere la tabella 2 in Dosaggio e somministrazione.)
Utilizzare con cautela i farmaci antinfiammatori non steroidei insieme a PALLADIA a causa di un aumentato rischio di ulcerazione o perforazione gastrointestinale.
PALLADIA viene metabolizzato nel fegato. La co-somministrazione di PALLADIA con forti inibitori della famiglia CYP3A4 può aumentare le concentrazioni di PALLADIA. L’effetto di farmaci concomitanti che possono inibire il metabolismo di PALLADIA non è stato valutato. La compatibilità dei farmaci deve essere monitorata nei pazienti che richiedono farmaci concomitanti.
L’uso sicuro di PALLADIA non è stato valutato in cani di età inferiore a 24 mesi o di peso inferiore a 5 kg.
Reazioni avverse
Uno studio clinico sul campo negli Stati Uniti, comprendente una fase mascherata di 6 settimane, seguita da una fase in aperto, ha valutato la sicurezza e l’efficacia di PALLADIA in 151 cani di proprietà di clienti che avevano tumori cutanei a mastociti di grado Patnaik II o III, ricorrenti, con o senza coinvolgimento linfonodale regionale. Le reazioni avverse più comuni riportate durante la fase mascherata sono riassunte nella tabella 3; quelle riportate durante l’intero studio (fase mascherata combinata con la fase in aperto) sono riassunte nella tabella 4.
Tabella 3. Riassunto delle reazioni avverse più comuni durante la fase mascherata
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Avverse Reazione |
Qualsiasi grado |
Grado 3 o 4b |
Qualsiasi grado |
Grado 3 o 4b |
|
Diarrea |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anoressia |
31,3% |
6.3% |
39,1% |
6,9% |
|
Letargia |
29.7% |
3.1% |
35.6% |
4.6% |
|
Vomito |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lameness |
9.4% |
0.0% |
17.2% |
0,0% |
|
Perdita di peso |
3,1% |
0.0% |
14,9% |
1,1% |
|
Sangue nelle feci/sanguinamento GI/diarrea emorragica |
3.1% |
0.0% |
12.6% |
2.3% |
|
Disturbo muscoloscheletrico |
6,3% |
0.0% |
11,5% |
1,1% |
|
Deidratazione |
4.7% |
0.0% |
9.2% |
2.3% |
|
Dermatite |
9,4% |
1,6% |
9,2% |
0.0% |
|
Prurito |
4,7% |
0,0% |
9.2% |
0,0% |
|
Tachipnea |
4.7% |
0,0% |
8,0% |
1,1% |
|
Dolore localizzato |
4,7% |
0,0% |
8.0% |
0,0% |
|
Nausea |
3,1% |
0.0% |
8,0% |
1,1% |
|
Dolore generale |
4.7% |
1.6% |
6.9% |
0.0% |
|
Polidipsia |
7.8% |
0.0% |
6,9% |
0,0% |
|
Pirexia |
3.1% |
0.0% |
5.7% |
2.3% |
|
Flatulenza |
3.1% |
0.0% |
5.7% |
0,0% |
|
Disturbo della pigmentazione |
1.6% |
0.0% |
5.7% |
0.0% |
|
Anormalità di laboratorio |
Qualsiasi grado |
Grado 3 o 4c |
Qualsiasi Gradec |
Grado 3 o 4c |
|
Neutropenia |
6.3% |
0.0% |
46.0% |
0,0% |
|
Trombocitopenia |
20,3% |
0,0% |
24,1% |
0.0% |
|
Aumento dell’alanina aminotransferasi |
21,9% |
4.7% |
24,1% |
1,1% |
|
Ipoalbuminemia |
7.8% |
0,0% |
12,6% |
0,0% |
|
Ematocrito diminuito |
7,8% |
0.0% |
5,7% |
3,4% |
|
Iperbilirubinemia |
1.6% |
1.6% |
5.7% |
0.0% |
|
Aumento della creatinina |
4,7% |
0,0% |
5.7% |
0,0% |
|
Infezione del tratto urinario |
1.6% |
0,0% |
5,7% |
0,0% |
a Il tempo medio in studio durante la fase mascherata era di 37,0 giorni per i cani trattati con PALLADIA (mediana, 42.0 giorni) e 27,6 giorni per i cani trattati con placebo (mediana, 21,0 giorni); non sono stati fatti aggiustamenti nei confronti statistici per questa disparità.
b Gli investigatori hanno assegnato un grado di gravità di 1, 2, 3 o 4 (1 – meno grave; 4 – più grave).
c La classificazione delle anomalie di laboratorio era basata sulla linea guida Common Toxicity Criteria del National Cancer Institute adattata per i canini (1 – meno grave; 4 – più grave).
Tabella 4. Riassunto delle reazioni avverse più comuni durante lo studio (fase mascherata combinata con la fase in aperto).label phase)a
|
PALLADIA (n = 145) a |
||
|
Reazioni avverse |
Qualsiasi gradodeb |
Grado 3 o 4b |
|
Diarrea |
58.6% |
8.3% |
|
Anoressia |
49.7% |
8.3% |
|
Vomito |
47.6% |
9,7% |
|
Letargia |
39,3% |
4.1% |
|
Luminosità |
22,8% |
0,0% |
|
Perdita di peso |
21,4% |
2.8% |
|
Sangue nelle feci/sanguinamento GI/diarrea emorragica |
18.6% |
2,8% |
|
Deidratazione |
15,2% |
2.1% |
|
Prurito |
12,4% |
0,0% |
|
Disturbo della pigmentazione |
11.7% |
0,0% |
|
Dermatite |
11.0% |
0,0% |
|
Disturbi muscoloscheletrici |
11,0% |
0,0% |
|
Dolore generale |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0,0% |
|
Tachipnea |
8,3% |
0.0% |
|
Nausea |
7,6% |
1.4% |
|
Polidipsia |
7,6% |
0,0% |
|
Pirexia |
6.9% |
2,8% |
|
Artrite |
6,2% |
0,0% |
|
Edema localizzato |
6.2% |
0,0% |
|
Infezione batterica della pelle |
5,5% |
0,0% |
|
Congiuntivite |
5.5% |
0.0% |
|
Anormalità di laboratorio |
Ogni grado |
Grado 3 o 4c |
|
Neutropenia |
44.8% |
1.4% |
|
Ipoalbuminemia |
28.3% |
1.4% |
|
Trombocitopenia |
28,3% |
2.1% |
|
Aumento dell’alanina aminotransferasi |
27,6% |
4.1% |
|
Ematocrito diminuito |
11,0% |
2.8% |
|
Incremento della creatinina |
13,8% |
1,4% |
|
Iperbilirubinemia |
6,9% |
0.0% |
|
Infezione del tratto urinario |
7,6% |
0,0% |
a La durata del trattamento con PALLADIA andava da 2 a 812 giorni (media, 144 giorni; mediana, 68 giorni). Tutti i cani hanno ricevuto almeno 1 dose di PALLADIA.
b Gli sperimentatori hanno assegnato un grado di gravità di 1, 2, 3 o 4 (1 – meno grave; 4 – più grave).
c La classificazione delle anomalie di laboratorio si è basata sulla linea guida Common Toxicity Criteria del National Cancer Institute adattata ai cani (1 – meno grave; 4 – più grave).
Altri eventi avversi sono stati riportati ma si sono verificati nel < 5% dei cani. Ogni singolo cane può aver avuto eventi avversi multipli.
C’erano 5 morti durante questo studio che erano possibilmente collegati al farmaco. I risultati patologici hanno generalmente rivelato prove di disfunzione vascolare tra cui tromboembolia polmonare (post-operatoria); insufficienza multiorgano associata a vasculite e trombosi; trombosi vascolare con coagulopatia intravascolare diffusa (CID) e pancreatite; e vasculite con CID. Un cane è morto in seguito a perforazione gastrica; la durata del trattamento con PALLADIA era di 221 giorni e non c’era evidenza di tumore dei mastociti alla necroscopia. Questi decessi si sono verificati in presenza o assenza di malattia lorda; la durata del trattamento variava da 18 a 221 giorni.
La relazione dei seguenti decessi con il farmaco è sconosciuta. Un cane, prima trattato per 3 settimane con un placebo, è morto di causa sconosciuta 7 giorni dopo l’inizio della terapia con PALLADIA. Un altro cane è morto per causa sconosciuta 92 giorni dopo l’inizio della terapia con PALLADIA. Non è stata condotta alcuna necroscopia in nessuno dei due cani.
Ventisette cani hanno sviluppato una qualche forma di emorragia gastrointestinale con il 2,8% dei cani che ha avuto una grave emorragia. Un cane ha sviluppato un’ulcerazione gastrica che era probabilmente legata al farmaco. Tre cani sono morti per perforazioni gastriche (1 cane) o duodenali (2 cani) durante lo studio. Un cane con una perforazione duodenale ha ricevuto solo 1 dose di farmaco in studio e, pertanto, non è stato considerato correlato al farmaco.
Sette cani hanno sviluppato depigmentazione nasale nelle prime settimane di trattamento. Undici cani hanno sviluppato cambiamenti del colore del pelo o della pelle durante lo studio. Due di questi cani hanno avuto cambiamenti completi del colore del mantello da fulvo a bianco e da rosso intenso a biondo. Sette cani hanno avuto alopecia.
C’è un effetto legato al farmaco sul peso corporeo: il 20,0% dei cani ha avuto >13% di perdita di peso nella fase mascherata più open-label attribuibile al farmaco. Di questi, 5 cani hanno avuto >25% di perdita di peso.
Tre cani hanno avuto attività di tipo convulsivo durante lo studio del farmaco. Non può essere determinato se questi erano correlati al farmaco.
Due cani hanno sviluppato epistassi che non era associata a trombocitopenia. Un altro cane ha sviluppato epistassi con concomitante coagulopatia intravascolare disseminata.
Per una copia della scheda di sicurezza (SDS) o per segnalare eventi avversi chiamare Zoetis al 1-888-963-8471.
Informazioni per i proprietari di cani:
Fornire sempre il foglio informativo per il cliente con la prescrizione e rivederlo con i proprietari. I proprietari devono essere informati sulle possibili reazioni avverse e quando interrompere il farmaco e chiamare il veterinario. I proprietari devono essere informati delle istruzioni di manipolazione.
Farmacologia clinica
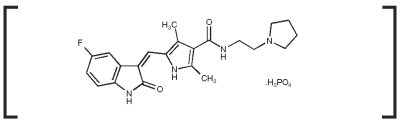
Meccanismo d’azione: Toceranib fosfato è una piccola molecola che ha un’attività antitumorale e antiangiogenica diretta. In studi di farmacologia non-clinica, toceranib ha inibito selettivamente l’attività tirosin-chinasica di diversi membri della famiglia delle tirosin-chinasi del recettore (RTK), alcuni dei quali sono implicati nella crescita tumorale, nell’angiogenesi patologica e nella progressione metastatica del cancro. Toceranib ha inibito l’attività della tirosin-chinasi Flk-1/KDR (recettore del fattore di crescita endoteliale vascolare, VEGFR2), del recettore del fattore di crescita derivato dalle piastrine (PDGFR) e del recettore del fattore delle cellule staminali (Kit) sia in saggi biochimici che cellulari. Toceranib ha dimostrato di esercitare un effetto antiproliferativo sulle cellule endoteliali in vitro. Il trattamento con Toceranib può indurre l’arresto del ciclo cellulare e la successiva apoptosi nelle linee cellulari tumorali che esprimono mutazioni attivanti nella chinasi split RTK, ckit. La crescita dei tumori dei mastociti canini è frequentemente guidata da mutazioni attivanti in c-kit.1,2
Altri composti della classe antiangiogenesi degli agenti antineoplastici sono noti per aumentare l’embrioletalità e le anomalie fetali. Poiché l’angiogenesi è una componente critica dello sviluppo embrionale e fetale, l’inibizione dell’angiogenesi in seguito alla somministrazione di PALLADIA dovrebbe comportare effetti avversi sulla gravidanza nella cagna.
Farmacocinetica
Dopo la somministrazione endovenosa, la farmacocinetica di toceranib è caratterizzata da un volume di distribuzione molto grande (>20 L/kg, che indica la ripartizione nei tessuti), un’emivita di eliminazione terminale di circa 16 ore e una clearance di >1 L/hr/kg. Con un regime di dosi di 3,25 mg di base libera equivalente (fbe)/kg di toceranib somministrato per via orale ogni due giorni per 2 settimane (7 dosi), i parametri farmacocinetici di toceranib nel plasma in cani Beagle sani (tra 7,2 – 12,5 kg) sono riportati nella tabella seguente.
Tabella 5: Parametri Farmacocinetici
|
Parametri Farmacocinetici (Media + 1SD) |
Totale (n=11;6M, 5F) |
Totale (n=10; 5M, 5F) |
|
Emivita di eliminazione, t1/2 (h) |
16.4 ± 3.6 |
17.2 ± 3.9 |
|
Tempo alla massima concentrazione plasmatica, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Concentrazione plasmatica massima, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Area sotto la curva temporale della concentrazione plasmatica, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Valore normalizzato alla dose (adattato a 3.25 mg/kg di dose)
b Cmin è la concentrazione a 48 ore dopo la dose, che corrisponde all’intervallo della dose.
La biodisponibilità orale di toceranib è del 77%. PALLADIA è altamente legato alle proteine al 91% – 93%.
Si deve notare che nonostante l’omogeneità dei soggetti inclusi in questo studio, è stata osservata una grande variabilità tra i soggetti. Indipendentemente dalla via di somministrazione, la farmacocinetica lineare è stata osservata a dosi fino a 5 mg/kg due volte al giorno. Utilizzando un sistema di test in vitro su epatociti e microsomi epatici, l’isomero Z è stato trovato metabolizzato al derivato N-ossido di toceranib in cani, uomini, gatti e ratti. Sebbene sia stata osservata una piccola differenza di genere nello studio in vitro (81% di conversione nei cani maschi, 56% di conversione nei cani femmine), non sono state osservate differenze nella farmacocinetica di toceranib in vivo. Gli effetti dell’insufficienza renale, dell’insufficienza epatica o della razza sulla farmacocinetica di toceranib non sono stati studiati.
Efficacia
L’efficacia e la sicurezza di PALLADIA compresse orali per il trattamento dei tumori dei mastociti sono state valutate in uno studio clinico randomizzato, controllato con placebo, in doppio maschera, multicentrico. Lo scopo di questo studio era di valutare l’efficacia e la sicurezza di PALLADIA nel trattamento dei tumori dei mastociti nei cani che avevano una malattia ricorrente misurabile dopo l’intervento chirurgico e di valutare la risposta oggettiva (risposta completa o parziale). Il trattamento con PALLADIA è stato confrontato con il trattamento con placebo utilizzando i tassi di risposta alla fine della fase mascherata di 6 settimane. I tassi di risposta sono stati determinati utilizzando i criteri di valutazione della risposta nei tumori solidi del National Cancer Institute3 che sono stati modificati specificamente per la valutazione dei tumori a mastociti canini.
Centocinquantatre cani sono stati assegnati in modo casuale al trattamento con 3,25 mg/kg di PALLADIA (n = 88) o placebo (n = 65) per via orale, ogni due giorni per 6 settimane, o fino alla progressione della malattia o al ritiro dallo studio per altre cause. Il trattamento è stato smascherato al momento della progressione della malattia: ai cani che ricevevano il placebo è stato offerto il crossover a PALLADIA in aperto; i cani che ricevevano PALLADIA sono stati interrotti dallo studio. I cani dovevano avere tumori cutanei a mastociti di grado Patnaik II o III, ricorrenti, con o senza coinvolgimento dei linfonodi regionali. Almeno 1 tumore doveva avere un diametro di almeno 20 mm. I cani avevano un limite di 1 protocollo di radiazione completato e un limite di 1 regime di chemioterapia sistemica precedente. Sono stati esclusi i cani con evidenza di tumore sistemico dei mastociti. Non era permesso il trattamento con corticosteroidi sistemici durante lo studio o nei 14 giorni precedenti l’inizio dello studio. Se necessario per gestire le reazioni avverse, sono state prescritte interruzioni della dose (sospensione di PALLADIA per un massimo di 2 settimane) e/o il dosaggio è stato ridotto fino a 2,2 mg/kg.
L’analisi di efficacia ha mostrato un vantaggio statisticamente significativo per PALLADIA rispetto al placebo nell’endpoint primario di efficacia della risposta obiettiva alla fine della fase mascherata di sei settimane. La risposta obiettiva è una risposta completa + una risposta parziale. La risposta parziale è una diminuzione ≥ 30% nella somma del diametro più lungo delle lesioni bersaglio, prendendo come riferimento la somma basale, la non progressione delle lesioni non bersaglio e la non comparsa di nuove lesioni.
Mast Cell Tumor – Risultati dell’endpoint primario di efficacia
|
Parametro di efficacia |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-valore |
|
Tasso di risposta oggettivo * |
7.9% |
37.2% |
< 0.001 |
* La differenza nel tasso di risposta obiettiva tra i gruppi non era significativamente associata al peso del tumore (presenza o assenza di coinvolgimento linfonodale regionale) o al grado del tumore (P > 0,05).
Durante lo studio, PALLADIA è stato somministrato in concomitanza con altri farmaci come antimicrobici, bloccanti dei recettori H-2, antistaminici, antiemetici, antinfiammatori non steroidei, farmaci antiulcera ad azione locale, modificatori della motilità gastrointestinale oppiacei, oppioidi, vaccini, antielmintici, antiparassitari e preparazioni corticosteroidee topiche/ftalmiche/otiche. Solo durante la fase in aperto, 5 cani hanno ricevuto un breve ciclo di corticosteroidi a breve durata d’azione.
Sicurezza animale:
Nello studio sulla sicurezza dell’animale target presentato di seguito, PALLADIA ha dimostrato di avere un margine di sicurezza ristretto; i cani in trattamento con PALLADIA devono essere monitorati per reazioni avverse che possono indicare la necessità di un aggiustamento della dose. Due cani nel gruppo da 6 mg/kg sono stati sottoposti a eutanasia per tossicità clinica rispettivamente nei giorni 23 e 27 dello studio.
Toceranib è stato somministrato per via orale a 20 cani Beagle adulti maschi e 20 femmine (circa 2 anni di età) a dosi di 0 mg/kg (placebo, 12 cani), 2 mg/kg (0,5X, 8 cani), 4 mg/kg (1X, 12 cani), o 6 mg/kg (1,5X, 8 cani) una volta ogni due giorni per 13 settimane consecutive senza interruzione della dose. Toceranib ha causato perdita di peso, diminuzione del consumo di mangime, cambiamenti pancreatici, gonadici, surrenali, muscolari ed ematopoietici.
Il consumo di mangime è diminuito nel gruppo 6 mg/kg rispetto al placebo, con la più grande differenza nei mezzi che si è verificata al giorno 35. La diminuzione del peso corporeo nel gruppo 4 mg/kg è stata osservata al giorno 31 e nel gruppo 6 mg/kg al giorno 15 rispetto al placebo ed è continuata durante lo studio. La zoppia correlata alla dose, osservata quasi esclusivamente negli arti posteriori, e il dolore agli arti erano maggiori in tutti i gruppi di trattamento rispetto al placebo, con il gruppo 6 mg/kg che dimostrava la più alta incidenza. Rigidità e debolezza sono state osservate quasi esclusivamente nel gruppo 6 mg/kg. L’arrossamento della mucosa orale è stato osservato in tutti i gruppi di trattamento. Un cane del gruppo 4 mg/kg ha avuto ulcerazioni orali e un cane del gruppo 6 mg/kg ha avuto ulcerazioni cutanee, entrambi con infezioni batteriche presenti. Diarrea o feci molli sono stati visti in tutti e quattro i gruppi.
Le analisi ematologiche hanno mostrato diminuzioni dell’ematocrito, dell’emoglobina e della conta degli eritrociti e una diminuzione della conta dei reticolociti nei gruppi 4 e 6 mg/kg che tendevano a recuperare sufficientemente per limitare ulteriori diminuzioni della conta degli eritrociti. La conta dei globuli bianchi era significativamente più bassa in tutto lo studio in tutti i gruppi trattati rispetto al placebo, principalmente a causa di una diminuzione dei neutrofili. I linfociti sono diminuiti in misura minore, soprattutto a basse dosi. Gli eosinofili e i basofili hanno mostrato diminuzioni marcate e persistenti. I monociti non sono stati colpiti.
La conta delle piastrine è aumentata leggermente nei gruppi da 4 e 6 mg/kg. Aumenti sono stati osservati in fibrinogeno nel gruppo 4 e 6 mg/kg.
Sono stati osservati aumenti in aspartato aminotransferasi, creatina chinasi, e concentrazioni di fosforo nel siero nei gruppi 4 e 6 mg/kg. Aumenti della fosfatasi alcalina sono stati osservati nel gruppo da 6 mg/kg. Un aumento dell’amilasi è stato osservato in un cane in ciascuno dei gruppi di trattamento. Un aumento del potassio nel siero è stato osservato in un cane del gruppo 6 mg/kg. Aumenti della lattato deidrogenasi e delle globuline sono stati osservati nel gruppo 6 mg/kg.
I cambiamenti microscopici legati al trattamento hanno incluso una riduzione da lieve a marcata della cellularità del midollo osseo sternale e femorale. C’era una corrispondente lieve ematopoiesi extramidollare, principalmente eritropoiesi, nella milza. Nel pancreas, si è verificata una degranulazione acinare da lieve a moderata legata alla dose, caratterizzata da una diffusa perdita di granuli di zimogeno. Nelle ghiandole surrenali, si è verificata una congestione/emorragia corticale minima a tutte le dosi, con una suggestiva relazione dose-effetto. La vacuolizzazione corticale surrenale è stata notata con bassa frequenza in tutti i gruppi. Cambiamenti correlati alla dose sono stati notati negli organi riproduttivi di entrambi i sessi. I maschi hanno mostrato una deplezione delle cellule germinali correlata alla dose, vacuolizzazione tubulare e riduzioni del numero di spermatozoi maturi. Nelle femmine, le ovaie hanno mostrato una ridotta incidenza di corpora lutea maturi / in regresso e una maggiore incidenza di piccoli follicoli.
Due cani (un maschio, una femmina) nel gruppo 6 mg/kg sono stati eutanasia per tossicità cliniche legate al trattamento nei giorni 23 e 27 dello studio, rispettivamente. L’inizio della sindrome terminale è stato visto come assunzione di cibo marcatamente ridotto e melena. Nei seguenti 9 giorni, la diminuzione dell’assunzione di cibo è progredita fino all’anoressia quasi completa ed è comparsa l’ematochezia. Sono stati osservati perdita di peso, letargia, zoppia degli arti posteriori e debolezza. I seguenti risultati di patologia clinica sono coerenti con i cambiamenti osservati negli altri cani del gruppo 6 mg/kg, nonché i cambiamenti dovuti alle condizioni debilitate dei cani appena prima dell’eutanasia. Entrambi i cani avevano aumenti di proteine totali, globuline, fosforo, colesterolo, trigliceridi e fibrinogeno. Un cane aveva pancitopenia, diminuzione dell’ematocrito, dell’emoglobina, dei reticolociti, dell’albumina e del PT e aumento delle bande. Era presente anche ematuria. L’altro cane aveva anche linfociti, eosinofili, cloruro e sodio diminuiti e aumenti di RBC, ematocrito, emoglobina, piastrine, ALP, amilasi, creatinina, BUN, magnesio, potassio e bilirubina totale. Il profilo della coagulazione ha mostrato una diminuzione del PT e un aumento del PTT in entrambi i cani. Questi cani hanno mostrato deplezione linfoide nei linfonodi, nel timo e nei tessuti linfatici associati all’intestino e lesioni gastrointestinali da lievi a marcate, oltre ai risultati microscopici descritti negli animali sopravvissuti fino alla fine dello studio. Questi due cani avevano anche lesioni nel tratto gastrointestinale, reni, pancreas, ipofisi e ghiandole surrenali.
Condizioni di conservazione: Conservare a temperatura ambiente controllata da 20° a 25° C (da 68° a 77° F).
Come viene fornito
Le compresse PALLADIA contengono 10 mg, 15 mg o 50 mg di toceranib come toceranib fosfato per compressa. Le compresse sono confezionate in flaconi da 30 pezzi.
1 London CA, Hannah AL, Zadovoskaya R, et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approvato dalla FDA
Prodotto da: Pfizer Inc, Ascoli, Italia
Distribuito da: Zoetis Inc., Kalamazoo, MI 49007
Revisionato: Agosto 2015