Learning Outcomes
- 電子の挙動と位置、およびこれらの要因が原子間の結合形成にどのように影響するかを説明できる
電子殻とボーアモデル

Fig.1. ボーア模型
ある元素を区別する原子番号である陽子の数と、それが持つ電子の数には関連があることを強調しておく必要がある。 電気的に中性な原子では、電子の数はすべて陽子の数と同じである。 このように、少なくとも電気的に中性であれば、各元素はその原子番号と同じ数の電子を持つという特徴があります。
原子の初期のモデルは、デンマークの科学者ニールス・ボーア(1885-1962)が1913年に開発しました。 このモデルでは、電子は主殻の中に存在する。 電子は通常、原子核に最も近い、最もエネルギーの低い殻に存在する。 しかし、この状態は不安定であり、電子はすぐに基底状態に戻ってしまう。 7706>
ボーア模型では、原子を陽子と中性子を含む中心原子核とし、図1に示すように、原子核から特定の距離にある円軌道に電子を配置しています。 この軌道は電子殻を形成しており、最外殻にある電子の数を可視化したものがエネルギー準位である。 これらのエネルギー準位は、数字と “n “という記号で表される。 例えば、1nは原子核に最も近いところにある最初のエネルギー準位を表します。
電子は一貫した順序で軌道を埋め、まず原子核に最も近い軌道を埋め、次に原子核から遠いエネルギーの高い軌道を埋め続けます。 同じエネルギーの軌道が複数ある場合は、それぞれのエネルギー準位で1個の電子が満たされた後、2個目の電子が加えられる。 7706>
標準的な条件下では、原子はまず内殻を埋め、最外殻にある電子の数は変動することが多い。 最内殻は最大2個の電子を持つが、次の2つの電子殻はそれぞれ最大8個の電子を持つことができる。 これはオクテット則と呼ばれ、最内殻を除き、原子は最外殻である価電子が8個ある方がエネルギー的に安定であるとするものである。 図2にいくつかの中性原子とその電子配置の例を示す。 この図では、ヘリウムは完全な外殻電子を持ち、2個の電子が第一殻と唯一の殻を満たしていることに注目されたい。 同様に、ネオンは8個の電子を含む完全な外殻2nを持つ。 一方、塩素とナトリウムの外殻はそれぞれ7個と1個ですが、理論的には8重則に従って8個あった方がエネルギー的に安定です。
練習問題
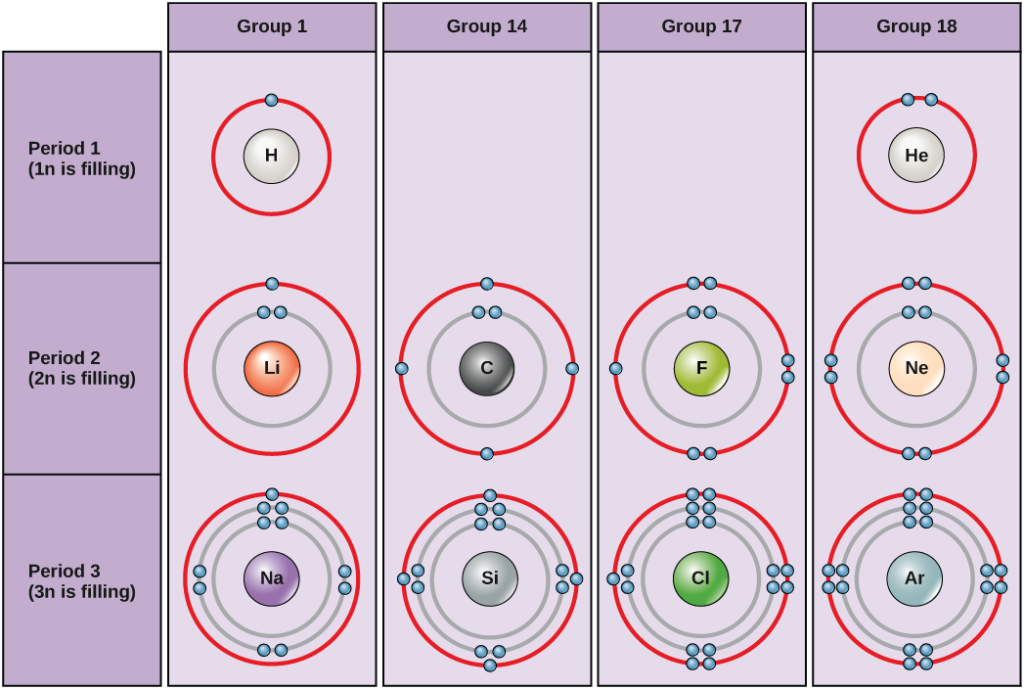
図2. 水素、ヘリウム、リチウム、炭素、フッ素、ネオン、ナトリウム、シリコン、塩素、アルゴンのボーア図
ボーア図は、各主殻にいくつの電子があるかということを示しています。 18族元素(ヘリウム、ネオン、アルゴンは図2に示す)は、外殻、つまり価電子帯がすべて揃っている。 価電子帯が完全であることが、最も安定な電子配置である。 7706>
原子は、最も安定な電子配置である完全な価電子殻を得るために、他の原子と電子を与えたり、奪ったり、共有したりすることがあります。 この図を見て、1族の元素が安定な電子配置になるためには、何個の電子を失えばよいでしょうか。 7706>
周期表の構成が陽子(と電子)の総数に基づいていることを理解すると、電子が外殻にどう分配されているかを知ることができます。 周期表は、電子の数とその電子がどこにあるかによって、列と行に分けられています。 図3.5460>

周期表の右端の列にある元素をよく見てみよう。 周期表には、各元素の原子量と原子番号が記されている。 7706>
18族のヘリウム(He)、ネオン(Ne)、アルゴン(Ar)はいずれも外側の電子殻が満たされており、他の原子と電子を共有しなくても安定で、単一原子として非常に安定である。 そのため、不活性ガス(希ガス)と呼ばれるようになった。 左の列の1族元素と比較してください。 水素(H)、リチウム(Li)、ナトリウム(Na)などの元素は、いずれも最外殻に電子を1個持っている。 つまり、他の原子や水などの分子に電子を提供したり共有したりすることで、安定した配置と満たされた外殻を得ることができるのです。 水素は電子を提供または共有することでこの配置になり、リチウムとナトリウムは電子を提供することで安定な配置になります。 負電荷の電子を失った結果、正電荷のイオンになる。 フッ素や塩素などの17族元素は、最外殻に7個の電子を持っているので、この殻を他の原子や分子の電子で埋めようとし、負に帯電したイオンになる傾向があります。 14族元素は、生体にとって最も重要な炭素を含むが、外殻に4個の電子を持つため、他の原子といくつかの共有結合(後述)を作ることができる。 7706>
電子軌道
特定の元素の反応性と化学結合を説明するのに便利ですが、ボーア原子のモデルは、電子が原子核を囲んで空間的にどのように分布しているかを正確に反映していません。 電子は地球が太陽の周りを回るように原子核の周りを回っているのではなく、電子軌道の中に存在しているのです。 このように比較的複雑な形をしているのは、電子が粒子としてだけでなく、波のような振る舞いをしているためです。 波動関数と呼ばれる量子力学の数学的方程式は、電子がどの位置にいるかをある確率で予測することができる。 7706>

図4.電子が最も多く存在する場所は、軌道と呼ばれている。 クリックすると大きな画像が表示されます。 sサブシェルは球のような形をしている。 1n主殻も2n主殻もs軌道を持つが、球の大きさは2n軌道の方が大きい。 pサブシェルは3つのダンベル型軌道からなる。 主殻2nにはp副殻がありますが、主殻1にはありません。
ボーアモデルが原子の電子殻配置を描いていることを思い出してください。 各電子殻の中には副殻があり、各副殻には電子を含む軌道の数が決められています。 電子の位置を正確に計算することは不可能ですが、科学者たちは、電子がその軌道上にあることがほとんどであることを知っています。 サブシェルは、s、p、d、fの文字で示される。sサブシェルは球状で、1つの軌道を持つ。 主殻1nはs軌道を1つだけ持ち、2個の電子を保持することができる。 主殻2nはsとpの部分殻を1つずつ持ち、合計8個の電子を保持できる。 p副殻は、図4に示すように、3つのダンベル型軌道を持つ。 dとfはもっと複雑な形をしていて、それぞれ5個と7個の軌道を持つ。 これらは図に示されていない。 主殻3nはs,p,dの副殻を持ち、18個の電子を保持することができる。 4n主殻はs,p,d,f軌道を持ち、32個の電子を保持することができる。 原子核から離れるにつれて、エネルギー準位に含まれる電子と軌道の数が増えていく。 周期表で原子を一つずつ見ていくと、次に空いている軌道に余分な電子をはめ込んでいくことで電子の構造を知ることができます。 この軌道はボーア模型の原子の一番奥の電子殻に相当する。 原子核の周りを球状に回っているため、1s軌道と呼ばれる。 1s軌道は原子核に最も近い軌道であり、他の軌道が満たされる前に必ず最初に満たされる。 水素は電子を1個持っているので、1s軌道の中の1カ所だけが埋まっています。 これは1s1と呼ばれ、上付き文字の1は1s軌道にある1個の電子を意味します。 ヘリウムは電子を2個持っているので、1s軌道を2個の電子で完全に埋めることができる。 これを1s2(ヘリウムの2個の電子が1s軌道にあること)と呼ぶ。 周期表図4では、水素とヘリウムは1行目(周期)にある唯一の元素である。これは、水素とヘリウムが最初の殻である1s軌道にしか電子を持っていないためである。 水素とヘリウムは、電気的に中性な状態で1s軌道と他の電子軌道を持たない唯一の元素である
第2電子殻は8個の電子を含むことができる。 この殻には、図4に示すように、もう1つの球形のs軌道と3つの「ダンベル」型のp軌道があり、それぞれが2個の電子を保持することができる。 1s軌道が満たされた後、2番目の電子殻は、まず2s軌道が満たされ、次に3つのp軌道が満たされる。 p軌道を満たすとき、それぞれ1個の電子を取るが、各p軌道に電子が入れば、2個目を追加することができる。 リチウム(Li)には3個の電子があり、第1殻と第2殻を占有している。 2個の電子が1s軌道を満たし、3個目の電子が2s軌道を満たす。 その電子配置は1s22s1である。 一方、ネオンは、最内周の1s軌道に2個、第2殻に8個(2s軌道とp軌道に各2個)の合計10個の電子を持っており、不活性ガスでエネルギー的に安定で、他の原子と化学結合することはほとんどない。 大きな元素はさらに軌道を持ち、第3電子殻を構成している。 電子殻と軌道の概念は密接に関連していますが、軌道モデルでは、電子が占める可能性のあるすべての場所の異なる形状と特別な向きを指定するため、軌道は原子の電子配置をより正確に描写しています。 このビデオには音声がないことに注意してください。
「原子軌道-スカンジウムの電子配置」の音声解説テキストはこちら(新しいウィンドウで開きます)でご覧いただけます。
Video Review
このビデオでは、電子の概要をもうひとつ説明しています:
Try It
Contribute!
このページを改善するもっと知る
。