Principalul obiectiv al transplantului de pancreas este de a ameliora diabetul zaharat insulino-dependent (tip 1 sau tip 2) și de a obține independența completă față de insulina injectată. Transplantul simultan de pancreas și rinichi (SPK) (a se vedea imaginea de mai jos) este opțiunea principală în cazul în care pacientul are și nefropatie diabetică și se califică pentru includerea pe listă pentru un transplant de rinichi. Primul transplant reușit de pancreas uman împreună cu un transplant de rinichi a fost efectuat la Universitatea din Minnesota de către Dr. William Kelly și Dr. Richard Lilleheiat Universitatea din Minnesota. În 2015, în Statele Unite au fost efectuate 947 de transplanturi de pancreas.
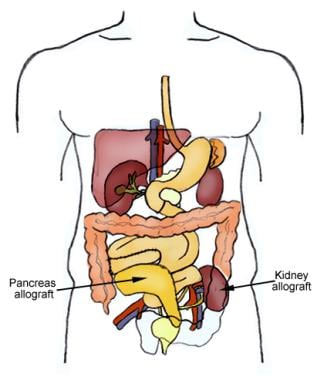 Plasarea alogrefei de rinichi-pancreas
Plasarea alogrefei de rinichi-pancreas Se estimează că 30,3 milioane de persoane – 9,4% din totalul populației Statelor Unite – suferă de diabet zaharat. Cu toate acestea, 1 din 4 adulți afectați nu știu că au diabet, iar din cei 84,1 milioane de adulți americani cu prediabet, doar 11,6% sunt conștienți de starea lor. Nefropatia diabetică este principala cauză a bolii cronice de rinichi în SUA și, în fiecare an, peste 50.000 de persoane dezvoltă o boală renală în stadiu terminal (ESRD) având ca principală cauză diabetul.
Acest articol se concentrează în principal pe transplantul de pancreas. Pentru o discuție completă despre transplantul de rinichi, vezi Transplantul renal pediatric și Transplantul renal.
Forme de transplant de pancreas
Un pancreas donat poate fi utilizat pentru terapia de substituție endocrină în unul dintre următoarele moduri:
1. Transplantul de pancreas singur (PTA): Indicat pentru pacienții cu diabet zaharat de tip 1 care prezintă episoade frecvente de hipoglicemie cu sau fără inconștiență, afectarea calității vieții sau alte probleme legate de toleranța la insulinoterapie. Acești pacienți au o funcție renală adecvată și nu este indicat transplantul de rinichi.
2. Transplantul de SPK: Organele provin de la același donator. Utilizarea primară a fost la pacienții cu diabet zaharat de tip 1 care au o rată de filtrare glomerulară estimată (eGFR) de 2</sup> sau sunt sub tratament de substituție renală.
3. Pancreas după transplant renal (PAK): Transplantul de pancreas de la donator decedat după un transplant renal anterior; indicațiile sunt similare cu cele pentru PTA
4. Transplantul de celule insulare pancreatice: Oferă o morbiditate mai mică, dar rezultate inferioare pe termen lung în comparație cu transplantul de organ solid (pancreas).
Aproximativ 80% din transplanturile de pancreas sunt efectuate ca transplant SPK. Aproximativ 10% dintre transplanturile de pancreas sunt efectuate ca transplant PAK după un transplant renal anterior de succes de la un donator viu sau decedat. Restul cazurilor sunt efectuate ca PTA. În 2015, în SUA au fost efectuate 80 de PTA-uri.
Transplantul de pancreas și cel de insule pot fi considerate opțiuni de transplant complementare, iar efectuarea unuia sau a celuilalt nu se exclude reciproc. Într-o analiză a 40 de transplanturi de pancreas (50% PTA, 27,5% SPK, 22,5% PAK) după eșecul grefei de transplant de celule de insule, ratele de supraviețuire generală (97% la 1 an și 83% la 5 ani) nu au fost afectate în mod negativ.
Testarea evaluării transplantului
În evaluarea unui pacient pentru transplantul de SPK, cuantificarea necesarului zilnic de insulină și a nivelurilor serice de C-peptidă la jeun sunt utilizate pentru a determina tipul de diabet prezent, severitatea rezistenței la insulină și beneficiul posibil al transplantului de pancreas. Un pacient foarte rezistent la insulină va avea un necesar ridicat de insulină (>1-1,5 unități/kg) și un nivel ridicat de C-peptidă la jeun (>4 ng/mL). Acești pacienți ar putea rămâne insulinodependenți în ciuda unui transplant de pancreas.
Cu toate acestea, aceste valori trebuie să fie luate în considerare în cadrul tabloului clinic general. De exemplu, un pacient care face dializă peritoneală cu dializat care conține dextroză va avea un necesar mai mare de insulină care va scădea odată ce transplantul de rinichi va elimina nevoia de dializă. C-peptidul nu este un marker exact la pacienții cu boală cronică de rinichi, deoarece are clearance variabil la acești pacienți. În plus, la un pacient care ia insulină, nivelul C-peptidei va fi fals scăzut dacă proba este prelevată atunci când pacientul este hipoglicemic; astfel, rezultatul C-peptidei trebuie interpretat în lumina unei măsurători concomitente a glucozei.
Ar trebui măsurată hemoglobina A1C, pentru a evalua severitatea diabetului pacientului.
Dacă pacientul are un diabet de tip 1, luați în considerare evaluarea inițială a markerilor autoimuni, inclusiv a anticorpilor împotriva acidului glutamic decarboxilază. O creștere a nivelului anticorpilor după transplantul de pancreas ar sugera o posibilă disfuncție a grefei de pancreas și hiperglicemie datorată unei reacții autoimune, spre deosebire de respingere.
Indicații și contraindicații
Numărul de transplanturi de pancreas a scăzut în fiecare an din 2004, când au fost efectuate aproximativ 1500; în 2016 au fost efectuate 181 de transplanturi de pancreas. Cel mai frecvent transplant multiorgan este cel de rinichi-pancreas, cu aproape 23.000 de transplanturi efectuate între 1988 și 2017. În 2016, au fost efectuate 795 de transplanturi de SPK. Pacienții cu diabet de tip 2 au reprezentat 12,5% din transplanturile de SPK.
Rețeaua United Network of Organ Sharing (UNOS) va înscrie pe listă un potențial candidat la transplantul de pancreas dacă pacientul îndeplinește unul dintre următoarele criterii de eligibilitate :
-
Insulino-dependent cu o C-peptidă de 2 ng/mL sau mai puțin (pacienți cu diabet de tip 1)
-
Insulino-dependent cu o C-peptidă de 2 ng/mL sau mai puțin (pacienți cu diabet de tip 1).peptidă mai mare de 2 ng/mL și un indice de masă corporală 2</sup> (pacienți prezumtivi cu diabet de tip 2)
Clinicianul trebuie să fie conștient de tabloul clinic atunci când interpretează aceste valori, așa cum s-a menționat mai sus.Utilizarea C-peptidei C este controversată.
Cele de mai jos sunt criteriile pentru tipul specific de transplant de pancreas:
-
PTA – Complicații metabolice frecvente, acute, inclusiv hipoglicemie sau cetoacidoză, incapacitatea de a tolera terapia cu insulină exogenă, și persistența complicațiilor acute în ciuda tratamentului bazat pe insulină
-
SPK – ESRD și eligibilitate pentru transplant de pancreas
-
PAK – Eligibilitatea pentru transplantul de pancreas și un transplant renal anterior de succes
Pacientul eligibil va trebui, de asemenea, să fie supus unei evaluări medicale adecvate, în special pentru stratificarea riscului cardiovascular și a bolii vasculare periferice. De asemenea, aceștia vor trebui să prezinte un istoric de complianță medicală. Limita de vârstă istorică pentru transplantul de pancreas, pe care unele centre au continuat să o folosească, este de 55 de ani. Cu toate acestea, numărul beneficiarilor de transplant de pancreas cu vârsta mai mare de 55 de ani a crescut în mod constant. În 2016, 24,5% dintre toți beneficiarii de transplant de pancreas au fost mai în vârstă de 50 de ani (PTA: 38,3%, SPK: 22,7%, PAK: 25,7%). Supraviețuirea pacienților este comparabilă în cazul receptorilor de transplant de pancreas mai tineri și mai în vârstă, dar receptorii mai în vârstă au avut evenimente cardiovasculare mai frecvente.
Contraindicațiile absolute, după cum urmează, sunt similare cu cele pentru alte transplanturi de organe solide:
-
Risc cardiovascular excesiv
-
Afecțiuni maligne active sau infecții care ar trebui să fie tratate și eliminate înainte de transplant
-
Factori de risc social ridicat, cum ar fi nerespectarea tratamentului medicamentos, lipsa asigurării și consumul de droguri ilicite
Contraindicațiile corelative includ următoarele:
-
Indicele de masă corporală peste 30 kg/m 2
-
Necesar de insulină de >1.5 U/kg pe zi
-
Boală cerebrovasculară, aortică/iliacă, cardiovasculară sau vasculară periferică
Beneficii ale transplantului de pancreas
Complicațiile microvasculare ale diabetului sunt direct legate de concentrația de glucoză. Astfel, ar putea fi de așteptat ca normalizarea glucozei prin transplantul de pancreas reușit să stabilizeze sau să inverseze complicațiile microvasculare. Beneficiile rezultate în urma transplantului de pancreas și de rinichi sunt discutate mai jos.
Retinopatia diabetică
Majoritatea candidaților la transplantul de pancreas au avut diabet timp de 20-25 de ani în medie înainte de a fi luați în considerare pentru transplant și, în consecință, mulți dintre ei au fost operați cu laser pentru retinopatie. Aceasta a fost o constatare comună peritransplant în majoritatea studiilor. Gravitatea acestor modificări oftalmologice poate anula un efect salutar clar al transplantului de PTA sau SPK asupra retinopatiei.
Studiile sugerează, totuși, că retinopatia se poate ameliora la 3 ani după SPK și că nevoia de intervenții chirurgicale ulterioare cu laser este mai mică după SPK decât după transplantul renal singur (KTA). Se crede că transplantul de pancreas și menținerea unei stări de euglicemie cel puțin stabilizează retinopatia diabetică. Sunt necesare studii prospective pentru a compara cele două grupuri, deoarece majoritatea studiilor nu au avut suficiente grupuri de control.
Nefropatie diabetică
Un număr semnificativ de candidați la transplant de pancreas au boală renală avansată. Cel mai frecvent scenariu pentru transplantul de pancreas este în combinație cu un transplant de rinichi pentru a trata pacienții cu uremie diabetică. SPK ar contribui la prevenirea efectelor nocive ale diabetului asupra noului transplant renal.
Studiile care au comparat funcția renală la beneficiarii de transplant SPK față de beneficiarii de KTA diabetici nu au demonstrat diferențe semnificative în perioada posttransplant timpurie. Cu toate acestea, nefropatia diabetică recurentă este observată încă de la 2 ani după KTA la un primitor diabetic sau la eșecul grefei de pancreas după SPK, dar nu a fost niciodată raportată la un transplant SPK funcțional. S-a demonstrat că pacienții cu un transplant de pancreas prezintă o progresie întârziată sau o inversare a nefropatiei diabetice.
Neuropatia diabetică
Neuropatia se ameliorează atât după transplantul de rinichi, cât și după cel de pancreas, sugerând că insuficiența renală și diabetul contribuie la neuropatia senzorială frecvent observată în momentul transplantului. Neuropatiile autonome, cum ar fi gastropareza, au nevoie de ani pentru a se dezvolta și pot fi dificil de cuantificat. Cu toate acestea, a fost raportată o ameliorare obiectivă a constatărilor neuropatice autonome la 4 ani după SPK și se observă că aceasta este mai mare după SPK decât după KTA.
Retinopatia diabetică
Retinopatia diabetică este o constatare omniprezentă la pacienții cu diabet și ESRD. Se poate observa o pierdere semnificativă a vederii/cearcăn. Orbirea nu este o contraindicație absolută pentru transplant, deoarece mulți pacienți orbi duc o viață foarte independentă.
Boala cardiovasculară
Boala cardiovasculară este cea mai frecventă cauză de deces la pacienții cu diabet cu insuficiență renală. Puține studii prospective au examinat relația dintre stabilirea normoglicemiei la pacienții cu diabet pe termen lung și reducerea morbidității și mortalității cardiovasculare. Într-un studiu transversal, fracția de ejecție a ventriculului stâng a fost mai mare, raportul dintre rata maximă de umplere și rata maximă de ejecție a fost mai mare, iar dilatarea dependentă de endoteliu a arterei brahiale a fost îmbunătățită la pacienții care au primit SPK în comparație cu pacienții cu diabet de tip 1 care au primit KTA. Alte dovezi arată că transplantul SPK reduce ratele de deces cardiovascular cu reducerea concomitentă a tensiunii arteriale.
Un alt studiu a observat o scădere mai mare a masei ventriculare stângi și o normalizare mai mare a disfuncției diastolice la beneficiarii de SPK decât la cei care au fost supuși KTA. În acest raport, ecocardiografia bidimensională (2-D) și în modul M a fost efectuată înainte și la 1 an după transplant la beneficiarii SPK și KTA. Un studiu retrospectiv de mare amploare a sugerat o asociere cu reduceri ale incidenței infarctului miocardic, a edemului pulmonar acut și a hipertensiunii arteriale la beneficiarii de SPK față de cei de KTA.
Boala arterială coronariană (CAD) este cea mai importantă comorbiditate care trebuie luată în considerare la pacienții cu diabet zaharat de tip 1 și nefropatie diabetică. Se estimează că pacienții cu diabet și ESRD prezintă un risc de 50 de ori mai mare de evenimente cardiovasculare decât populația generală. Prevalența CAD semnificativă (>50% stenoză) la pacienții cu diabet care încep tratamentul pentru ESRD este estimată la 45-55%. Din cauza neuropatiei diabetice, este posibil ca pacienții să nu resimtă angina pectorală în timpul episoadelor de ischemie miocardică.
Actul vascular cerebral și atacul ischemic tranzitoriu
Pacienții cu ESRD și diabet zaharat au o rată crescută de accidente vasculare cerebrale și atacuri ischemice tranzitorii. Decesele legate de boala vasculară cerebrală la pacienții cu ESRD sunt aproximativ de două ori mai frecvente la cei cu diabet decât la cei fără diabet. Accidentele vasculare cerebrale se produc mai frecvent și la o vârstă mai tânără la pacienții cu diabet decât la pacienții non-diabetici de aceeași vârstă și sex.
Boala vasculară periferică
Boala vasculară periferică a extremităților inferioare este semnificativă la pacienții cu diabet. Pacienții cu ESRD sunt expuși riscului de amputare a unui membru inferior. Aceste probleme încep de obicei cu un ulcer al piciorului asociat cu neuropatia somatosenzorială avansată.
Nevropatie autonomă
Nevropatia autonomă este prevalentă și se poate manifesta ca gastropatie, cistopatie și hipotensiune ortostatică. Amploarea neuropatiei autonome diabetice este adesea subestimată.
Vacuarea gastrică deficitară (gastropareză) este un aspect important de luat în considerare din cauza implicațiilor sale semnificative pentru evoluția posttransplant. Pacienții cu gastropareză severă pot avea dificultăți în tolerarea medicamentelor imunosupresoare orale care sunt esențiale pentru a preveni respingerea organelor transplantate. Episoadele de depleție de volum cu azotemie asociată apar frecvent la pacienții cu transplant de SPK. Morbiditatea gastrointestinală este o indicație frecventă de reinternare în urma transplantului de pancreas.
Disfuncția vezicală neurogenă este un aspect important de luat în considerare la pacienții supuși transplantului de pancreas cu drenaj vezical sau transplantului SPK. Incapacitatea de a simți plenitudinea vezicii urinare și de a goli vezica predispune la reziduuri postmicționale ridicate și la posibilitatea de reflux vezico-ureteral. Acest lucru poate afecta negativ funcția alogrefei renale, poate crește incidența infecțiilor vezicale și a pielonefritei și poate predispune la pancreatită de grefă.
Combinația de hipotensiune ortostatică și hipertensiune în poziție culcată rezultă din dereglarea tonusului vascular. Acest lucru are implicații pentru controlul tensiunii arteriale în urma transplantului, în special la pacienții cu transplant de pancreas drenat de vezica urinară, care sunt predispuși la depleție de volum. Prin urmare, este importantă o reevaluare atentă a necesarului de medicație antihipertensivă posttransplant.
Neuropatii senzoriale și motorii
Aceste afecțiuni sunt frecvente la pacienții cu diabet de lungă durată. Acest lucru poate avea implicații pentru reabilitarea după transplant. Neuropatia periferică este, de asemenea, un indicator pentru riscul crescut de rănire a picioarelor și ulcerele ulterioare ale piciorului diabetic.
Boli mentale sau emoționale
Boli mentale, inclusiv nevroza și depresia, sunt frecvente în populația diabetică insulino-dependentă. Diagnosticarea și tratamentul adecvat al acestor boli înainte de obținerea unui transplant de pancreas poate îmbunătăți semnificativ complianța medicală.
Rezultate
Evaluarea ratelor de rezultate ale grefei de pancreas a fost îngreunată de lipsa de uniformitate în ceea ce privește criteriile de eșec al grefei. Unele programe nu raportează un eșec al grefei dacă producția de C-peptidă continuă, în timp ce altele raportează un eșec al grefei dacă primitorul nu mai este independent de insulină. Comitetul pentru transplant de pancreas OPTN/UNOS a propus următoarele definiții mai precise pentru eșecul grefei de pancreas, care sunt în prezent în curs de implementare :
-
Îndepărtarea pancreasului transplantat
-
Reînregistrarea pentru un transplant de pancreas
-
Înregistrarea pentru un transplant de insule după primirea unui transplant de pancreas
-
Utilizarea de insulină de ≥0.5 unități/kg/zi timp de 90 de zile consecutiveDecesul receptorului
Numărul de receptori în viață cu o alogrefă de pancreas funcțională a continuat să crească în ultimul deceniu și a depășit 18.000 în 2016. Mortalitatea a scăzut în mod constant în rândul tuturor grupurilor de transplant de pancreas ca urmare a unor regimuri imunosupresoare mai sigure și mai eficiente. Mortalitatea la un an pentru PTA a scăzut de la 4,6% în 2012-2013 la 0,8% pentru transplanturile efectuate în 2014-2015. Pentru SPK, ratele de supraviețuire a pacienților la 5 ani au fost similare la pacienții cu diabet de tip 1 și de tip 2 (90,5% și, respectiv, 91,5%), în ciuda vârstei mai înaintate și a comorbidității asociate cu diabetul de tip 2. Acest lucru se datorează probabil selecției candidaților cu diabet de tip 2 a căror stare cardiovasculară poate tolera riscurile operatorii ridicate.
Cel mai mare risc de pierdere a grefei este în primul an post-transplant și în special în primele 3 luni, indiferent de tipul de transplant de pancreas. Analizele datelor Registrului Internațional de Transplant de Pancreas au utilizat independența față de insulină ca principal criteriu pentru supraviețuirea grefei. Cele mai bune rate de supraviețuire a grefei de pancreas din transplantul SPK au fost de 86% la un an și de 73% la 5 ani. Rezultatele SPK sunt superioare celor obținute cu transplantul PAK și PTA. Un avantaj al transplantului SPK este că respingerea acută poate fi detectată mai ușor, deoarece creatinina serică poate fi utilizată ca marker.
În cazul transplantului PAK, ratele de supraviețuire a grefei de pancreas la 1 an și la 5 ani sunt de 80% și, respectiv, 58%. Pentru PTA, ratele comparabile sunt de 77% și 56%.
Ratele de respingere acută sunt similare pentru SPK și PAK, de aproximativ 4% pentru fiecare. Timpul de înjumătățire estimat al grefelor s-a îmbunătățit de-a lungul anilor, SPK durând aproximativ 14 ani, PAK 7 ani și PTA 7 ani.