Definition: Batteriet, der anvender svampebly og blyperoxid til omdannelse af den kemiske energi til elektrisk energi, en sådan type batteri kaldes et blysyrebatteri. Blysyrebatteriet anvendes oftest i kraftværker og understationer, fordi det har højere cellespænding og lavere omkostninger.
Blybatteriets opbygning
Den forskellige dele af blybatteriet er vist nedenfor. Beholderen og pladerne er hovedparten af blysyrebatteriet. Beholderen lagrer kemisk energi, som omdannes til elektrisk energi ved hjælp af pladerne.
1. Beholder – Blysyrebatteriets beholder er fremstillet af glas, blyforet træ, ebonit, hård gummi af bituminøs forbindelse, keramiske materialer eller formstøbt plast og sidder øverst for at undgå udledning af elektrolyt. I bunden af beholderen er der fire ribber, på to af dem hviler den positive plade, og de andre støtter de negative plader.
Prismaet tjener som støtte for pladerne og beskytter dem samtidig mod kortslutning.Det materiale, som batteribeholderne er fremstillet af, skal være modstandsdygtigt over for svovlsyre, må ikke deformere eller være porøst eller indeholde urenheder, der skader elektrolytten.
2. Plade – Pladen i blybattericellen er af forskellig udformning, og de består alle i en eller anden form af et gitter, som består af bly og det aktive materiale. Gitteret er vigtigt for at lede den elektriske strøm og for at fordele strømmen ligeligt på det aktive materiale. Hvis strømmen ikke er jævnt fordelt, vil det aktive materiale løsne sig og falde ud.
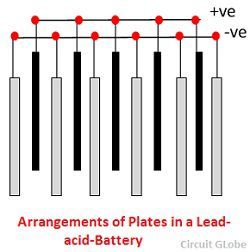 Gitterne er fremstillet af en legering af bly og antimon. De er normalt fremstillet med tværribben, der krydser stederne i en ret vinkel eller diagonalt. Gitteret til de positive og negative plader er af samme konstruktion, men gitteret til de negative plader er lavet lettere, fordi de ikke er så vigtige for den ensartede ledning af strømmen.
Gitterne er fremstillet af en legering af bly og antimon. De er normalt fremstillet med tværribben, der krydser stederne i en ret vinkel eller diagonalt. Gitteret til de positive og negative plader er af samme konstruktion, men gitteret til de negative plader er lavet lettere, fordi de ikke er så vigtige for den ensartede ledning af strømmen.
Batteriets plader er af to typer. De er de formede plader eller planteplader og de klæbede eller faureplader.
Planteplader anvendes i vid udstrækning til stationære batterier, da disse er tungere i vægt og dyrere end de klæbede plader. Men pladerne er mere holdbare og mindre tilbøjelige til at miste aktivt materiale ved hurtig opladning og afladning. Plantes plader har et lavt kapacitetsvægt-forhold.
Faure-processen er meget velegnet til fremstilling af negative plader frem for positive plader. Det negative aktive materiale er ret sejt, og det undergår en forholdsvis lille ændring ved opladning og afladning.
3. Aktivt materiale – Det materiale i en celle, der deltager aktivt i en kemisk reaktion (optagelse eller udvikling af elektrisk energi) under opladning eller afladning, kaldes cellens aktive materiale. De aktive elementer i blysyre er
- Blyperoxid (PbO2) – Det danner det positive aktive materiale. PbO2 har en mørk chokoladebroget farve.
- Svampebly – Det udgør det negative aktive materiale. Det er gråt i farven.
- Fortyndet svovlsyre (H2SO4) – Det bruges som elektrolyt. Den indeholder 31 % svovlsyre.
Blyperoxid og svampebly, som udgør det negative og positive aktive materiale, har den lille mekaniske styrke og kan derfor anvendes alene.
4. Separatorer – Separatorerne er tynde plader af ikke-ledende materiale bestående af kemisk behandlet blytræ, porøst gummi eller måtter af glasfiber og placeres mellem det positive og det negative for at isolere dem fra hinanden. Separatorerne er rillet lodret på den ene side og er glatte på den anden side.
5. Batteriklemmer – Et batteri har to poler, den positive og den negative. Den positive terminal med en diameter på 17,5 mm i toppen er lidt større end den negative terminal, som har en diameter på 16 mm.
Blybatteriets funktionsprincip
Når svovlsyre opløses, splittes dens molekyler op i positive brint-ioner (2H+) og negative sulfat-ioner (SO4-) og bevæger sig frit. Hvis de to elektroder er nedsænket i opløsningerne og tilsluttet en jævnstrømsforsyning, bliver hydrogenionerne positivt ladet og bevæger sig mod elektroderne og tilsluttes forsyningens negative terminal. SO4-ionerne, der er negativt ladede, bevæger sig mod elektroderne, der er forbundet til den positive terminal af hovedforsyningen (dvs, anode).
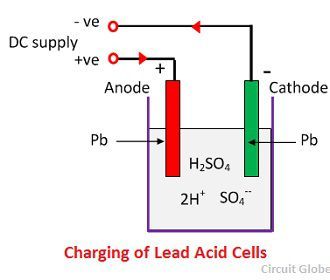 Hver hydrogenion tager en elektron fra katoden, og hver sulfat-ion tager de to negative ioner fra anoderne og reagerer med vand og danner svovl- og brintsyre.
Hver hydrogenion tager en elektron fra katoden, og hver sulfat-ion tager de to negative ioner fra anoderne og reagerer med vand og danner svovl- og brintsyre.
Den ilt, som dannes ud fra ovenstående ligning, reagerer med blyoxid og danner blyperoxid (PbO2.) Under opladning forbliver blykatoden således som bly, men blyanoden omdannes til blyperoxid, der har chokoladefarve.
Hvis jævnstrømskilden frakobles, og hvis voltmeteret tilsluttes mellem elektroderne, vil det vise potentialforskellen mellem dem. Hvis en ledning forbinder elektroderne, vil strømmen flyde fra den positive plade til den negative plade gennem et eksternt kredsløb, dvs. cellen er i stand til at levere elektrisk energi.
Kemisk virkning under afladning
Når cellen er fuldt afladet, er anoden af blyperoxid (PbO2) og en katode af metallisk svampebly (Pb). Når elektroderne forbindes gennem en modstand, aflader cellen, og elektronerne strømmer i modsat retning af den retning, der er gældende under opladning.
Væstofionerne bevæger sig til anoden og når de anoderne modtager en elektron fra anoden og bliver til et hydrogenatom. Brintatomet kommer i kontakt med en PbO2, så det angriber og danner blysulfat (PbSO4), hvidlig i farven og vand i henhold til den kemiske ligning.
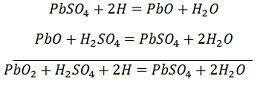
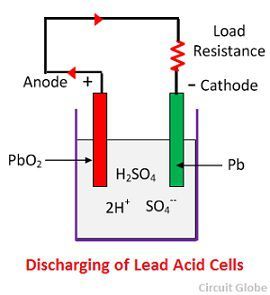 Den enkelte sulfation (SO4-) bevæger sig mod katoden og når dertil og afgiver to elektroner bliver til radikal SO4, angriber den metalliske blykatode og danner blysulfat, hvidlig i farven i henhold til den kemiske ligning.
Den enkelte sulfation (SO4-) bevæger sig mod katoden og når dertil og afgiver to elektroner bliver til radikal SO4, angriber den metalliske blykatode og danner blysulfat, hvidlig i farven i henhold til den kemiske ligning.
Kemisk virkning under genopladning
Til genopladning er anoden og katoden forbundet til den positive og den negative terminal af jævnstrømsnettet. Svovlsyremolekylerne opløses til ioner af 2H+ og SO4-. Brintionerne, der er positivt ladede, bevæger sig mod katoderne og modtager to elektroner derfra og danner et brintatom. Brintatomet reagerer med blysulfatkatoden og danner bly og svovlsyre i henhold til den kemiske ligning.
![]()
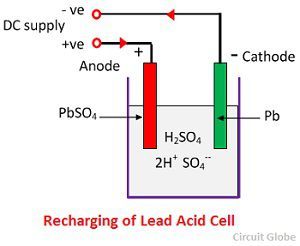 SO4-ionen bevæger sig til anoden, afgiver sine to ekstra elektroner og bliver til SO4-radikalet, reagerer med blysulfatanoden og danner blyperoxid og blysvovlsyre i henhold til den kemiske ligning.
SO4-ionen bevæger sig til anoden, afgiver sine to ekstra elektroner og bliver til SO4-radikalet, reagerer med blysulfatanoden og danner blyperoxid og blysvovlsyre i henhold til den kemiske ligning.![]() Ladningen og afladningen er repræsenteret ved en enkelt reversibel ligning, der er givet nedenfor.
Ladningen og afladningen er repræsenteret ved en enkelt reversibel ligning, der er givet nedenfor.
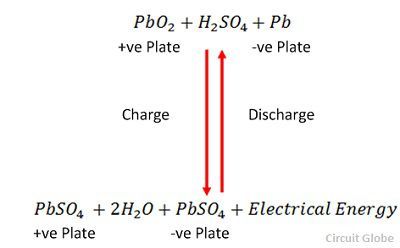 Ligningen skal læses nedad for afladning og opad for genopladning.
Ligningen skal læses nedad for afladning og opad for genopladning.