Définition : La batterie qui utilise du plomb spongieux et du peroxyde de plomb pour la conversion de l’énergie chimique en énergie électrique, ce type de batterie est appelé batterie plomb-acide. La batterie plomb-acide est le plus souvent utilisée dans les centrales électriques et les sous-stations parce qu’elle a une tension de cellule plus élevée et un coût inférieur.
Construction de la batterie plomb-acide
Les différentes parties de la batterie plomb-acide sont présentées ci-dessous. Le conteneur et les plaques constituent la partie principale de la batterie plomb-acide. Le conteneur stocke l’énergie chimique qui est convertie en énergie électrique à l’aide des plaques.
1. Conteneur – Le conteneur de la batterie plomb-acide est fait de verre, de bois doublé de plomb, d’ébonite, du caoutchouc dur du composé bitumineux, de matériaux céramiques ou de plastiques moulés et sont assis en haut pour éviter la décharge de l’électrolyte. Au fond du conteneur, il y a quatre nervures, sur deux d’entre elles repose la plaque positive et les autres soutiennent les plaques négatives.
Le prisme sert de support aux plaques et les protège en même temps d’un court-circuit.Le matériau dont sont faits les conteneurs de la batterie doit être résistant à l’acide sulfurique, ne doit pas se déformer ni être poreux, ni contenir des impuretés qui endommagent l’électrolyte.
2. Plaque – La plaque de la cellule plomb-acide est de conception diverse et elles consistent toutes en une forme de grille qui est composée de plomb et de la matière active. La grille est essentielle pour conduire le courant électrique et pour distribuer le courant de manière égale sur la matière active. Si le courant n’est pas distribué uniformément, alors la matière active se détache et tombe.
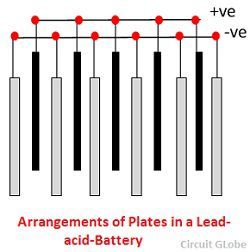 Les grilles sont constituées d’un alliage de plomb et d’antimoine. Elles sont généralement réalisées avec la nervure transversale qui traverse les places à angle droit ou en diagonale. La grille des plaques positives et négatives sont de même conception, mais les grilles des plaques négatives sont faites plus légères car elles ne sont pas aussi essentielles pour la conduction uniforme du courant.
Les grilles sont constituées d’un alliage de plomb et d’antimoine. Elles sont généralement réalisées avec la nervure transversale qui traverse les places à angle droit ou en diagonale. La grille des plaques positives et négatives sont de même conception, mais les grilles des plaques négatives sont faites plus légères car elles ne sont pas aussi essentielles pour la conduction uniforme du courant.
Les plaques de la batterie sont de deux types. Ce sont les plaques formées ou plaques de plante et les plaques collées ou plaques de faure.
Les plaques de Plante sont largement utilisées pour les batteries stationnaires car elles sont plus lourdes en poids et plus coûteuses que les plaques collées. Mais ces plaques sont plus durables et moins susceptibles de perdre de la matière active par des charges et des décharges rapides. La plaque végétale a un faible rapport poids capacité.
Le procédé Faure est beaucoup plus adapté à la fabrication des plaques négatives que des plaques positives. La matière active négative est assez résistante, et elle subit un changement comparativement faible de la charge et de la décharge.
3. Matière active – La matière dans une cellule qui prend une participation active dans une réaction chimique (absorption ou évolution de l’énergie électrique) pendant la charge ou la décharge est appelée la matière active de la cellule. Les éléments actifs de l’acide de plomb sont
- Le peroxyde de plomb (PbO2) – Il forme la matière active positive. Les PbO2 sont de couleur balai chocolat foncé.
- Le plomb spongieux – Il forme la matière active négative. Il est de couleur grise.
- Acide sulfurique dilué (H2SO4) – Il est utilisé comme électrolyte. Il contient 31% d’acide sulfurique.
Le peroxyde de plomb et le plomb spongieux, qui forment les matières actives négatives et positives ont le peu de résistance mécanique et peuvent donc être utilisés seuls.
4. Séparateurs – Les séparateurs sont de fines feuilles de matériaux non conducteurs constitués de bois de plomb traité chimiquement, de caoutchoucs poreux ou de tapis de fibres de verre et sont placés entre le positif et le négatif pour les isoler l’un de l’autre. Les séparateurs sont rainurés verticalement sur un côté et sont lisses sur l’autre côté.
5. Bornes de la batterie – Une batterie a deux bornes le positif et le négatif. La borne positive d’un diamètre de 17,5 mm en haut est légèrement plus grande que la borne négative qui a un diamètre de 16 mm.
Principe de fonctionnement de la batterie plomb-acide
Lorsque l’acide sulfurique se dissout, ses molécules se décomposent en ions positifs d’hydrogène (2H+) et en ions négatifs de sulfate (SO4-) et se déplacent librement. Si les deux électrodes sont immergées dans les solutions et connectées à une alimentation en courant continu, les ions hydrogène, chargés positivement, se déplacent vers les électrodes et sont connectés à la borne négative de l’alimentation. Les ions SO4- étant chargés négativement se sont déplacés vers les électrodes connectées à la borne positive de l’alimentation principale (c’est-à-dire, anode).
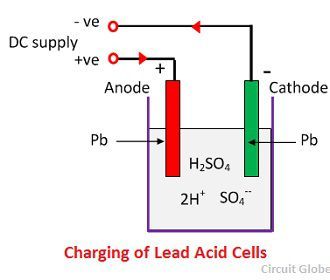 Chaque ion hydrogène prend un électron de la cathode, et chaque ion sulfate prend les deux ions négatifs des anodes et réagit avec l’eau et forme de l’acide sulfurique et de l’acide hydrogène.
Chaque ion hydrogène prend un électron de la cathode, et chaque ion sulfate prend les deux ions négatifs des anodes et réagit avec l’eau et forme de l’acide sulfurique et de l’acide hydrogène.
L’oxygène, qui est produit à partir de l’équation ci-dessus réagit avec l’oxyde de plomb et forme du peroxyde de plomb (PbO2.) Ainsi, pendant la charge, la cathode de plomb reste en plomb, mais l’anode de plomb se transforme en peroxyde de plomb, de couleur chocolat.
Si la source d’alimentation en courant continu est déconnectée et si le voltmètre se connecte entre les électrodes, il montrera la différence de potentiel entre elles. Si un fil relie les électrodes, alors le courant circulera de la plaque positive à la plaque négative à travers le circuit externe c’est-à-dire que la cellule est capable de fournir de l’énergie électrique.
Action chimique pendant la décharge
Lorsque la cellule est à pleine décharge, alors l’anode est en peroxyde de plomb (PbO2) et une cathode est en plomb éponge métallique (Pb). Lorsque les électrodes sont reliées par une résistance, la cellule se décharge et les électrons circulent dans une direction opposée à celle de la charge.
Les ions d’hydrogène se déplacent vers l’anode et atteignant les anodes reçoivent un électron de l’anode et deviennent atome d’hydrogène. L’atome d’hydrogène entre en contact avec un PbO2, donc il attaque et forme du sulfate de plomb (PbSO4), de couleur blanchâtre et de l’eau selon l’équation chimique.
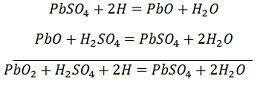
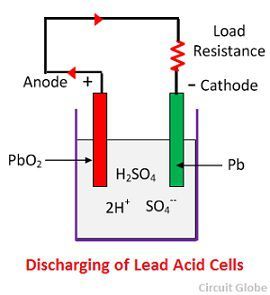 Chaque ion sulfate (SO4-) se déplace vers la cathode et y arrivant cède deux électrons devient radical SO4, attaque la cathode de plomb métallique et forme du sulfate de plomb de couleur blanchâtre selon l’équation chimique.
Chaque ion sulfate (SO4-) se déplace vers la cathode et y arrivant cède deux électrons devient radical SO4, attaque la cathode de plomb métallique et forme du sulfate de plomb de couleur blanchâtre selon l’équation chimique.
Action chimique pendant la recharge
Pour la recharge, l’anode et la cathode sont connectées à la borne positive et à la borne négative du réseau d’alimentation en courant continu. Les molécules de l’acide sulfurique se décomposent en ions de 2H+ et de SO4-. Les ions d’hydrogène, chargés positivement, se déplacent vers les cathodes et reçoivent deux électrons de celles-ci pour former un atome d’hydrogène. L’atome d’hydrogène réagit avec la cathode de sulfate de plomb formant du plomb et de l’acide sulfurique selon l’équation chimique.
![]()
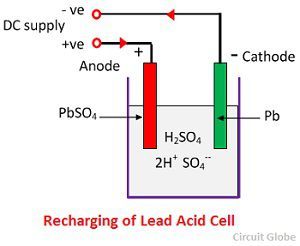 L’ion SO4- se déplace vers l’anode, abandonne ses deux électrons supplémentaires devient le radical SO4, réagit avec l’anode de sulfate de plomb et forme du peroxyde de plomb et de l’acide sulfurique de plomb selon l’équation chimique.
L’ion SO4- se déplace vers l’anode, abandonne ses deux électrons supplémentaires devient le radical SO4, réagit avec l’anode de sulfate de plomb et forme du peroxyde de plomb et de l’acide sulfurique de plomb selon l’équation chimique.![]() La charge et la décharge sont représentées par une seule équation réversible donnée ci-dessous.
La charge et la décharge sont représentées par une seule équation réversible donnée ci-dessous.
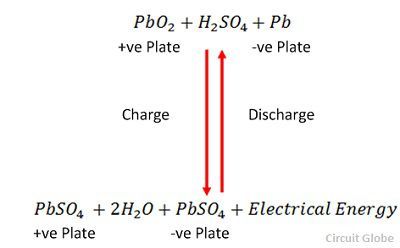 L’équation doit se lire vers le bas pour la décharge et vers le haut pour la recharge.
L’équation doit se lire vers le bas pour la décharge et vers le haut pour la recharge.
.