Määritelmä: Akkua, joka käyttää sienen lyijyä ja lyijyperoksidia kemiallisen energian muuntamiseen sähköenergiaksi, tällaista akkutyyppiä kutsutaan lyijyhappoakuksi. Lyijyhappoakkua käytetään yleisimmin voimalaitoksissa ja sähköasemilla, koska sen kennojännite on korkeampi ja kustannukset alhaisemmat.
Lyijyhappoakun rakenne
Lyijyhappoakun eri osat on esitetty alla. Säiliö ja levyt ovat lyijyakun tärkein osa. Säiliö varastoi kemiallista energiaa, joka muutetaan sähköenergiaksi levyjen avulla.
1. Säiliö – Lyijyhappoakun säiliö on valmistettu lasista, lyijyllä vuoratusta puusta, eboniitista, bitumikumin kovakumista, keraamisista materiaaleista tai valetuista muoveista, ja se istutetaan yläosaan elektrolyytin purkautumisen estämiseksi. Säiliön pohjassa on neljä kylkiluuta, joista kahden päällä lepää positiivinen levy ja muut tukevat negatiivisia levyjä.
Prisma toimii levyjen tukena ja samalla suojaa niitä oikosululta.Materiaalin, josta akkujen säiliöt on valmistettu, on kestettävä rikkihappoa, se ei saa deformoitua tai olla huokoinen tai sisältää epäpuhtauksia, jotka vahingoittavat elektrolyyttiä.
2. Levy – Lyijyakun kennon levy on rakenteeltaan moninainen, ja ne kaikki koostuvat jossakin muodossa säleiköstä, joka muodostuu lyijystä ja aktiivisesta materiaalista. Ristikko on välttämätön sähkövirran johtamiseksi ja virran jakamiseksi tasaisesti aktiiviselle materiaalille. Jos virta ei jakaudu tasaisesti, aktiivinen materiaali löystyy ja putoaa pois.
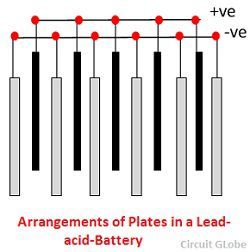 Ristikot koostuvat lyijyn ja antimonin seoksesta. Niissä on yleensä poikittainen kylkiluu, joka ylittää paikat suorassa kulmassa tai vinosti. Positiivisten ja negatiivisten levyjen ritilät ovat rakenteeltaan samanlaisia, mutta negatiivisten levyjen ritilät on tehty kevyemmiksi, koska ne eivät ole yhtä välttämättömiä virran tasaisen johtamisen kannalta.
Ristikot koostuvat lyijyn ja antimonin seoksesta. Niissä on yleensä poikittainen kylkiluu, joka ylittää paikat suorassa kulmassa tai vinosti. Positiivisten ja negatiivisten levyjen ritilät ovat rakenteeltaan samanlaisia, mutta negatiivisten levyjen ritilät on tehty kevyemmiksi, koska ne eivät ole yhtä välttämättömiä virran tasaisen johtamisen kannalta.
Pariston levyjä on kahdenlaisia. Ne ovat muotoillut levyt eli Plante-levyt ja liimatut eli Faure-levyt.
Plante-levyjä käytetään enimmäkseen paikallaan olevissa akuissa, koska ne ovat painavampia ja kalliimpia kuin liimatut levyt. Levyt ovat kuitenkin kestävämpiä ja menettävät vähemmän aktiivista materiaalia nopeassa latauksessa ja purkauksessa. Planten levyillä on alhainen kapasiteetin painosuhde.
Faure-prosessi soveltuu paljon paremmin negatiivisten levyjen kuin positiivisten levyjen valmistukseen. Negatiivinen aktiivinen materiaali on melko sitkeää, ja se muuttuu verrattain vähän latauksen ja purkauksen aikana.
3. Aktiivinen materiaali – Kennon materiaalia, joka osallistuu aktiivisesti kemialliseen reaktioon (sähköenergian imeytyminen tai kehittyminen) latauksen tai purkauksen aikana, kutsutaan kennon aktiiviseksi materiaaliksi. Lyijyhapon aktiiviset aineet ovat
- Lyijyperoksidi (PbO2) – Se muodostaa positiivisen aktiivisen aineen. PbO2 on väriltään tumman suklaaluudan väristä.
- Sienipitoinen lyijy – Sen muodostaa negatiivisen aktiivisen aineen. Se on väriltään harmaata.
- Laimea rikkihappo (H2SO4) – Sitä käytetään elektrolyyttinä. Se sisältää 31 % rikkihappoa.
Negatiivisen ja positiivisen aktiivisen materiaalin muodostavat lyijyperoksidi ja sienimäinen lyijy, joiden mekaaninen lujuus on vähäinen ja siksi niitä voidaan käyttää yksinään.
4. Erotinelementit – Erotinelementit ovat ohuita ei-johtavan materiaalin levyjä, jotka on valmistettu kemiallisesti käsitellystä lyijypuusta, huokoisesta kumista tai lasikuitumattojen muodostamasta materiaalista, ja ne asetetaan positiivisen ja negatiivisen materiaalin väliin eristääkseen ne toisistaan. Erotinlevyt on uritettu pystysuoraan toiselta puolelta ja sileä toiselta puolelta.
5. Akun liittimet – Akussa on kaksi liitintä, positiivinen ja negatiivinen. Positiivinen napa, jonka halkaisija on ylhäällä 17,5 mm, on hieman suurempi kuin negatiivinen napa, jonka halkaisija on 16 mm.
Lyijyakun toimintaperiaate
Kun rikkihappo liukenee, sen molekyylit hajoavat positiivisiksi vetyioneiksi (2H+) ja sulfaatin negatiivisiksi ioneiksi (SO4-) ja liikkuvat vapaasti. Jos kaksi elektrodia upotetaan liuoksiin ja kytketään tasavirtalähteeseen, vetyionit ovat positiivisesti varautuneita ja liikkuvat kohti elektrodeja, jotka on kytketty syötön negatiiviseen napaan. SO4-ionit, jotka ovat negatiivisesti varautuneita, liikkuvat kohti elektrodeja, jotka on liitetty syöttöverkon positiiviseen päätelaitteeseen (ts, anodi).
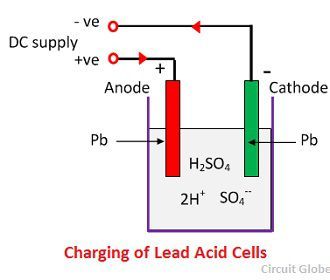 Jokainen vetyioni ottaa yhden elektronin katodilta ja kukin sulfaatti-ioni ottaa kaksi negatiivista ionia anodeilta ja reagoi veden kanssa muodostaen rikki- ja vetyhappoa.
Jokainen vetyioni ottaa yhden elektronin katodilta ja kukin sulfaatti-ioni ottaa kaksi negatiivista ionia anodeilta ja reagoi veden kanssa muodostaen rikki- ja vetyhappoa.
Happi, joka syntyy edellä esitetyn yhtälön perusteella reagoi lyijyoksidin kanssa muodostaen lyijyperoksidia (PbO2.) Siten latauksen aikana lyijykatodi pysyy lyijynä, mutta lyijyanodi muuttuu lyijyperoksidiksi, joka on väriltään suklaata.
Jos tasavirtalähde kytketään pois päältä ja jos jännitemittari kytketään elektrodien väliin, se näyttää niiden välisen potentiaalieron. Jos johdin yhdistää elektrodit, niin virta virtaa positiiviselta levyltä negatiiviselle levylle ulkoisen virtapiirin kautta eli kenno pystyy syöttämään sähköenergiaa.
Kemiallinen toiminta purkauksen aikana
Kun kenno on täyteen purkautunut, niin anodi on lyijyperoksidia (PbO2) ja katodi on metallista sienijohdinta (Pb). Kun elektrodit kytketään vastuksen kautta, kenno purkautuu ja elektronit virtaavat vastakkaiseen suuntaan kuin latauksen aikana.
Vetyionit siirtyvät anodille ja saavuttaessaan anodit saavat yhden elektronin anodilta ja muuttuvat vetyatomiksi. Vetyatomi joutuu kosketuksiin PbO2:n kanssa, jolloin se hyökkää ja muodostaa lyijysulfaattia (PbSO4), joka on valkoista väriä ja vettä kemiallisen yhtälön mukaisesti.
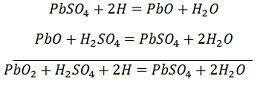
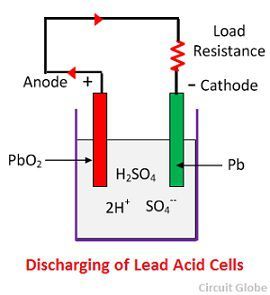 Kukin sulfaatti-ioni (SO4-) liikkuu kohti katodia ja sinne päästyään luopuu kahdesta elektronista muuttuu radikaaliksi SO4:ksi, hyökkää metallisen lyijykatodin kimppuun ja muodostaa lyijysulfaattia, jonka väri on vaalea, kemiallista yhtälöä noudattaen.
Kukin sulfaatti-ioni (SO4-) liikkuu kohti katodia ja sinne päästyään luopuu kahdesta elektronista muuttuu radikaaliksi SO4:ksi, hyökkää metallisen lyijykatodin kimppuun ja muodostaa lyijysulfaattia, jonka väri on vaalea, kemiallista yhtälöä noudattaen.
Kemiallinen toiminta latauksen aikana
Latausta varten anodi ja katodi kytketään tasavirtaverkon positiiviseen ja negatiiviseen napaan. Rikkihapon molekyylit hajoavat 2H+- ja SO4-ioneiksi. Positiivisesti varautuneet vetyionit siirtyvät kohti katodia, saavat sieltä kaksi elektronia ja muodostavat vetyatomin. Vetyatomi reagoi lyijysulfaattikatodin kanssa muodostaen lyijyä ja rikkihappoa kemiallisen yhtälön mukaisesti.
![]()
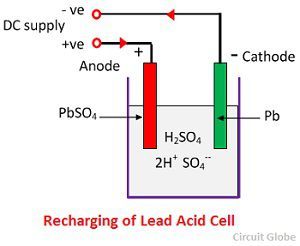 SO4-ioni siirtyy anodille, luovuttaa kaksi ylimääräistä elektroniaan ja muuttuu radikaaliksi SO4:ksi, reagoi lyijysulfaattianodin kanssa muodostaen lyijyperoksidia ja lyijyrikkihappoa kemiallisen yhtälön mukaisesti.
SO4-ioni siirtyy anodille, luovuttaa kaksi ylimääräistä elektroniaan ja muuttuu radikaaliksi SO4:ksi, reagoi lyijysulfaattianodin kanssa muodostaen lyijyperoksidia ja lyijyrikkihappoa kemiallisen yhtälön mukaisesti.![]() Latautuminen ja purkautuminen esitetään yhdellä palautuvalla yhtälöllä, joka on esitetty alla.
Latautuminen ja purkautuminen esitetään yhdellä palautuvalla yhtälöllä, joka on esitetty alla.
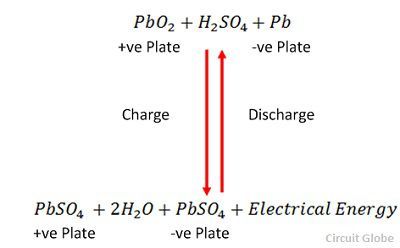 Yhtälön pitäisi lukea alaspäin purkautumisen osalta ja ylöspäin latautumisen osalta.
Yhtälön pitäisi lukea alaspäin purkautumisen osalta ja ylöspäin latautumisen osalta.