Meghatározás: Az akkumulátor, amely a kémiai energia elektromos energiává alakításához szivacsos ólmot és ólomperoxidot használ, az ilyen típusú akkumulátort ólomsavas akkumulátornak nevezik. Az ólomsavas akkumulátort leggyakrabban erőművekben és alállomásokon használják, mert nagyobb cellafeszültséggel és alacsonyabb költséggel rendelkezik.
Az ólomsavas akkumulátor felépítése
Az ólomsavas akkumulátor különböző részei az alábbiakban láthatók. A tartály és a lemezek az ólomsavas akkumulátor fő részei. A tartály tárolja a kémiai energiát, amelyet a lemezek segítségével elektromos energiává alakítunk át.
1. Tartály – Az ólomsavas akkumulátor tartálya üvegből, ólommal bélelt fából, ebonitból, bitumenes keménygumiból, kerámiaanyagokból vagy öntött műanyagból készül, és az elektrolit kiürülésének elkerülése érdekében felül ül. A tartály alján négy borda található, ezek közül kettőn nyugszik a pozitív lemez, a többi pedig a negatív lemezeket támasztja meg.
A prizma a lemezek alátámasztására szolgál, és egyúttal védi őket a rövidzárlattól.Az anyagnak, amelyből az akkumulátortartályok készülnek, ellenállónak kell lennie a kénsavval szemben, nem deformálódhat, nem lehet porózus, és nem tartalmazhat az elektrolitot károsító szennyeződéseket.
2. Lemez – Az ólom-sav-cella lemeze változatos kialakítású, és mindegyik valamilyen formában rácsból áll, amely ólomból és az aktív anyagból áll. A rács elengedhetetlen az elektromos áram vezetéséhez és az áram egyenletes eloszlásához az aktív anyagon. Ha az áram nem egyenletesen oszlik el, akkor az aktív anyag fellazul és kihullik.
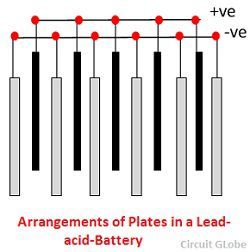 A rácsok ólom és antimon ötvözetéből készülnek. Ezek általában a helyeket derékszögben vagy átlósan keresztező keresztirányú bordával készülnek. A pozitív és negatív lemezek rácsai azonos kialakításúak, de a negatív lemezek rácsai könnyebbek, mert az áram egyenletes vezetése szempontjából kevésbé fontosak.
A rácsok ólom és antimon ötvözetéből készülnek. Ezek általában a helyeket derékszögben vagy átlósan keresztező keresztirányú bordával készülnek. A pozitív és negatív lemezek rácsai azonos kialakításúak, de a negatív lemezek rácsai könnyebbek, mert az áram egyenletes vezetése szempontjából kevésbé fontosak.
Az akkumulátor lemezei kétfélék. Ezek a formázott lemezek vagy plante lemezek és a pasztázott vagy faure lemezek.
A plante lemezeket nagyrészt helyhez kötött akkumulátoroknál használják, mivel ezek nehezebbek és költségesebbek, mint a pasztázott lemezek. A lemezek azonban tartósabbak és kevésbé hajlamosak arra, hogy a gyors töltés és kisütés következtében aktív anyagot veszítsenek. A Plantes-lemez alacsony kapacitás-súlyaránnyal rendelkezik.
A Faure-eljárás sokkal inkább a negatív lemezek, mint a pozitív lemezek gyártására alkalmas. A negatív aktív anyag meglehetősen szívós, és viszonylag kis változáson megy keresztül a töltés és kisütés során.
3. Aktív anyag – A cella aktív anyagának nevezzük a cella aktív anyagát, amely a töltés vagy kisütés során aktívan részt vesz egy kémiai reakcióban (elektromos energia elnyelése vagy fejlesztése). Az ólomsav aktív elemei a következők
- Ólom-peroxid (PbO2) – Ez alkotja a pozitív aktív anyagot. A PbO2 sötét csokoládé seprű színű.
- Szivacsos ólom – Ez alkotja a negatív aktív anyagot. Szürke színű.
- Híg kénsav (H2SO4) – Elektrolytként használják. 31% kénsavat tartalmaz.
A negatív és pozitív aktív anyagokat alkotó ólom-peroxid és szivacs-ólom kevés mechanikai szilárdsággal rendelkezik, ezért önmagában is használható.
4. Szeparátorok – A szeparátorok kémiailag kezelt ólomfából, porózus gumiból vagy üvegszálas szőnyegből álló, nem vezető anyagból készült vékony lemezek, amelyeket a pozitív és a negatív közé helyeznek, hogy szigeteljék őket egymástól. Az elválasztók az egyik oldalon függőlegesen barázdáltak, a másik oldalon pedig simák.
5. Akkumulátor csatlakozók – Az akkumulátornak két csatlakozója van, a pozitív és a negatív. A pozitív pólus, amelynek átmérője felül 17,5 mm, valamivel nagyobb, mint a negatív pólus, amelynek átmérője 16 mm.
Az ólomsavas akkumulátor működési elve
Mikor a kénsav feloldódik, molekulái pozitív hidrogénionokra (2H+) és szulfát negatív ionokra (SO4-) bomlanak és szabadon mozognak. Ha a két elektródot oldatokba merítjük és egyenáramú tápegységhez csatlakoztatjuk, akkor a hidrogénionok pozitív töltésűek és az elektródák felé mozognak, és a tápegység negatív termináljához csatlakoznak. A negatív töltésű SO4-ionok a tápfeszültség pozitív csatlakozójához csatlakoztatott elektródák felé mozdulnak el (azaz,
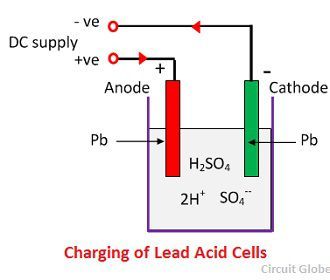 Minden hidrogénion elvesz egy elektront a katódtól, és minden szulfátion elvesz két negatív iont az anódoktól, és reakcióba lép a vízzel, és kén- és hidrogénsavat képez.
Minden hidrogénion elvesz egy elektront a katódtól, és minden szulfátion elvesz két negatív iont az anódoktól, és reakcióba lép a vízzel, és kén- és hidrogénsavat képez.
A fenti egyenletből keletkező oxigén reakcióba lép az ólom-oxiddal, és ólom-peroxidot (PbO2.) Így a töltés során az ólomkatód ólomként marad, de az ólomanód csokoládé színű ólomperoxiddá alakul át.
Ha az egyenáramú tápforrást lekapcsoljuk, és ha a feszültségmérőt az elektródák közé kapcsoljuk, az megmutatja a köztük lévő potenciálkülönbséget. Ha drót köti össze az elektródákat, akkor a pozitív lemezről a negatív lemezre külső áramkörön keresztül áram folyik, azaz a cella képes elektromos energiát szolgáltatni.
Kémiai működés a kisütés során
Ha a cella teljes kisütés, akkor az anód ólomperoxidból (PbO2) és katód fémes szivacsos ólomból (Pb) áll. Amikor az elektródákat ellenálláson keresztül összekötjük, a cella kisül, és az elektronok a töltéssel ellentétes irányba áramlanak.
A hidrogénionok az anód felé mozognak, és az anódokat elérve az anódtól egy elektront kapnak, és hidrogénatom lesz belőlük. A hidrogénatom érintkezésbe kerül egy PbO2-vel, így megtámadja és a kémiai egyenlet szerint fehéres színű ólomszulfátot (PbSO4) és vizet képez.
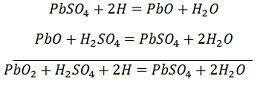
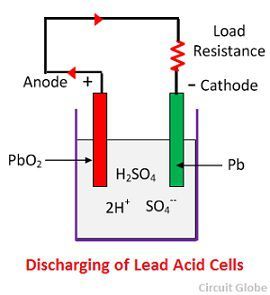 Az egyes szulfátionok (SO4-) a katód felé haladnak és odaérve két elektront leadva SO4 gyökké válik, megtámadja a fémes ólomkatódot és a kémiai egyenlet szerint fehéres színű ólomszulfátot képez.
Az egyes szulfátionok (SO4-) a katód felé haladnak és odaérve két elektront leadva SO4 gyökké válik, megtámadja a fémes ólomkatódot és a kémiai egyenlet szerint fehéres színű ólomszulfátot képez.
Kémiai működés az újratöltés során
Az újratöltéshez az anódot és a katódot az egyenáramú hálózat pozitív és negatív pólusához csatlakoztatják. A kénsav molekulái 2H+ és SO4- ionokra bomlanak. A pozitív töltésű hidrogénionok a katódok felé mozognak, és onnan két elektront kapnak, és hidrogénatomot alkotnak. A hidrogénatom reakcióba lép az ólom-szulfát katóddal, ólmot és kénsavat képezve a kémiai egyenletnek megfelelően.
![]()
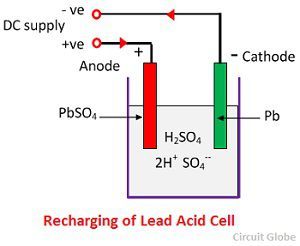 SO4- ion az anód felé mozog, leadja két további elektronját, SO4 gyökké válik, reakcióba lép az ólom-szulfát anóddal és ólom-peroxidot és ólom-kénsavat képez a kémiai egyenletnek megfelelően.
SO4- ion az anód felé mozog, leadja két további elektronját, SO4 gyökké válik, reakcióba lép az ólom-szulfát anóddal és ólom-peroxidot és ólom-kénsavat képez a kémiai egyenletnek megfelelően.![]() A töltést és a kisülést egyetlen, alább megadott reverzibilis egyenlet ábrázolja.
A töltést és a kisülést egyetlen, alább megadott reverzibilis egyenlet ábrázolja.
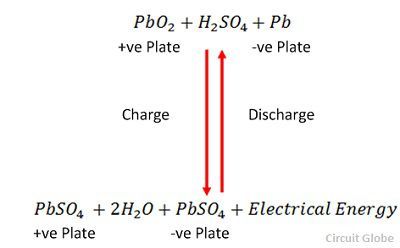 Az egyenletnek a kisülésnél lefelé, a feltöltésnél pedig felfelé kell szólnia.
Az egyenletnek a kisülésnél lefelé, a feltöltésnél pedig felfelé kell szólnia.