Definition: Batteriet som använder svampbly och blyperoxid för att omvandla den kemiska energin till elektrisk energi, en sådan typ av batteri kallas blysyrabatteri. Blysyrabatteriet används oftast i kraftverk och undercentraler eftersom det har högre cellspänning och lägre kostnad.
Blybatteriets uppbyggnad
Blybatteriets olika delar visas nedan. Behållaren och plattorna är huvuddelen av blybatteriet. Behållaren lagrar kemisk energi som omvandlas till elektrisk energi med hjälp av plattorna.
1. Behållare – Blybatteriets behållare är tillverkad av glas, blyklädd trä, ebonit, hårdgummi av bituminös blandning, keramiska material eller formgjuten plast och sitter på toppen för att undvika att elektrolyten rinner ut. I botten av behållaren finns fyra ribbor, på två av dem vilar den positiva plattan och de andra stöder de negativa plattorna.
Prisman tjänar som stöd för plattorna och skyddar dem samtidigt mot kortslutning.Materialet som batteribehållarna är tillverkade av ska vara motståndskraftigt mot svavelsyra, får inte deformeras eller vara poröst eller innehålla föroreningar som skadar elektrolyten.
2. Platta – Plattan i en blybattericell är av olika utformning och de består alla i någon form av ett galler som består av bly och det aktiva materialet. Gittret är viktigt för att leda den elektriska strömmen och för att fördela strömmen jämnt på det aktiva materialet. Om strömmen inte fördelas jämnt kommer det aktiva materialet att lossna och falla ut.
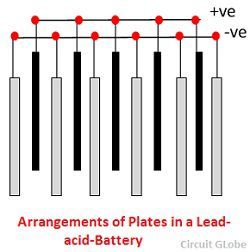 Gallren består av en legering av bly och antimon. Dessa är vanligtvis tillverkade med tvärribban som korsar platserna i rät vinkel eller diagonalt. Gittret för de positiva och negativa plattorna är av samma konstruktion, men gallren för de negativa plattorna är gjorda lättare eftersom de inte är lika viktiga för en jämn ledning av strömmen.
Gallren består av en legering av bly och antimon. Dessa är vanligtvis tillverkade med tvärribban som korsar platserna i rät vinkel eller diagonalt. Gittret för de positiva och negativa plattorna är av samma konstruktion, men gallren för de negativa plattorna är gjorda lättare eftersom de inte är lika viktiga för en jämn ledning av strömmen.
Batteriets plattor är av två typer. De är de formade plattorna eller planteplattorna och de klistrade plattorna eller faureplattorna.
Planteplattor används till stor del för stationära batterier eftersom dessa är tyngre i vikt och dyrare än de klistrade plattorna. Men plattorna är mer hållbara och mindre benägna att förlora aktivt material vid snabb laddning och urladdning. Plantes plattor har ett lågt kapacitetsviktförhållande.
Faure-processen är mycket lämplig för tillverkning av negativa plattor snarare än positiva plattor. Det negativa aktiva materialet är ganska segt och genomgår en jämförelsevis liten förändring vid laddning och urladdning.
3. Aktivt material – Det material i en cell som aktivt deltar i en kemisk reaktion (absorption eller utveckling av elektrisk energi) vid laddning eller urladdning kallas cellens aktiva material. De aktiva elementen i blysyra är
- Blyperoxid (PbO2) – Den utgör det positiva aktiva materialet. PbO2 har en mörk chokladbröstfärg.
- Svampbly – Det utgör det negativa aktiva materialet. Det är grått i färgen.
- Utspädd svavelsyra (H2SO4) – Den används som elektrolyt. Den innehåller 31 % svavelsyra.
Blyperoxid och svampbly, som utgör de negativa och positiva aktiva materialen, har liten mekanisk hållfasthet och kan därför användas ensamma.
4. Separatorer – Separatorerna är tunna skivor av icke-ledande material som består av kemiskt behandlat blyträd, porösa gummisubstanser eller mattor av glasfiber och som placeras mellan det positiva och det negativa för att isolera dem från varandra. Separatorerna är räfflade vertikalt på ena sidan och släta på den andra sidan.
5. Batteripoler – Ett batteri har två terminaler, den positiva och den negativa. Den positiva terminalen med en diameter på 17,5 mm upptill är något större än den negativa terminalen som är 16 mm i diameter.
Blysyrabatteriets funktionsprincip
När svavelsyran löses upp bryts dess molekyler upp i positiva vätejoner (2H+) och negativa sulfatjoner (SO4-) och rör sig fritt. Om de två elektroderna är nedsänkta i lösningarna och anslutna till likströmsförsörjningen så blir vätejonerna positivt laddade och rör sig mot elektroderna och anslutna till den negativa terminalen av försörjningen. SO4-jonerna, som är negativt laddade, rör sig mot elektroderna som är anslutna till den positiva terminalen på huvudnätet (dvs, anod).
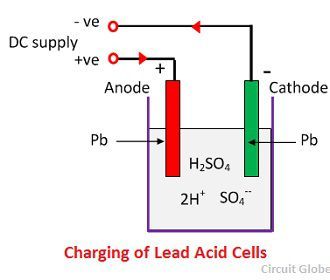 Varje vätejon tar en elektron från katoden, och varje sulfatjon tar de två negativa jonerna från anoderna och reagerar med vatten och bildar svavelsyra och vätesyra.
Varje vätejon tar en elektron från katoden, och varje sulfatjon tar de två negativa jonerna från anoderna och reagerar med vatten och bildar svavelsyra och vätesyra.
Syret, som produceras från ovanstående ekvation reagerar med blyoxid och bildar blyperoxid (PbO2.) Under laddningen förblir alltså blykatoden bly, men blyanoden omvandlas till blyperoxid, som är chokladfärgad.
Om likströmskällan kopplas bort och voltmätaren kopplas in mellan elektroderna, kommer den att visa potentialskillnaden mellan dem. Om en tråd förbinder elektroderna kommer strömmen att flöda från den positiva plattan till den negativa plattan genom den externa kretsen, dvs. cellen kan leverera elektrisk energi.
Kemisk verkan under urladdning
När cellen är fullt urladdad består anoden av blyperoxid (PbO2) och katoden av metalliskt svampbly (Pb). När elektroderna är anslutna genom ett motstånd, urladdas cellen och elektronerna flödar i motsatt riktning mot den riktning som gäller vid laddning.
Vätejonerna rör sig till anoden och når anoderna tar emot en elektron från anoden och blir till en väteatom. Väteatomen kommer i kontakt med en PbO2, så den angriper och bildar blysulfat (PbSO4), vitaktig i färgen och vatten enligt den kemiska ekvationen.
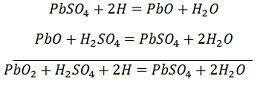
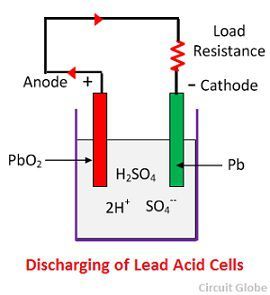 Varje sulfatjon (SO4-) rör sig mot katoden och när den når dit avger den två elektroner och blir en radikal SO4, som angriper den metalliska blykatoden och bildar blysulfat vitaktig i färgen enligt den kemiska ekvationen.
Varje sulfatjon (SO4-) rör sig mot katoden och när den når dit avger den två elektroner och blir en radikal SO4, som angriper den metalliska blykatoden och bildar blysulfat vitaktig i färgen enligt den kemiska ekvationen.
Kemisk verkan vid uppladdning
För uppladdning ansluts anoden och katoden till den positiva och den negativa terminalen på likströmsnätet. Svavelsyrans molekyler bryts upp till joner av 2H+ och SO4-. De positivt laddade vätejonerna rör sig mot katoderna och tar emot två elektroner därifrån och bildar en väteatom. Väteatomen reagerar med bly-sulfatkatoden och bildar bly och svavelsyra enligt den kemiska ekvationen.
![]()
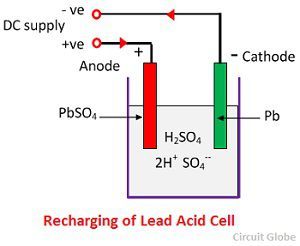 SO4-jonen rör sig till anoden, avger sina två extra elektroner och blir en radikal SO4, som reagerar med bly-sulfat-anoden och bildar blyperoxid och blysvavelsyra enligt den kemiska ekvationen.
SO4-jonen rör sig till anoden, avger sina två extra elektroner och blir en radikal SO4, som reagerar med bly-sulfat-anoden och bildar blyperoxid och blysvavelsyra enligt den kemiska ekvationen.![]() Laddningen och urladdningen representeras av en enda reversibel ekvation som ges nedan.
Laddningen och urladdningen representeras av en enda reversibel ekvation som ges nedan.
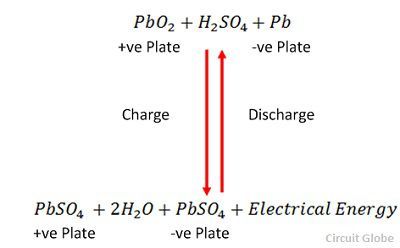 Ekvationen ska läsas nedåt för urladdning och uppåt för uppladdning.
Ekvationen ska läsas nedåt för urladdning och uppåt för uppladdning.