定義。 化学エネルギーを電力に変換するためにスポンジ鉛と過酸化鉛を使用する電池で、このようなタイプの電池は鉛蓄電池と呼ばれます。
鉛蓄電池の構造
鉛蓄電池の各部を以下に示す。 鉛蓄電池の主要部は容器とプレートである。 容器は化学エネルギーを貯蔵し、プレートの助けによって電気エネルギーに変換されます
1. 容器 – 鉛蓄電池の容器は、ガラス、鉛ライニング木材、エボナイト、瀝青化合物の硬質ゴム、セラミック材料や成形プラスチックで作られており、電解液の放電を避けるために、上部に座っている。 容器の底には4つのリブがあり、そのうちの2つは正極板を乗せ、他のものは負極板を支える。
プリズムは板を支える役割を果たすと同時に、短絡から板を保護する。電池容器の材料は、硫酸に耐性があり、変形したり多孔質であったり、電解液を損傷する不純物を含んでいないことが望ましい。 プレート – 鉛酸電池のプレートは多様なデザインで、すべて鉛と活物質からなるグリッドのいくつかのフォームで構成されています。 グリッドは電流を伝導し、活物質上に電流を均等に分布させるために不可欠です。 電流が均等に配分されないと、活物質が緩んで脱落してしまいます。
 グリッドは、鉛とアンチモンの合金でできています。 これらは通常、場所を直角または斜めに横切る横リブで作られています。 正極板と負極板のグリッドは同じデザインですが、負極板のグリッドは電流の均一な伝導にそれほど必要ではないので、より軽く作られています。 成形板(プランテ板)と貼付板(フォーレ板)である。
グリッドは、鉛とアンチモンの合金でできています。 これらは通常、場所を直角または斜めに横切る横リブで作られています。 正極板と負極板のグリッドは同じデザインですが、負極板のグリッドは電流の均一な伝導にそれほど必要ではないので、より軽く作られています。 成形板(プランテ板)と貼付板(フォーレ板)である。
プランテ板は貼付板より重量が重く、コストが高いので、主に定置用電池に使用される。 しかし、耐久性が高く、急速な充放電による活物質の損失が少ない。 7615>
Faureプロセスは正極板よりもむしろ負極板の製造に適している。 負極活物質は非常に丈夫で、充放電による変化が比較的少ない。 活物質-充電または放電の際に化学反応(電気エネルギーの吸収または発生)に積極的に参加する電池の材料を電池の活物質と呼ぶ。 鉛酸の活物質は
- 過酸化鉛(PbO2)- 正の活物質を形成する。 PbO2 は color.
- スポンジ鉛 – そのフォーム負の活物質でダークチョコレートほうきです。 それはcolour.3657>
- 希硫酸(H2SO4)のグレーです – それは、電解質として使用されます。 硫酸を31%含んでいます。
負と正の活物質を形成する過酸化鉛とスポンジ鉛は、機械的強度が小さいので単独で使用できます。
4. セパレータ-化学処理した鉛材、多孔質ゴム、ガラス繊維のマットでできた非伝導体の薄いシートで、正と負の間に置いて互いを絶縁するために使用されます。 セパレータの片側には縦に溝があり、もう片側は平滑になっています。 バッテリー端子 – バッテリーには、プラスとマイナスの2つの端子があります。 上部の直径17.5mmのプラス端子は、直径16mmのマイナス端子よりわずかに大きい。
鉛蓄電池の動作原理
硫酸が溶けると、その分子はプラスの水素イオン(2H+)と硫酸マイナスイオン(SO4-)に分解されて自由に移動する。 2つの電極を溶液に浸し、直流電源に接続すると、正に帯電した水素イオンが電極に向かって移動し、電源のマイナス端子に接続されます。 SO4-イオンは負に帯電し、電極に向かって移動し、電源の正極に接続される(すなわち。
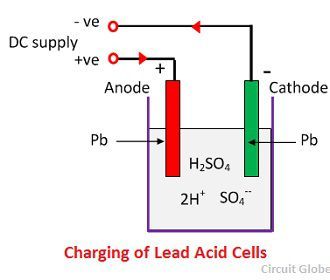 各水素イオンは正極から1個の電子を取り、各硫酸イオンは負極から2個の負イオンを取り、水と反応し硫酸と水素酸を生成します。このように、充電中、正極の鉛は鉛のままですが、負極の鉛は過酸化鉛になり、チョコレート色に変化します。 ワイヤーが電極を接続すると、電流は正極から負極に外部回路を通して流れます。つまり、電池は電気エネルギーを供給することができるのです。 電極を抵抗で接続すると、電池が放電し、充電時とは逆の方向に電子が流れる。
各水素イオンは正極から1個の電子を取り、各硫酸イオンは負極から2個の負イオンを取り、水と反応し硫酸と水素酸を生成します。このように、充電中、正極の鉛は鉛のままですが、負極の鉛は過酸化鉛になり、チョコレート色に変化します。 ワイヤーが電極を接続すると、電流は正極から負極に外部回路を通して流れます。つまり、電池は電気エネルギーを供給することができるのです。 電極を抵抗で接続すると、電池が放電し、充電時とは逆の方向に電子が流れる。
水素イオンは陽極に移動し、陽極に到達すると陽極から電子を1個受け取り、水素原子になる。 水素原子はPbO2と接触するので、化学式に従って硫酸鉛(PbSO4)を攻撃し、白っぽい色をした水を形成します。
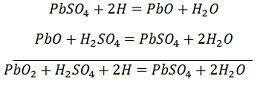
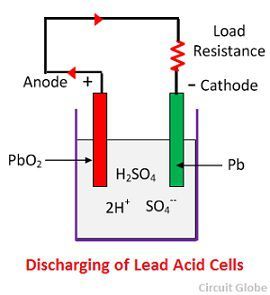 各硫酸イオン(SO4-)は陰極に向かって動き、そこに達すると2つの電子を放棄してラジカルSO4になり、金属鉛陰極を攻撃して化学式に従って硫酸鉛の色をした白っぽいものを形成します。
各硫酸イオン(SO4-)は陰極に向かって動き、そこに達すると2つの電子を放棄してラジカルSO4になり、金属鉛陰極を攻撃して化学式に従って硫酸鉛の色をした白っぽいものを形成します。
充電中の化学作用
充電のために、陽極と陰極はDC電源の正と負の端子に接続されています。 硫酸の分子は2H+とSO4-のイオンに分解されます。 正電荷を帯びた水素イオンは陰極に向かって移動し、そこから2個の電子を受け取って水素原子を形成する。
![]()
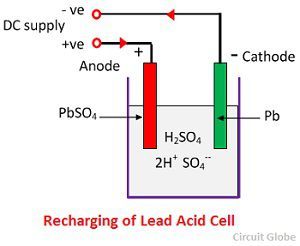 SO4- イオンが陽極に移動し、2個の追加電子を手放しラジカルSO4となり、硫酸鉛陽極と反応して化学式に従って過酸化鉛と硫酸鉛を形成する。
SO4- イオンが陽極に移動し、2個の追加電子を手放しラジカルSO4となり、硫酸鉛陽極と反応して化学式に従って過酸化鉛と硫酸鉛を形成する。![]() 充電と放電は、以下に示す単一の可逆式で表されます。
充電と放電は、以下に示す単一の可逆式で表されます。
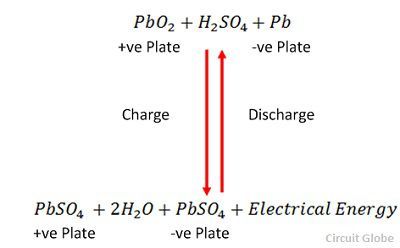 式は、放電の場合は下向きに、充電の場合は上向きに読みます。
式は、放電の場合は下向きに、充電の場合は上向きに読みます。