Definicja: Akumulator, który wykorzystuje ołów gąbczasty i nadtlenek ołowiu do zamiany energii chemicznej na energię elektryczną, taki typ akumulatora nazywamy akumulatorem kwasowo-ołowiowym. Akumulator kwasowo-ołowiowy jest najczęściej stosowany w elektrowniach i podstacjach, ponieważ ma wyższe napięcie ogniwa i niższy koszt.
Konstrukcja akumulatora kwasowo-ołowiowego
Różne części akumulatora kwasowo-ołowiowego są pokazane poniżej. Pojemnik i płyty są głównymi częściami akumulatora kwasowo-ołowiowego. Pojemnik przechowuje energię chemiczną, która jest przekształcana w energię elektryczną za pomocą płyt.
1. Pojemnik – Pojemnik akumulatora kwasowo-ołowiowego jest wykonany ze szkła, drewna pokrytego ołowiem, ebonitu, twardej gumy z masy bitumicznej, materiałów ceramicznych lub formowanych tworzyw sztucznych i są osadzone u góry, aby uniknąć wypływu elektrolitu. W dolnej części pojemnika znajdują się cztery żebra, na dwóch z nich spoczywają płyty dodatnie, a pozostałe podtrzymują płyty ujemne.
Pryzmat służy jako podpora dla płyt i jednocześnie chroni je przed zwarciem.Materiał, z którego wykonane są pojemniki akumulatora powinien być odporny na działanie kwasu siarkowego, nie powinien się odkształcać, być porowaty, ani zawierać zanieczyszczeń niszczących elektrolit.
2. Płyta – Płyta ogniwa ołowiowo-kwasowego ma różną budowę i wszystkie składają się z jakiejś formy siatki, która jest zbudowana z ołowiu i materiału aktywnego. Siatka jest niezbędna do przewodzenia prądu elektrycznego i do równomiernego rozprowadzania prądu na materiale aktywnym. Jeśli prąd nie jest równomiernie rozprowadzany, wówczas materiał aktywny rozluźni się i wypadnie.
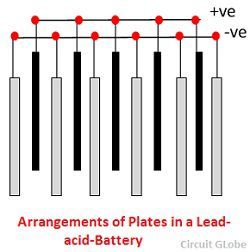 Siatki wykonane są ze stopu ołowiu i antymonu. Zwykle są one wykonane z poprzecznym żebrem przecinającym miejsca pod kątem prostym lub ukośnie. Siatki dla płyt dodatnich i ujemnych są tej samej konstrukcji, ale siatki dla płyt ujemnych są lżejsze, ponieważ nie są one tak istotne dla równomiernego przewodzenia prądu.
Siatki wykonane są ze stopu ołowiu i antymonu. Zwykle są one wykonane z poprzecznym żebrem przecinającym miejsca pod kątem prostym lub ukośnie. Siatki dla płyt dodatnich i ujemnych są tej samej konstrukcji, ale siatki dla płyt ujemnych są lżejsze, ponieważ nie są one tak istotne dla równomiernego przewodzenia prądu.
Płyty akumulatora są dwóch typów. Są to płyty formowane lub płyty Plante’a i płyty pastowane lub płyty Faure’a.
Płyty Plante’a są używane głównie w bateriach stacjonarnych, ponieważ są one cięższe i bardziej kosztowne niż płyty pastowane. Płyty te są jednak bardziej trwałe i mniej podatne na utratę materiału aktywnego w wyniku szybkiego ładowania i rozładowywania. Płyta Plantes ma niski stosunek masy do pojemności.
Proces Faure’a jest odpowiedni do produkcji płyt ujemnych, a nie dodatnich. Ujemny materiał aktywny jest dość twardy i ulega stosunkowo niewielkim zmianom podczas ładowania i rozładowywania.
3. Materiał aktywny – Materiał w ogniwie, który bierze czynny udział w reakcji chemicznej (pochłanianie lub wydzielanie energii elektrycznej) podczas ładowania lub rozładowywania, nazywany jest materiałem aktywnym ogniwa. Elementy aktywne kwasu ołowiowego to
- Nadtlenek ołowiu (PbO2) – Tworzy on dodatni materiał aktywny. PbO2 są ciemne czekolada miotła w kolorze.
- Ołów gąbczasty – Jego forma ujemny materiał aktywny. Jest koloru szarego.
- Rozcieńczony kwas siarkowy (H2SO4) – Jest on stosowany jako elektrolit. Zawiera 31% kwasu siarkowego.
Nadtlenek ołowiu i ołów gąbczasty, które tworzą ujemny i dodatni materiał czynny mają małą wytrzymałość mechaniczną i dlatego mogą być stosowane samodzielnie.
4. Separatory – Separatory są cienkimi arkuszami nieprzewodzącego materiału składającego się z chemicznie obrobionego drewna ołowianego, porowatych gum lub mat z włókna szklanego i są umieszczane pomiędzy dodatnim i ujemnym materiałem czynnym w celu odizolowania ich od siebie. Separatory są rowkowane pionowo z jednej strony i są gładkie z drugiej strony.
5. Zaciski akumulatora – Akumulator posiada dwa zaciski, dodatni i ujemny. Zacisk dodatni o średnicy 17,5 mm u góry jest nieco większy od zacisku ujemnego, który ma średnicę 16 mm.
Zasada działania akumulatora kwasowo-ołowiowego
Gdy kwas siarkowy rozpuszcza się, jego cząsteczki rozpadają się na dodatnie jony wodorowe (2H+) i ujemne jony siarczanowe (SO4-) i poruszają się swobodnie. Jeśli dwie elektrody są zanurzone w roztworach i podłączone do zasilania DC, to jony wodorowe są dodatnio naładowane i przeniósł się w kierunku elektrod i podłączony do ujemnego zacisku zasilania. Jony SO4- naładowane ujemnie przemieszczają się w kierunku elektrod podłączonych do dodatniego zacisku zasilania (tj, anoda).
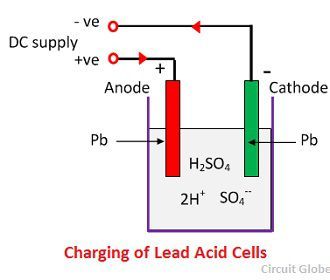 Każdy jon wodorowy pobiera jeden elektron z katody, a każdy jon siarczanowy pobiera dwa jony ujemne z anody i reaguje z wodą tworząc kwas siarkowy i wodorowy.
Każdy jon wodorowy pobiera jeden elektron z katody, a każdy jon siarczanowy pobiera dwa jony ujemne z anody i reaguje z wodą tworząc kwas siarkowy i wodorowy.
Tlen, który powstał z powyższego równania reaguje z tlenkiem ołowiu i tworzy nadtlenek ołowiu (PbO2.Tak więc podczas ładowania katoda ołowiowa pozostaje jako ołów, ale anoda ołowiowa przekształca się w nadtlenek ołowiu, koloru czekoladowego.
Jeśli źródło zasilania prądem stałym jest odłączone i jeśli woltomierz podłączony jest pomiędzy elektrodami, pokaże on różnicę potencjałów pomiędzy nimi. Jeżeli drut połączy elektrody, wtedy prąd będzie płynął od płyty dodatniej do płyty ujemnej poprzez obwód zewnętrzny, tzn. ogniwo jest zdolne do dostarczania energii elektrycznej.
Akcja chemiczna podczas rozładowywania
Gdy ogniwo jest w pełni rozładowane, wtedy anoda jest z nadtlenku ołowiu (PbO2), a katoda jest z metalicznego ołowiu gąbczastego (Pb). Kiedy elektrody są połączone przez opór, rozładowanie ogniwa i elektrony płyną w kierunku przeciwnym do tego podczas ładowania.
Jony wodoru poruszają się do anody i osiągając anody otrzymują jeden elektron z anody i stają się atomem wodoru. Atom wodoru styka się z PbO2, więc atakuje i tworzy siarczan ołowiu (PbSO4) o białawym zabarwieniu i wodę zgodnie z równaniem chemicznym.
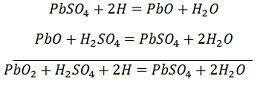
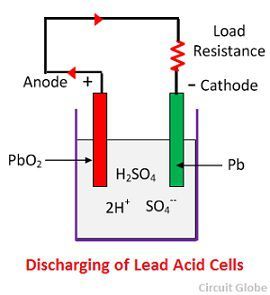 Każdy jon siarczanowy (SO4-) porusza się w kierunku katody i docierając tam oddaje dwa elektrony staje się rodnikiem SO4, atakuje metaliczną katodę ołowianą i tworzy siarczan ołowiu o białawym zabarwieniu zgodnie z równaniem chemicznym.
Każdy jon siarczanowy (SO4-) porusza się w kierunku katody i docierając tam oddaje dwa elektrony staje się rodnikiem SO4, atakuje metaliczną katodę ołowianą i tworzy siarczan ołowiu o białawym zabarwieniu zgodnie z równaniem chemicznym.
Działanie chemiczne podczas ładowania
Do ładowania, anoda i katoda są podłączone do dodatniego i ujemnego terminala sieci zasilania DC. Cząsteczki kwasu siarkowego rozpadają się na jony 2H+ i SO4-. Jony wodoru, naładowane dodatnio, przemieszczają się w kierunku katody, skąd otrzymują dwa elektrony i tworzą atom wodoru. Atom wodoru reaguje z katodą siarczanu ołowiu tworząc ołów i kwas siarkowy zgodnie z równaniem chemicznym.
![]()
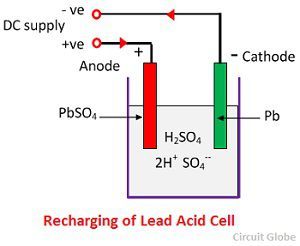 Jon SO4- przemieszcza się do anody, oddaje swoje dwa dodatkowe elektrony staje się rodnikiem SO4, reaguje z anodą siarczanu ołowiu i tworzy nadtlenek ołowiu i kwas siarkowy ołowiu zgodnie z równaniem chemicznym.
Jon SO4- przemieszcza się do anody, oddaje swoje dwa dodatkowe elektrony staje się rodnikiem SO4, reaguje z anodą siarczanu ołowiu i tworzy nadtlenek ołowiu i kwas siarkowy ołowiu zgodnie z równaniem chemicznym.![]() Ładowanie i rozładowywanie są reprezentowane przez pojedyncze równanie odwracalne podane poniżej.
Ładowanie i rozładowywanie są reprezentowane przez pojedyncze równanie odwracalne podane poniżej.
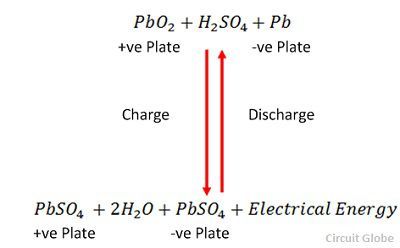 Równanie powinno być czytane w dół dla rozładowania i w górę dla ładowania.
Równanie powinno być czytane w dół dla rozładowania i w górę dla ładowania.
.