Definice: Takový typ baterie se nazývá olověný akumulátor, který využívá olověnou houbu a peroxid olova k přeměně chemické energie na elektrickou energii. Olověný akumulátor se nejčastěji používá v elektrárnách a rozvodnách, protože má vyšší napětí článků a nižší náklady.
Konstrukce olověného akumulátoru
Různé části olověného akumulátoru jsou uvedeny níže. Nádoba a desky jsou hlavní částí olověného akumulátoru. V nádobě se uchovává chemická energie, která se pomocí desek přeměňuje na energii elektrickou.
1. V nádobě se uchovává chemická energie, která se pomocí desek přeměňuje na energii elektrickou. Nádoba – Nádoba olověného akumulátoru je vyrobena ze skla, olovem obloženého dřeva, ebonitu, tvrdé pryže z bitumenové směsi, keramických materiálů nebo lisovaných plastů a je usazena nahoře, aby se zabránilo vybíjení elektrolytu. Na dně nádoby jsou čtyři žebra, na dvou z nich spočívají kladné desky a ostatní podpírají záporné desky.
Hranol slouží jako opora desek a zároveň je chrání před zkratem.Materiál, z něhož jsou vyrobeny obaly baterií, by měl být odolný vůči kyselině sírové, neměl by se deformovat, být porézní nebo obsahovat nečistoty, které poškozují elektrolyt.
2. Deska – Desky olověného článku mají různou konstrukci a všechny se skládají z nějaké formy mřížky, která je tvořena olovem a aktivním materiálem. Mřížka je nezbytná pro vedení elektrického proudu a pro rovnoměrné rozložení proudu na aktivní materiál. Pokud není proud rovnoměrně rozložen, aktivní materiál se uvolní a vypadne.
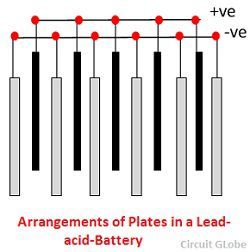 Mřížky jsou tvořeny slitinou olova a antimonu. Obvykle se vyrábějí s příčným žebrem, které protíná místa v pravém úhlu nebo šikmo. Mřížky pro kladné a záporné desky jsou stejné konstrukce, ale mřížky pro záporné desky jsou vyrobeny lehčí, protože nejsou tak podstatné pro rovnoměrné vedení proudu.
Mřížky jsou tvořeny slitinou olova a antimonu. Obvykle se vyrábějí s příčným žebrem, které protíná místa v pravém úhlu nebo šikmo. Mřížky pro kladné a záporné desky jsou stejné konstrukce, ale mřížky pro záporné desky jsou vyrobeny lehčí, protože nejsou tak podstatné pro rovnoměrné vedení proudu.
Desky baterie jsou dvojího typu. Jsou to desky tvarované neboli planteho desky a desky lepené neboli faureho desky.
Planteho desky se používají převážně pro stacionární baterie, protože jsou těžší a dražší než desky lepené. Tyto desky jsou však odolnější a méně náchylné ke ztrátě aktivního materiálu rychlým nabíjením a vybíjením. Plantesovy desky mají nízký poměr hmotnosti a kapacity.
Faureův postup je mnohem vhodnější pro výrobu záporných než kladných desek. Záporný aktivní materiál je poměrně houževnatý a při nabíjení a vybíjení podléhá poměrně malým změnám.
3. Aktivní materiál – Materiál v článku, který se aktivně účastní chemické reakce (absorpce nebo vývinu elektrické energie) při nabíjení nebo vybíjení, se nazývá aktivní materiál článku. Aktivními prvky kyseliny olovnaté jsou
- Peroxid olovnatý (PbO2) – Tvoří kladný aktivní materiál. PbO2 mají barvu tmavé čokoládové metly.
- Houba olova – Tvoří záporný aktivní materiál. Má šedou barvu.
- Zředěná kyselina sírová (H2SO4) – Používá se jako elektrolyt. Obsahuje 31 % kyseliny sírové.
Peroxid olova a houbové olovo, které tvoří záporný a kladný aktivní materiál, mají malou mechanickou pevnost, a proto je lze použít samostatně.
4. Separátory – Separátory jsou tenké pláty nevodivého materiálu tvořené chemicky upraveným olovnatým dřevem, porézními pryžemi nebo rohožemi ze skleněných vláken a jsou umístěny mezi kladným a záporným materiálem, aby je od sebe izolovaly. Oddělovače jsou na jedné straně svisle drážkované a na druhé straně hladké.
5. Oddělovače jsou na jedné straně svisle drážkované a na druhé straně hladké. Svorky baterie – Baterie má dvě svorky kladnou a zápornou. Kladný pól o průměru 17,5 mm v horní části je o něco větší než záporný pól, který má průměr 16 mm.
Princip činnosti olověného akumulátoru
Při rozpouštění kyseliny sírové se její molekuly rozpadají na kladné vodíkové ionty (2H+) a záporné síranové ionty (SO4-) a volně se pohybují. Jsou-li obě elektrody ponořeny do roztoků a připojeny ke stejnosměrnému napájení, pak jsou vodíkové ionty kladně nabité a pohybují se směrem k elektrodám a jsou připojeny k zápornému pólu napájení. Záporně nabité ionty SO4- se pohybují směrem k elektrodám připojeným ke kladné svorce hlavního přívodu (tzn, Anoda).
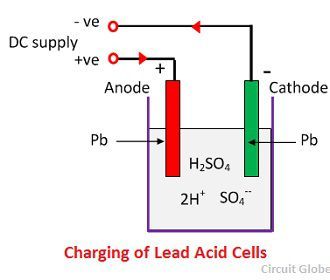 Každý vodíkový iont si vezme jeden elektron z katody a každý síranový iont si vezme dva záporné ionty z anody a reaguje s vodou za vzniku kyseliny sírové a vodíkové.
Každý vodíkový iont si vezme jeden elektron z katody a každý síranový iont si vezme dva záporné ionty z anody a reaguje s vodou za vzniku kyseliny sírové a vodíkové.
Kyslík, který vzniká z výše uvedené rovnice, reaguje s oxidem olovnatým a tvoří peroxid olova (PbO2.) Během nabíjení tedy olověná katoda zůstává jako olovo, ale olověná anoda se mění na peroxid olova, čokoládové barvy.
Pokud se odpojí zdroj stejnosměrného proudu a pokud se mezi elektrody připojí voltmetr, ukáže rozdíl potenciálů mezi nimi. Spojí-li se elektrody vodičem, poteče proud z kladné desky na zápornou desku vnějším obvodem, tj. článek je schopen dodávat elektrickou energii.
Chemický děj při vybíjení
Při úplném vybití článku je anoda z peroxidu olova (PbO2) a katoda z kovové houby olova (Pb). Když jsou elektrody spojeny přes odpor, článek se vybíjí a elektrony proudí opačným směrem než při nabíjení.
Vodíkové ionty se pohybují k anodě a dosažením anody přijímají jeden elektron z anody a stávají se atomem vodíku. Atom vodíku se dostane do kontaktu s PbO2, takže napadne a vytvoří síran olovnatý (PbSO4), bělavé barvy a vodu podle chemické rovnice.
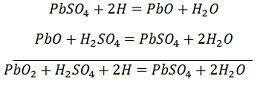
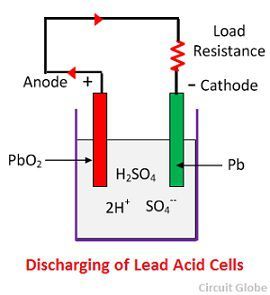 Každý síranový ion (SO4-) se pohybuje směrem ke katodě a dosáhne tam odevzdá dva elektrony, stane se radikálem SO4, napadne kovovou olovnatou katodu a vytvoří síran olovnatý bělavé barvy podle chemické rovnice.
Každý síranový ion (SO4-) se pohybuje směrem ke katodě a dosáhne tam odevzdá dva elektrony, stane se radikálem SO4, napadne kovovou olovnatou katodu a vytvoří síran olovnatý bělavé barvy podle chemické rovnice.
Chemický děj při dobíjení
Pro dobíjení se anoda a katoda připojí ke kladné a záporné svorce stejnosměrné napájecí sítě. Molekuly kyseliny sírové se rozpadají na ionty 2H+ a SO4-. Kladně nabité vodíkové ionty se pohybují směrem ke katodám, odkud přijímají dva elektrony a vytvářejí atom vodíku. Atom vodíku reaguje s katodou síranu olovnatého za vzniku olova a kyseliny sírové podle chemické rovnice.
![]()
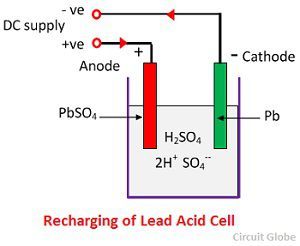 Iont SO4- se přesune k anodě, odevzdá své dva dodatečné elektrony, stane se radikálem SO4, reaguje s anodou síranu olovnatého a vzniká peroxid olova a kyselina sírová podle chemické rovnice.
Iont SO4- se přesune k anodě, odevzdá své dva dodatečné elektrony, stane se radikálem SO4, reaguje s anodou síranu olovnatého a vzniká peroxid olova a kyselina sírová podle chemické rovnice.![]() Nabíjení a vybíjení jsou reprezentovány jedinou reverzibilní rovnicí uvedenou níže.
Nabíjení a vybíjení jsou reprezentovány jedinou reverzibilní rovnicí uvedenou níže.
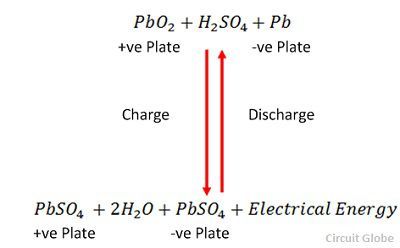 Rovnice by měla znít směrem dolů pro vybíjení a směrem nahoru pro dobíjení.
Rovnice by měla znít směrem dolů pro vybíjení a směrem nahoru pro dobíjení.
.