Definizione: La batteria che utilizza piombo spugnoso e perossido di piombo per la conversione dell’energia chimica in energia elettrica, tale tipo di batteria è chiamata batteria al piombo. La batteria al piombo è più comunemente usata nelle centrali elettriche e nelle sottostazioni perché ha una tensione di cella più alta e un costo inferiore.
Costruzione della batteria al piombo
Le varie parti della batteria al piombo sono mostrate sotto. Il contenitore e le piastre sono la parte principale della batteria al piombo. Il contenitore immagazzina energia chimica che viene convertita in energia elettrica con l’aiuto delle piastre.
1. Contenitore – Il contenitore della batteria al piombo è fatto di vetro, legno rivestito di piombo, ebanite, la gomma dura del composto bituminoso, materiali ceramici o plastica stampata e sono seduti in alto per evitare la scarica dell’elettrolito. Nella parte inferiore del contenitore, ci sono quattro costole, su due di esse poggia la piastra positiva e le altre sostengono le piastre negative.
Il prisma serve come supporto per le piastre e allo stesso tempo le protegge da un cortocircuito.Il materiale di cui sono fatti i contenitori delle batterie dovrebbe essere resistente all’acido solforico, non dovrebbe deformarsi o essere poroso, o contenere impurità che danneggiano l’elettrolita.
2. Piastra – La piastra della cella al piombo-acido è di diverso design e tutte consistono in una qualche forma di griglia che è composta da piombo e materiale attivo. La griglia è essenziale per condurre la corrente elettrica e per distribuire equamente la corrente sul materiale attivo. Se la corrente non è distribuita uniformemente, il materiale attivo si allenta e cade.
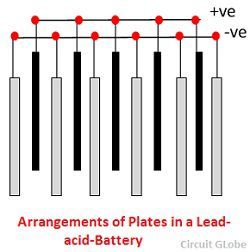 Le griglie sono costituite da una lega di piombo e antimonio. Di solito sono fatte con la nervatura trasversale che attraversa i posti ad angolo retto o in diagonale. Le griglie per le piastre positive e negative sono dello stesso disegno, ma le griglie per le piastre negative sono fatte più leggere perché non sono così essenziali per la conduzione uniforme della corrente.
Le griglie sono costituite da una lega di piombo e antimonio. Di solito sono fatte con la nervatura trasversale che attraversa i posti ad angolo retto o in diagonale. Le griglie per le piastre positive e negative sono dello stesso disegno, ma le griglie per le piastre negative sono fatte più leggere perché non sono così essenziali per la conduzione uniforme della corrente.
Le piastre della batteria sono di due tipi. Sono le piastre formate o piastre plante e le piastre incollate o faure.
Le piastre plante sono utilizzate in gran parte per le batterie stazionarie in quanto sono più pesanti in peso e più costose delle piastre incollate. Ma le piastre sono più durevoli e meno suscettibili di perdere materiale attivo con la carica e la scarica rapida. Le piastre plantes hanno un basso rapporto peso capacità.
Il processo Faure è molto adatto alla produzione di piastre negative piuttosto che positive. Il materiale attivo negativo è abbastanza resistente, e subisce un cambiamento relativamente basso dalla carica e dalla scarica.
3. Materiale attivo – Il materiale in una cella che prende parte attiva in una reazione chimica (assorbimento o evoluzione di energia elettrica) durante la carica o la scarica è chiamato il materiale attivo della cella. Gli elementi attivi dell’acido di piombo sono
- Perossido di piombo (PbO2) – Forma il materiale attivo positivo. Il PbO2 è di colore ginestra cioccolato scuro.
- Piombo spugna – Forma il materiale attivo negativo. È di colore grigio.
- Acido solforico diluito (H2SO4) – È usato come elettrolita. Contiene il 31% di acido solforico.
Il perossido di piombo e il piombo spugna, che formano i materiali attivi negativi e positivi hanno la poca resistenza meccanica e quindi possono essere usati da soli.
4. Separatori – I separatori sono sottili fogli di materiale non conduttore costituiti da legno di piombo trattato chimicamente, gomme porose, o stuoie di fibra di vetro e sono posti tra il positivo e il negativo per isolarli tra loro. I separatori sono scanalati verticalmente su un lato e sono lisci sull’altro lato.
5. Terminali della batteria – Una batteria ha due terminali, il positivo e il negativo. Il terminale positivo con un diametro di 17,5 mm nella parte superiore è leggermente più grande del terminale negativo che ha un diametro di 16 mm.
Principio di funzionamento della batteria al piombo
Quando l’acido solforico si dissolve, le sue molecole si scompongono in ioni idrogeno positivi (2H+) e ioni solfato negativi (SO4-) e si muovono liberamente. Se i due elettrodi sono immersi in soluzioni e collegati all’alimentazione DC, gli ioni idrogeno, essendo caricati positivamente, si muovono verso gli elettrodi e sono collegati al terminale negativo dell’alimentazione. Gli ioni SO4- essendo caricati negativamente spostati verso gli elettrodi collegati al terminale positivo dell’alimentazione principale (cioè, Ogni ione idrogeno prende un elettrone dal catodo, e ogni ione solfato prende i due ioni negativi dagli anodi e reagisce con l’acqua e forma acido solforico e idrogeno.
L’ossigeno, che prodotto dall’equazione di cui sopra reagisce con l’ossido di piombo e forma perossido di piombo (PbO2.Così, durante la carica il catodo di piombo rimane come piombo, ma l’anodo di piombo viene convertito in perossido di piombo, di colore cioccolato.
Se la fonte di alimentazione DC è scollegata e se il voltmetro si collega tra gli elettrodi, mostrerà la differenza di potenziale tra loro. Se il filo collega gli elettrodi, allora la corrente scorrerà dalla piastra positiva alla piastra negativa attraverso il circuito esterno, cioè la cella è in grado di fornire energia elettrica.
Azione chimica durante la scarica
Quando la cella è completamente scarica, allora l’anodo è di perossido di piombo (PbO2) e un catodo è di piombo spugna metallica (Pb). Quando gli elettrodi sono collegati attraverso una resistenza, la cella si scarica e gli elettroni scorrono in direzione opposta a quella durante la carica.
Gli ioni di idrogeno si muovono verso l’anodo e raggiungendo gli anodi ricevono un elettrone dall’anodo e diventano atomo di idrogeno. L’atomo di idrogeno entra in contatto con un PbO2, quindi attacca e forma solfato di piombo (PbSO4), di colore biancastro e acqua secondo l’equazione chimica.
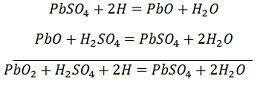
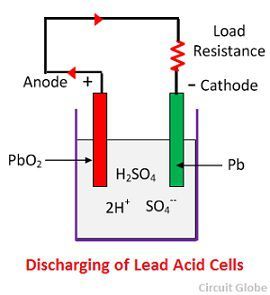 Ogni ione solfato (SO4-) si muove verso il catodo e raggiungendolo cede due elettroni diventando radicale SO4, attacca il catodo di piombo metallico e forma solfato di piombo di colore biancastro secondo l’equazione chimica.
Ogni ione solfato (SO4-) si muove verso il catodo e raggiungendolo cede due elettroni diventando radicale SO4, attacca il catodo di piombo metallico e forma solfato di piombo di colore biancastro secondo l’equazione chimica.
Azione chimica durante la ricarica
Per la ricarica, l’anodo e il catodo sono collegati al terminale positivo e negativo della rete di alimentazione DC. Le molecole dell’acido solforico si scompongono in ioni 2H+ e SO4-. Gli ioni di idrogeno, essendo caricati positivamente, si muovono verso i catodi e ricevono due elettroni da lì e formano un atomo di idrogeno. L’atomo di idrogeno reagisce con il catodo del solfato di piombo formando piombo e acido solforico secondo l’equazione chimica.
![]()
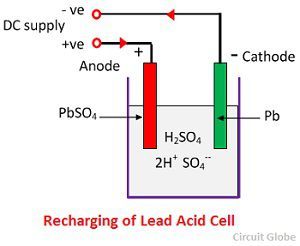 Lo ione SO4- si muove verso l’anodo, cede i suoi due elettroni supplementari e diventa radicale SO4, reagisce con l’anodo del solfato di piombo e forma perossido di piombo e acido solforico di piombo secondo l’equazione chimica.
Lo ione SO4- si muove verso l’anodo, cede i suoi due elettroni supplementari e diventa radicale SO4, reagisce con l’anodo del solfato di piombo e forma perossido di piombo e acido solforico di piombo secondo l’equazione chimica.![]() La carica e la scarica sono rappresentate da un’unica equazione reversibile data di seguito.
La carica e la scarica sono rappresentate da un’unica equazione reversibile data di seguito.
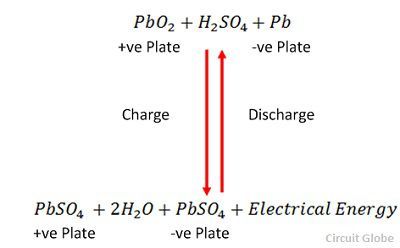 L’equazione dovrebbe essere letta verso il basso per la scarica e verso l’alto per la ricarica.
L’equazione dovrebbe essere letta verso il basso per la scarica e verso l’alto per la ricarica.