Definitie: De batterij die sponslood en loodperoxide gebruikt voor de omzetting van de chemische energie in elektrische stroom, een dergelijk type batterij wordt een loodzuurbatterij genoemd. De loodzuurbatterij wordt het meest gebruikt in de elektrische centrales en de onderstations omdat zij hogere celspanning en lagere kosten heeft.
Opbouw van loodzuurbatterij
De verschillende delen van de loodzuurbatterij worden hieronder getoond. De houder en de platen vormen het belangrijkste onderdeel van de loodzuur-batterij. De houder slaat chemische energie op die wordt omgezet in elektrische energie met behulp van de platen.
1. Container – De container van de loodzuur-batterij is gemaakt van glas, met lood bekleed hout, eboniet, het harde rubber van bitumineuze samenstelling, keramische materialen of gevormde kunststoffen en zitten aan de bovenkant om de lozing van elektrolyt te voorkomen. Aan de onderkant van de houder bevinden zich vier ribben, op twee daarvan rust de positieve plaat en de andere ondersteunen de negatieve platen.
Het prisma dient als steun voor de platen en beschermt ze tegelijkertijd tegen kortsluiting.Het materiaal waarvan de batterijhouders zijn gemaakt, moet bestand zijn tegen zwavelzuur, mag niet vervormen of poreus zijn, of onzuiverheden bevatten die de elektrolyt beschadigen.
2. Plaat – De plaat van de loodzuurcel is van verschillend ontwerp en zij bestaan alle uit een of andere vorm van een rooster dat is samengesteld uit lood en het actieve materiaal. Het rooster is essentieel voor het geleiden van de elektrische stroom en voor het gelijkmatig verdelen van de stroom over het actieve materiaal. Indien de stroom niet gelijkmatig wordt verdeeld, zal het actieve materiaal loskomen en uitvallen.
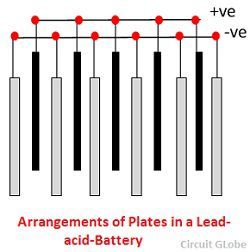 De roosters zijn vervaardigd uit een legering van lood en antimoon. Deze zijn meestal gemaakt met de dwarsrib die de plaatsen in een rechte hoek of diagonaal kruist. De roosters voor de positieve en negatieve platen zijn van hetzelfde ontwerp, maar de roosters voor de negatieve platen zijn lichter gemaakt omdat ze niet zo essentieel zijn voor de uniforme geleiding van de stroom.
De roosters zijn vervaardigd uit een legering van lood en antimoon. Deze zijn meestal gemaakt met de dwarsrib die de plaatsen in een rechte hoek of diagonaal kruist. De roosters voor de positieve en negatieve platen zijn van hetzelfde ontwerp, maar de roosters voor de negatieve platen zijn lichter gemaakt omdat ze niet zo essentieel zijn voor de uniforme geleiding van de stroom.
De platen van de batterij zijn van twee types. Het zijn de gevormde platen of plante platen en de geplakte of faure platen.
Plante’s platen worden grotendeels gebruikt voor stationaire batterijen omdat deze zwaarder in gewicht en duurder zijn dan de geplakte platen. Maar de platen zijn duurzamer en minder gevoelig voor verlies van actief materiaal door snel laden en ontladen. De geplakte plaat heeft een lage capaciteits-gewichtsverhouding.
Het Faure-procédé is veel geschikter voor de vervaardiging van negatieve platen dan voor positieve platen. Het negatieve actieve materiaal is vrij taai, en het ondergaat een betrekkelijk lage verandering van het laden en het lossen.
3. Actief Materiaal – het materiaal in een cel dat actief aan een chemische reactie (absorptie of evolutie van elektrische energie) tijdens het laden of het lossen deelneemt wordt genoemd het actieve materiaal van de cel. De actieve elementen van het loodzuur zijn
- Loodperoxide (PbO2) – Het vormt het positieve actieve materiaal. PbO2 heeft een donkere chocoladebruine kleur.
- Sponslood – Het vormt het negatieve actieve materiaal. Het is grijs van kleur.
- Verdund zwavelzuur (H2SO4) – Het wordt gebruikt als een elektrolyt. Het bevat 31% zwavelzuur.
De loodperoxide en het sponslood, die de negatieve en positieve actieve materialen vormen, hebben weinig mechanische sterkte en kunnen daarom alleen worden gebruikt.
4. Scheiders – De scheiders zijn dunne platen van niet-geleidend materiaal dat bestaat uit chemisch behandeld loodhout, poreus rubber of matten van glasvezel en worden tussen de positieve en de negatieve geplaatst om ze van elkaar te isoleren. De scheiders zijn aan één kant verticaal gegroefd en zijn aan de andere kant glad.
5. Batterijaansluitingen – Een batterij heeft twee aansluitingen, de positieve en de negatieve. De positieve pool met een diameter van 17,5 mm aan de bovenzijde is iets groter dan de negatieve pool met een diameter van 16 mm.
Werkingsprincipe van loodzuur-batterij
Wanneer het zwavelzuur oplost, vallen de moleculen uiteen in positieve waterstofionen (2H+) en negatieve sulfaationen (SO4-) en bewegen vrij. Als de twee elektroden in oplossingen worden ondergedompeld en met gelijkstroom worden verbonden dan worden de waterstofionen die positief worden geladen en naar de elektroden bewogen en met de negatieve terminal van de voeding verbonden. De SO4-ionen die negatief geladen zijn bewogen zich naar de elektroden die verbonden zijn met de positieve terminal van de toevoerleiding (d.w.z,
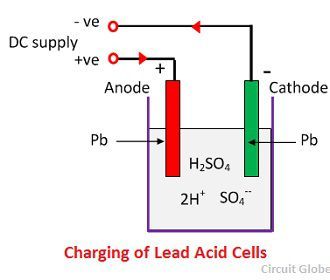 Elk waterstofion neemt één elektron van de kathode, en elk sulfaation neemt de twee negatieve ionen van de anoden en reageren met water en vormen zwavelzuur en waterstofzuur.
Elk waterstofion neemt één elektron van de kathode, en elk sulfaation neemt de twee negatieve ionen van de anoden en reageren met water en vormen zwavelzuur en waterstofzuur.
De zuurstof, die uit de bovenstaande vergelijking wordt geproduceerd, reageert met loodoxide en vormt loodperoxide (PbO2.) Aldus, tijdens het laden blijft de loodkathode als lood, maar de loodanode wordt omgezet in loodperoxyde, chocolade in colour.
Als de gelijkstroombron van levering wordt losgekoppeld en als de voltmeter tussen de elektroden verbindt, zal het het potentiële verschil tussen hen tonen. Als de draad de elektroden verbindt, dan zal de stroom van de positieve plaat naar de negatieve plaat door externe kring vloeien d.w.z. de cel is geschikt om elektrische energie te leveren.
Chemische Actie tijdens het Ontladen
Wanneer de cel volledige lossing is, dan is de anode van loodperoxyde (PbO2) en een kathode is van metaalsponslood (Pb). Wanneer de elektroden door een weerstand worden verbonden, ontlaadt de cel en stromen de elektronen in een richting tegengesteld aan die tijdens het laden.
De waterstofionen bewegen zich naar de anode en bij het bereiken van de anodes ontvangen ze één elektron van de anode en worden waterstofatoom. Het waterstofatoom komt in contact met een PbO2, zodat het aanvalt en vormt loodsulfaat (PbSO4), witachtig van kleur en water volgens de chemische vergelijking.
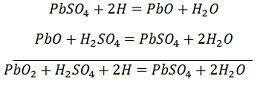
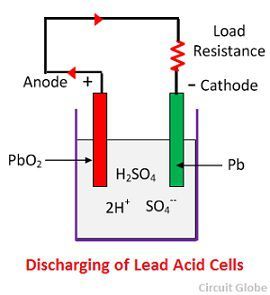 Het elk sulfaation (SO4-) beweegt naar de kathode en het bereiken van daar geeft twee elektronen op wordt radicaal SO4, valt de metallische loodkathode aan en vormt loodsulfaat witachtig van kleur volgens de chemische vergelijking.
Het elk sulfaation (SO4-) beweegt naar de kathode en het bereiken van daar geeft twee elektronen op wordt radicaal SO4, valt de metallische loodkathode aan en vormt loodsulfaat witachtig van kleur volgens de chemische vergelijking.
Chemische werking tijdens het opladen
Voor het opladen worden de anode en de kathode aangesloten op de positieve en de negatieve pool van het gelijkstroomnet. De moleculen van het zwavelzuur vallen uiteen in ionen van 2H+ en SO4-. De waterstofionen die positief geladen zijn, bewegen zich naar de kathoden en ontvangen daar twee elektronen en vormen een waterstofatoom. Het waterstofatoom reageert met de loodsulfaatkathode en vormt lood en zwavelzuur volgens de chemische vergelijking.
![]()
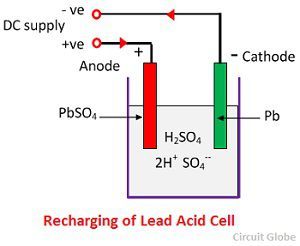 SO4-ion beweegt zich naar de anode, geeft zijn twee extra elektronen af en wordt radicaal SO4, reageert met de loodsulfaatanode en vormt loodperoxide en loodzwavelzuur volgens de chemische vergelijking.
SO4-ion beweegt zich naar de anode, geeft zijn twee extra elektronen af en wordt radicaal SO4, reageert met de loodsulfaatanode en vormt loodperoxide en loodzwavelzuur volgens de chemische vergelijking.![]() De oplading en ontlading worden weergegeven door een enkele omkeerbare vergelijking die hieronder wordt gegeven.
De oplading en ontlading worden weergegeven door een enkele omkeerbare vergelijking die hieronder wordt gegeven.
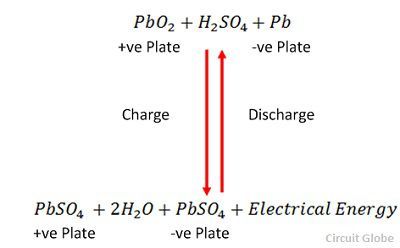 De vergelijking moet naar beneden worden gelezen voor ontlading en naar boven voor heroplading.
De vergelijking moet naar beneden worden gelezen voor ontlading en naar boven voor heroplading.