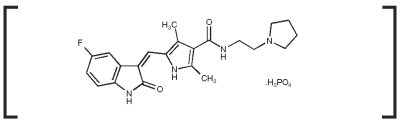
Palladia Wskazania
Palladia tabletki są wskazane w leczeniu Patnaik stopnia II lub III, nawracających, skórnych guzów z komórek tucznych z lub bez zajęcia regionalnych węzłów chłonnych u psów.
Dawkowanie i podawanie
Zawsze dostarczać Kartę Informacyjną Klienta wraz z receptą. Podawać dawkę początkową 3,25 mg/kg (1,48 mg/lb) masy ciała, doustnie, co drugi dzień (patrz Tabela 1). Zmniejszenie dawki o 0,5 mg/kg (do minimalnej dawki 2,2 mg/kg (1,0 mg/lb) co drugi dzień) oraz przerwanie podawania dawki (zaprzestanie podawania produktu PALLADIA na okres do dwóch tygodni) może być zastosowane, w razie potrzeby, w celu opanowania działań niepożądanych (patrz Tabela 2 oraz Ostrzeżenia i środki ostrożności). Dawkę należy dostosowywać na podstawie około cotygodniowej oceny weterynaryjnej przez pierwsze 6 tygodni, a następnie co około 6 tygodni. PALLADIA może być podawana z pokarmem lub bez. Nie należy dzielić tabletek.
Tabela 1. 3.Schemat dawkowania 25 mg/kg
|
Masa ciała psa |
Liczba tabletek |
||||
|
Funtów |
Kilogramy |
Dawka |
10 mg |
15 mg |
50 mg |
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
|||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
|||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
|||
|
18.6 – 22,0 |
8,5 – 10,0 |
30 mg |
|||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
|||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
|||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
|||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
|||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
|||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
|||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
|||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
|||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
|||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
|||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
|||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
|||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
|||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
|||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
|||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
|||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
|||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
|||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
|||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
|||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
|||
|
139.0 – 144,0 |
63,1 – 65,3 |
210 mg |
|||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
|||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
|||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
|||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
|||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
|||
Tabela 2: Dose Modification Based on Toxicity Observed
|
Toksyczność |
Dostosowanie dawki |
|
Neutropenia |
|
Tabela 2: Modyfikacja dawki na podstawie zaobserwowanej toksyczności.
>1000/µL
Podtrzymać poziom dawki
≤1000/µL lub gorączka neutropeniczna lub zakażenie
Zatrzymać lek do czasu >1000/µL i wystąpienia objawów klinicznych w normie; następnie zmniejszyć dawkę o 0.5 mg/kg
Toksyczność nerek (kreatynina)
<2.0 mg/dL
Utrzymać poziom dawki
≥2,0 mg/dL
Zatrzymać lek do momentu <2.0 mg/dL następnie zmniejszyć dawkę o 0,5 mg/kg
Albumina
<1,5 g/dL
Stop lek do czasu >2.5 g/dL następnie zmniejszyć dawkę o 0,5 mg/kg
Hematokryt
<26%
Zatrzymać lek do >30% następnie zmniejszyć dawkę o 0.5 mg/kg
Diarrhea
<4 wodniste stolce/dobę przez mniej niż 2 dni
Maintain dose level and Rozpocząć leczenie podtrzymujące
≥4 wodniste stolce/dobę lub ≥ 2 dni
Zatrzymać podawanie leku do czasu uformowania stolca i rozpocząć leczenie podtrzymujące. Po wznowieniu dawkowania, zmniejszyć dawkę o 0,5 mg/kg
Krwawienie z przewodu pokarmowego
Świeża krew w stolcu lub czarny smolisty stolec przez > 2 dni lub szczery krwotok lub skrzepy krwi w stolcu.
Zatrzymać lek i rozpocząć leczenie wspomagające do czasu ustąpienia wszystkich objawów klinicznych krwi w stolcu, następnie zmniejszyć dawkę o 0.5 mg/kg.
Przeciwwskazania
Nie stosować u psów używanych do rozrodu oraz u suk w ciąży lub karmiących (patrz Farmakologia kliniczna).
Ostrzeżenia
PALLADIA może powodować zaburzenia czynności naczyń krwionośnych, które mogą prowadzić do obrzęków i zaburzeń zakrzepowo-zatorowych, w tym płucnych zaburzeń zakrzepowo-zatorowych. Należy zaprzestać stosowania leku do czasu ustąpienia objawów klinicznych i normalizacji stanu klinicznego. Aby zapewnić homeostazę naczyń krwionośnych, należy odczekać co najmniej 3 dni po odstawieniu leku przed wykonaniem zabiegu chirurgicznego (patrz Działania niepożądane).
Poważne i czasami śmiertelne powikłania żołądkowo-jelitowe, w tym perforacja przewodu pokarmowego, występowały rzadko u psów leczonych produktem PALLADIA (patrz Działania niepożądane). W przypadku podejrzenia owrzodzenia przewodu pokarmowego należy przerwać podawanie leku i zastosować odpowiednie leczenie.
Ostrzeżenia dla ludzi:
Nie stosować u ludzi. PRZECHOWYWAĆ TEN LEK I WSZYSTKIE LEKI W MIEJSCU NIEDOSTĘPNYM DLA DZIECI. Dzieci nie powinny mieć kontaktu z lekiem PALLADIA. Trzymać dzieci z dala od kału, moczu lub wymiocin leczonych psów. Aby uniknąć kontaktu z lekiem, po podaniu produktu PALLADIA należy umyć ręce wodą z mydłem i założyć rękawice ochronne, aby zapobiec bezpośredniemu kontaktowi z kałem, moczem, wymiocinami oraz przełamanymi lub zwilżonymi tabletkami produktu PALLADIA. Wszystkie odpady należy umieścić w plastikowej torbie i szczelnie zamknąć przed ogólnym usunięciem. W razie przypadkowego kontaktu oczu z lekiem należy natychmiast przepłukać oczy wodą. W razie przypadkowego połknięcia przez człowieka należy niezwłocznie zwrócić się o pomoc lekarską, pokazać lekarzowi ulotkę dołączoną do opakowania lub etykietę. W razie przypadkowego połknięcia tego leku mogą wystąpić dolegliwości żołądkowo-jelitowe, takie jak wymioty lub biegunka.
Kobiety w ciąży, kobiety, które mogą zajść w ciążę lub matki karmiące powinny zwrócić szczególną uwagę na te środki ostrożności dotyczące obchodzenia się z lekiem. (PALLADIA, podobnie jak inne leki w tej klasie, zapobiega tworzeniu się nowych naczyń krwionośnych w guzach. W podobny sposób lek PALLADIA może wpływać na tworzenie się naczyń krwionośnych u rozwijającego się płodu i może zaszkodzić nienarodzonemu dziecku (spowodować wady wrodzone). U kobiet w ciąży przypadkowe spożycie produktu leczniczego PALLADIA może mieć niekorzystny wpływ na przebieg ciąży.
Środki ostrożności
Tymczasowo przerwać stosowanie produktu leczniczego PALLADIA, jeśli jednocześnie wystąpi niedokrwistość, azotemia, hipoalbuminemia i hiperfosfatemia. Leczenie należy wznowić w dawce zmniejszonej o 0,5 mg/kg po 1 do 2 tygodniach, gdy wartości ulegną poprawie, a stężenie albuminy wyniesie >2,5 g/dl. Czasowe przerwanie leczenia może być konieczne, jeśli wystąpi jedno z wymienionych zaburzeń: hematokryt <26%, kreatynina ≥2,0 mg/dl lub albumina <1,5 g/dl. Następnie należy wznowić leczenie przy zmniejszeniu dawki o 0,5 mg/kg, gdy hematokryt wyniesie >30%, kreatynina <2,0 mg/dl, a albumina >2,5 g/dl.
Tymczasowo przerwać stosowanie produktu leczniczego PALLADIA, jeśli liczba neutrofilów wynosi ≤1000/µL. Wznowienie leczenia po 1 do 2 tygodniach przy zmniejszeniu dawki o 0,5 mg/kg, gdy liczba neutrofilów powróci do wartości >1000/µL. Dalsze zmniejszenie dawki może być konieczne w przypadku ponownego wystąpienia ciężkiej neutropenii.
Obecność ogólnoustrojowego guza komórek tucznych przed rozpoczęciem leczenia może predysponować psa do klinicznie istotnej degranulacji komórek tucznych z możliwymi ciężkimi ogólnoustrojowymi działaniami niepożądanymi podczas leczenia produktem PALLADIA. Należy podjąć próbę wykluczenia mastocytozy układowej przed rozpoczęciem leczenia produktem PALLADIA.
PALLADIA była związana z wystąpieniem ciężkiej biegunki lub krwawienia z przewodu pokarmowego, które wymagają natychmiastowego leczenia. Może być konieczne przerwanie podawania i zmniejszenie dawki w zależności od nasilenia objawów klinicznych. (Patrz Tabela 2 w części Dawkowanie i podawanie.)
Niesteroidowe leki przeciwzapalne należy stosować ostrożnie w skojarzeniu z produktem leczniczym PALLADIA ze względu na zwiększone ryzyko owrzodzenia lub perforacji przewodu pokarmowego.
PALLADIA jest metabolizowana w wątrobie. Jednoczesne podawanie produktu leczniczego PALLADIA z silnymi inhibitorami rodziny CYP3A4 może zwiększać stężenie produktu leczniczego PALLADIA. Nie oceniano wpływu jednocześnie stosowanych leków, które mogą hamować metabolizm produktu leczniczego PALLADIA. Należy monitorować zgodność lekową u pacjentów wymagających jednoczesnego stosowania leków.
Nie oceniano bezpieczeństwa stosowania produktu leczniczego PALLADIA u psów w wieku poniżej 24 miesięcy lub ważących mniej niż 5 kg.
Działania niepożądane
W amerykańskim badaniu klinicznym w terenie, składającym się z 6-tygodniowej fazy z maską, po której nastąpiła faza z otwartą etykietą, oceniano bezpieczeństwo i skuteczność produktu PALLADIA u 151 psów będących własnością klientów, które miały nawracające, skórne guzy komórek tucznych w stopniu II lub III wg Patnaika z zajęciem lub bez zajęcia regionalnych węzłów chłonnych. Najczęstsze działania niepożądane zgłaszane podczas fazy maskowanej podsumowano w Tabeli 3; działania niepożądane zgłaszane podczas całego badania (faza maskowana połączona z fazą otwartą) podsumowano w Tabeli 4.
Tabela 3. Podsumowanie najczęstszych działań niepożądanych podczas fazy z maską
|
Placebo (n = 64) |
PALLADIA (n = 87) |
|||
|
Działanie niepożądane Reaction |
Any Gradeb |
Grade 3 or 4b |
Any Gradeb |
Grade 3 or 4b |
|
Diarrhea |
26.6% |
3.1% |
46.0% |
6,9% |
|
Anoreksja |
31,3% |
6.3% |
39,1% |
6,9% |
|
Letarg |
29.7% |
3.1% |
35.6% |
4.6% |
|
Wymioty |
32,8% |
6,3% |
32,2% |
9.2% |
|
Lamliwość |
9,4% |
0,0% |
17.2% |
0,0% |
|
Utrata wagi |
3,1% |
0.0% |
14,9% |
1,1% |
|
Krew w stolcu/krwawienie z przewodu pokarmowego/ biegunka krwotoczna |
3.1% |
0.0% |
12.6% |
2.3% |
|
Zaburzenia mięśniowo-szkieletowe |
6.3% |
0.0% |
11,5% |
1,1% |
|
Dehydracja |
4.7% |
0.0% |
9.2% |
2.3% |
|
Zapalenie skóry |
9,4% |
1,6% |
9,2% |
0.0% |
|
Pruritus |
4.7% |
0.0% |
9.2% |
0,0% |
|
Tachypnea |
4.7% |
0,0% |
8,0% |
1,1% |
|
Ból zlokalizowany |
4,7% |
0,0% |
8.0% |
0,0% |
|
Nauka |
3,1% |
0.0% |
8,0% |
1,1% |
|
Ból ogólny |
4.7% |
1,6% |
6,9% |
0,0% |
|
Polidypsja |
7,8% |
0.0% |
6,9% |
0,0% |
|
Pyreksja |
3.1% |
0.0% |
5.7% |
2.3% |
|
Płaskość |
3,1% |
0,0% |
5.7% |
0,0% |
|
Zaburzenia pigmentacji |
1.6% |
0.0% |
5.7% |
0.0% |
|
Nieprawidłowości laboratoryjne |
Każdy Gradec |
Gradacja 3 lub 4c |
Any Gradec |
Grade 3 or 4c |
|
Neutropenia |
6.3% |
0.0% |
46.0% |
0,0% |
|
Thrombocytopenia |
20,3% |
0,0% |
24,1% |
0.0% |
|
Zwiększenie aktywności aminotransferazy alaninowej |
21,9% |
4.7% |
24,1% |
1,1% |
|
Hypoalbuminemia |
7.8% |
0,0% |
12,6% |
0,0% |
|
Zmniejszony hematokryt |
7,8% |
0.0% |
5,7% |
3,4% |
|
Hyperbilirubinemia |
1.6% |
1.6% |
5.7% |
0.0% |
|
Zwiększona kreatynina |
4,7% |
0,0% |
5.7% |
0,0% |
|
Zakażenie dróg moczowych |
1.6% |
0,0% |
5,7% |
0,0% |
a Średni czas trwania badania w fazie maskowanej wynosił 37,0 dni dla psów leczonych produktem PALLADIA (mediana, 42.0 dni) i 27,6 dni dla psów otrzymujących placebo (mediana, 21,0 dni); w porównaniach statystycznych nie uwzględniono tej różnicy.
b Badacze przypisali stopień ciężkości 1, 2, 3 lub 4 (1 – najmniej ciężki; 4 – najbardziej ciężki).
c Klasyfikację nieprawidłowości laboratoryjnych oparto na wytycznych National Cancer Institute’s Common Toxicity Criteria zaadaptowanych dla psów (1 – najmniej ciężka; 4 – najbardziej ciężka).
Tabela 4. Podsumowanie najczęstszych działań niepożądanych podczas badania (faza z maską w połączeniu z fazą otwartą)a
Tabela 4.label phase)a
|
PALLADIA (n = 145) a |
||
|
Działania niepożądane |
Każdy stopieńb |
Stopień 3 lub 4b |
|
Biegunka |
58.6% |
8,3% |
|
Anoreksja |
49.7% |
8,3% |
|
Wymioty |
47.6% |
9,7% |
|
Letarg |
39,3% |
4.1% |
|
Łamliwość |
22.8% |
0.0% |
|
Utrata wagi |
21.4% |
2.8% |
|
Krew w stolcu/krwawienie z przewodu pokarmowego/biegunka krwotoczna |
18.6% |
2.8% |
|
Dehydracja |
15.2% |
2.1% |
|
Świąd |
12,4% |
0,0% |
|
Zaburzenia pigmentacji |
11.7% |
0,0% |
|
Zapalenie skóry |
11.0% |
0,0% |
|
Zaburzenia mięśniowo-szkieletowe |
11,0% |
0,0% |
|
Ból ogólny |
8.3% |
0,0% |
|
Otitis externa |
8.3% |
0.0% |
|
Tachypnea |
8.3% |
0.0% |
|
Nudności |
7,6% |
1.4% |
|
Polidypsja |
7,6% |
0,0% |
|
Pyreksja |
6.9% |
2,8% |
|
Zapalenie stawów |
6,2% |
0,0% |
|
Zlokalizowany obrzęk |
6.2% |
0,0% |
|
Bakteryjne zakażenie skóry |
5,5% |
0,0% |
|
Zapalenie spojówek |
5.5% |
0.0% |
|
Nieprawidłowości laboratoryjne |
Każdy stopień |
Stopień 3 lub 4c |
|
Neutropenia |
44.8% |
1,4% |
|
Hypoalbuminemia |
28,3% |
1.4% |
|
Thrombocytopenia |
28,3% |
2.1% |
|
Zwiększona aminotransferaza alaninowa |
27,6% |
4.1% |
|
Zmniejszony hematokryt |
11,0% |
2.8% |
|
Zwiększona kreatynina |
13,8% |
1,4% |
|
Hyperbilirubinemia |
6,9% |
0.0% |
|
Zakażenie dróg moczowych |
7,6% |
0,0% |
a Czas trwania leczenia produktem leczniczym PALLADIA wynosił od 2 do 812 dni (średnia, 144 dni; mediana, 68 dni). Wszystkie psy otrzymały co najmniej 1 dawkę produktu PALLADIA.
b Badacze przypisali stopień ciężkości 1, 2, 3 lub 4 (1 – najmniej ciężki; 4 – najbardziej ciężki).
c Klasyfikacja nieprawidłowości laboratoryjnych została oparta na wytycznych Common Toxicity Criteria National Cancer Institute dostosowanych dla psów (1 – najmniej ciężki; 4 – najbardziej ciężki).
Zgłaszano inne zdarzenia niepożądane, ale wystąpiły one u < 5% psów. U każdego psa mogło wystąpić wiele zdarzeń niepożądanych.
W trakcie tego badania wystąpiło 5 zgonów, które prawdopodobnie były związane z lekiem. Wyniki badań patologicznych na ogół ujawniały dowody zaburzeń czynności naczyń, w tym płucną chorobę zakrzepowo-zatorową (pooperacyjną); niewydolność wielonarządową związaną z zapaleniem naczyń i zakrzepicą; zakrzepicę naczyń z rozsianą koagulopatią wewnątrznaczyniową (DIC) i zapaleniem trzustki; oraz zapalenie naczyń z DIC. Jeden pies zmarł wtórnie do perforacji żołądka; czas leczenia produktem PALLADIA wynosił 221 dni, a sekcja zwłok nie wykazała obecności guza komórek tucznych. Zgony te wystąpiły w obecności lub przy braku choroby podstawowej; czas trwania leczenia wynosił od 18 do 221 dni.
Związek następujących zgonów z lekiem nie jest znany. Jeden pies, leczony najpierw przez 3 tygodnie placebo, zmarł z nieznanej przyczyny 7 dni po rozpoczęciu leczenia preparatem PALLADIA. Inny pies zmarł z nieznanej przyczyny 92 dni po rozpoczęciu leczenia preparatem PALLADIA. U żadnego z tych psów nie przeprowadzono sekcji zwłok.
U dwudziestu siedmiu psów wystąpiła jakaś forma krwawienia z przewodu pokarmowego, przy czym u 2,8% psów wystąpiło ciężkie krwawienie. U jednego psa rozwinęło się owrzodzenie żołądka, które prawdopodobnie było związane z lekiem. Trzy psy zmarły w trakcie badania z powodu perforacji żołądka (1 pies) lub dwunastnicy (2 psy). Jeden pies z perforacją dwunastnicy otrzymał tylko 1 dawkę badanego leku i dlatego nie uznano jej za związaną z lekiem.
U siedmiu psów wystąpiła depigmentacja nosa w ciągu pierwszych kilku tygodni leczenia. U jedenastu psów w trakcie badania wystąpiły zmiany koloru sierści lub skóry. Dwa z tych psów miały całkowitą zmianę koloru sierści z płowego na biały i z głęboko rudego na blond. U siedmiu psów wystąpiło łysienie.
Występuje wpływ leku na masę ciała: 20,0% psów miało >13% spadek masy ciała w fazie maskowanej plus fazie otwartej, który można przypisać działaniu leku. Spośród nich u 5 psów wystąpiła >25% utrata masy ciała.
Trzy psy miały aktywność przypominającą napady drgawkowe podczas przyjmowania badanego leku. Nie można ustalić, czy były one związane z lekiem.
Dwa psy miały zapalenie nadtwardówki, które nie było związane z trombocytopenią. U innego psa wystąpiło zapalenie nadtwardówki z towarzyszącą koagulopatią wewnątrznaczyniową.
W celu uzyskania kopii karty charakterystyki (SDS) lub zgłoszenia zdarzeń niepożądanych należy skontaktować się z firmą Zoetis pod numerem 1-888-963-8471.
Informacje dla właścicieli psów:
Zawsze dostarczać Arkusz Informacyjny dla Klienta wraz z receptą i zapoznać z nim właścicieli. Właściciele powinni zostać poinformowani o możliwych działaniach niepożądanych oraz o tym, kiedy należy odstawić lek i skontaktować się z lekarzem weterynarii. Właściciele powinni być poinformowani o instrukcjach postępowania.
Farmakologia kliniczna
Mechanizm działania: Fosforan tokeranibu jest małą cząsteczką, która wykazuje zarówno bezpośrednie działanie przeciwnowotworowe, jak i antyangiogenne. W nieklinicznych badaniach farmakologicznych tooceranib wybiórczo hamował aktywność kinazy tyrozynowej kilku członków rodziny rozszczepionych kinaz tyrozynowych receptora (RTK), z których niektóre są zaangażowane we wzrost guza, patologiczną angiogenezę i przerzutową progresję nowotworu. Toceranib hamował aktywność kinazy tyrozynowej Flk-1/KDR (receptor czynnika wzrostu śródbłonka naczyniowego, VEGFR2), receptora płytkopochodnego czynnika wzrostu (PDGFR) i receptora czynnika komórek macierzystych (Kit) zarówno w badaniach biochemicznych, jak i komórkowych. Wykazano, że tokeranib wywiera działanie antyproliferacyjne na komórki śródbłonka in vitro. Leczenie tokeranibem może indukować zatrzymanie cyklu komórkowego i następczą apoptozę w liniach komórkowych nowotworów wyrażających aktywujące mutacje w rozszczepionej kinazie RTK, ckit. Wzrost nowotworów mastocytów u psów jest często napędzany przez mutacje aktywujące w c-kit.1,2
Inne związki w klasie antyangiogennych środków przeciwnowotworowych są znane z tego, że zwiększają śmiertelność zarodków i nieprawidłowości płodu. Ponieważ angiogeneza jest krytycznym elementem rozwoju zarodka i płodu, należy oczekiwać, że zahamowanie angiogenezy po podaniu produktu leczniczego PALLADIA spowoduje niekorzystny wpływ na ciążę u suki.
Farmakokinetyka
Po podaniu dożylnym, farmakokinetyka toceranibu charakteryzuje się bardzo dużą objętością dystrybucji (>20 L/kg, co wskazuje na podział do tkanek), końcowym okresem półtrwania eliminacji wynoszącym około 16 godzin oraz klirensem >1 L/godz/kg. W przypadku schematu obejmującego dawki 3,25 mg ekwiwalentu wolnej zasady (fbe)/kg toceranibu podawanego doustnie w postaci tabletek co drugi dzień przez 2 tygodnie (7 dawek), parametry farmakokinetyczne toceranibu w osoczu u zdrowych psów rasy Beagle (o masie ciała od 7,2 do 12,5 kg) przedstawiono w poniższej tabeli.
Tabela 5: Parametry farmakokinetyczne
|
Parametry farmakokinetyczne (średnia + 1SD) |
Ogółem (n=11;6M, 5F) |
Dawka całkowita (n=10; 5M, 5F) |
|
Półokres eliminacji, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Czas do osiągnięcia maksymalnego stężenia w osoczu, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Maksymalne stężenie w osoczu, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Area under the plasma concentration time-curve, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Wartość znormalizowana względem dawki (dostosowana do 3.25 mg/kg dawki)
b Cmin jest stężeniem w 48 h po podaniu dawki, co odpowiada przedziałowi dawkowania.
Dostępność biologiczna toceranibu w jamie ustnej wynosi 77%. Produkt PALLADIA jest w wysokim stopniu wiązany z białkami w 91% do 93%.
Należy zauważyć, że pomimo jednorodności uczestników włączonych do tego badania, obserwowano dużą zmienność pomiędzy uczestnikami. Niezależnie od drogi podania, liniową farmakokinetykę obserwowano w przypadku dawek do 5 mg/kg dwa razy na dobę. W badaniach in vitro na hepatocytach i mikrosomach wątroby stwierdzono, że izomer Z jest metabolizowany do N-tlenkowej pochodnej toceranibu u psów, ludzi, kotów i szczurów. Chociaż w badaniu in vitro zaobserwowano niewielką różnicę między płciami (81% konwersji u psów płci męskiej i 56% konwersji u psów płci żeńskiej), nie zaobserwowano różnic w farmakokinetyce toceranibu in vivo. Nie badano wpływu zaburzeń czynności nerek, zaburzeń czynności wątroby lub rasy na farmakokinetykę toceranibu.
Skuteczność
Skuteczność i bezpieczeństwo stosowania tabletek doustnych PALLADIA w leczeniu guzów komórek tucznych oceniano w randomizowanym, kontrolowanym placebo, podwójnie maskowanym, wieloośrodkowym badaniu klinicznym w terenie. Celem tego badania była ocena skuteczności i bezpieczeństwa stosowania preparatu PALLADIA w leczeniu guzów z komórek tucznych u psów, u których doszło do nawrotu mierzalnej choroby po zabiegu chirurgicznym oraz ocena obiektywnej odpowiedzi (całkowita lub częściowa odpowiedź). Leczenie produktem PALLADIA porównywano z leczeniem placebo na podstawie wskaźników odpowiedzi na zakończenie 6-tygodniowej fazy z maską. Wskaźniki odpowiedzi zostały określone przy użyciu wytycznych National Cancer Institute’s Response Evaluation Criteria in Solid Tumors Guideline3 , które zostały zmodyfikowane specjalnie do oceny nowotworów komórek tucznych u psów.
Sześćset pięćdziesiąt trzy psy zostały losowo przydzielone do leczenia produktem PALLADIA w dawce 3,25 mg/kg (n = 88) lub placebo (n = 65) doustnie, co drugi dzień przez 6 tygodni lub do czasu progresji choroby lub wycofania z badania z innej przyczyny. Leczenie zostało zdemaskowane w momencie progresji choroby: psom otrzymującym placebo zaproponowano przejście na otwartą pętlę leczenia preparatem PALLADIA; psy otrzymujące PALLADIA zostały wycofane z badania. Psy musiały mieć nawracające, skórne guzy z komórek tucznych w stopniu II lub III wg Patnaika, z zajęciem lub bez zajęcia regionalnych węzłów chłonnych. Co najmniej 1 guz musiał mieć średnicę co najmniej 20 mm. Psy miały limit 1 zakończonego protokołu radioterapii i limit 1 wcześniejszego schematu chemioterapii systemowej. Wykluczono psy, u których stwierdzono układowy nowotwór komórek tucznych. Nie zezwalano na leczenie kortykosteroidami systemowymi w trakcie badania lub w ciągu 14 dni przed rozpoczęciem badania. Jeśli było to konieczne w celu opanowania działań niepożądanych, przepisywano przerwy w podawaniu dawki (zaprzestanie podawania produktu PALLADIA na okres do 2 tygodni) i (lub) zmniejszano dawkę nawet do 2,2 mg/kg.
Analiza skuteczności wykazała statystycznie istotną przewagę produktu PALLADIA nad placebo w pierwszorzędowym punkcie końcowym skuteczności, jakim była obiektywna odpowiedź na koniec sześciotygodniowej fazy maskowanej. Obiektywna odpowiedź to odpowiedź całkowita + odpowiedź częściowa. Odpowiedź częściowa to zmniejszenie o ≥ 30% sumy najdłuższych średnic zmian docelowych, biorąc za punkt odniesienia sumę wyjściową, brak progresji zmian niebędących zmianami docelowymi i brak nowych zmian.
Mast Cell Tumor – Primary Effectiveness Endpoint Results
|
Parametr skuteczności |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-.value |
|
Objective Response Rate * |
7.9% |
37.2% |
< 0.001 |
* Różnica w odsetku obiektywnych odpowiedzi między grupami nie była istotnie związana z obciążeniem guza (obecność vs. brak zajęcia regionalnych węzłów chłonnych) ani stopniem zaawansowania nowotworu (P > 0,05).
Podczas badania produkt leczniczy PALLADIA podawano jednocześnie z innymi lekami, takimi jak środki przeciwbakteryjne, blokery receptorów H-2, leki przeciwhistaminowe, leki przeciwwymiotne, niesteroidowe leki przeciwzapalne, miejscowo działające leki przeciwwrzodowe, opiatowe leki modyfikujące motorykę przewodu pokarmowego, opioidy, szczepionki, leki przeciwrobacze, leki przeciwpasożytnicze oraz miejscowe/okulistyczne/otyczne preparaty kortykosteroidowe. Tylko podczas fazy otwartej 5 psów otrzymało krótki kurs krótko działających kortykosteroidów.
Bezpieczeństwo dla zwierząt:
W przedstawionym poniżej badaniu bezpieczeństwa u zwierząt docelowych wykazano, że produkt PALLADIA ma wąski margines bezpieczeństwa; psy leczone produktem PALLADIA powinny być monitorowane pod kątem działań niepożądanych, które mogą wskazywać na konieczność dostosowania dawki. Dwa psy w grupie otrzymującej dawkę 6 mg/kg poddano eutanazji z powodu klinicznych działań toksycznych odpowiednio w dniach 23 i 27 badania.
Toceranib podawano doustnie 20 samcom i 20 samicom dorosłych psów rasy Beagle (w wieku około 2 lat) w dawkach 0 mg/kg (placebo, 12 psów), 2 mg/kg (0,5X, 8 psów), 4 mg/kg (1X, 12 psów) lub 6 mg/kg (1,5X, 8 psów) raz na drugi dzień przez 13 kolejnych tygodni bez przerwy w podawaniu dawek. Toceranib powodował utratę masy ciała, zmniejszenie spożycia paszy, zmiany w trzustce, gonadach, nadnerczach, mięśniach i układzie krwiotwórczym.
Zużycie paszy było zmniejszone w grupie 6 mg/kg w porównaniu z placebo, z największą różnicą w średnich występującą w dniu 35. Zmniejszenie masy ciała w grupie 4 mg/kg obserwowano w dniu 31, a w grupie 6 mg/kg w dniu 15 w porównaniu z placebo i utrzymywało się ono przez cały czas trwania badania. Kulawizny związane z dawką, obserwowane prawie wyłącznie na tylnych kończynach, oraz ból kończyn były większe we wszystkich grupach leczenia w porównaniu z placebo, przy czym w grupie 6 mg/kg występowały z największą częstością. Sztywność i osłabienie występowały prawie wyłącznie w grupie otrzymującej 6 mg/kg. Zaczerwienienie błony śluzowej jamy ustnej obserwowano we wszystkich grupach leczenia. Jeden pies w grupie 4 mg/kg miał owrzodzenia jamy ustnej i jeden pies w grupie 6 mg/kg miał owrzodzenia skóry, w obu przypadkach obecne były infekcje bakteryjne. Biegunka lub miękki stolec były obserwowane we wszystkich czterech grupach.
Analizy hematologiczne wykazały zmniejszenie hematokrytu, hemoglobiny i liczby erytrocytów oraz zmniejszenie liczby retikulocytów w grupach 4 i 6 mg/kg, które miały tendencję do powrotu do normy w stopniu wystarczającym do ograniczenia dalszych spadków liczby erytrocytów. Liczba białych krwinek była znacząco niższa w trakcie całego badania we wszystkich grupach leczonych w porównaniu z placebo, głównie z powodu zmniejszenia liczby neutrofili. Liczba limfocytów zmniejszyła się w mniejszym stopniu, zwłaszcza w przypadku małej dawki. Eozynofile i bazofile wykazywały wyraźne, utrzymujące się zmniejszenie. Monocyty nie uległy zmianie.
Liczba płytek krwi nieznacznie wzrosła w grupach 4 i 6 mg/kg. Zaobserwowano wzrost fibrynogenu w grupie 4 i 6 mg/kg.
Zaobserwowano wzrost stężenia aminotransferazy asparaginianowej, kinazy kreatynowej i fosforu w surowicy w grupach 4 i 6 mg/kg. Zwiększenie fosfatazy alkalicznej zaobserwowano w grupie 6 mg/kg. Wzrost amylazy zaobserwowano u jednego psa w każdej z grup leczenia. Wzrost stężenia potasu w surowicy zaobserwowano u jednego psa w grupie 6 mg/kg. Wzrost dehydrogenazy mleczanowej i globulin zaobserwowano w grupie 6 mg/kg.
Zmiany mikroskopowe związane z leczeniem obejmowały niewielkie do znacznego zmniejszenie komórkowości szpiku kostnego mostka i kości udowej. W śledzionie występowała odpowiednia łagodna hematopoeza pozaszpikowa, głównie erytropoeza. W trzustce wystąpiła związana z dawką lekka do umiarkowanej degranulacja akinariów, charakteryzująca się rozproszoną utratą ziarnistości zymogenu. W nadnerczach wystąpiło minimalne przekrwienie/krwotok korowy przy wszystkich dawkach, z sugestywną zależnością od dawki. Wakuolizację kory nadnerczy odnotowano z niską częstotliwością we wszystkich grupach. Zmiany związane z dawką odnotowano w narządach rozrodczych obu płci. U mężczyzn stwierdzono związane z dawką zubożenie komórek rozrodczych, wakuolizację kanalików i zmniejszenie liczby dojrzałych plemników. U samic, jajniki wykazywały zmniejszoną częstość występowania dojrzałych/regresujących ciałek żółtych i zwiększoną częstość występowania małych pęcherzyków jajnikowych.
Dwa psy (jeden samiec, jedna samica) w grupie 6 mg/kg zostały poddane eutanazji z powodu toksyczności klinicznej związanej z leczeniem, odpowiednio w dniach 23 i 27 badania. Pojawienie się zespołu końcowego objawiło się znacznym zmniejszeniem pobierania pokarmu i meleną. W ciągu kolejnych 9 dni zmniejszone pobieranie pokarmu postępowało do prawie całkowitej anoreksji i pojawiła się hematochezja. Zaobserwowano utratę masy ciała, senność, kulawiznę tylnych kończyn i osłabienie. Poniższe wyniki badań klinicznych są zgodne ze zmianami zaobserwowanymi u innych psów w grupie otrzymującej 6 mg/kg, jak również ze zmianami wynikającymi ze stanu osłabienia psów tuż przed eutanazją. U obu psów stwierdzono wzrost poziomu białka całkowitego, globulin, fosforu, cholesterolu, trójglicerydów i fibrynogenu. Jeden pies miał pancytopenię, obniżony hematokryt, hemoglobinę, retikulocyty, albuminy i PT oraz podwyższone prążki. Obecny był również krwiomocz. Drugi pies miał również obniżone limfocyty, eozynofile, chlorki i sód oraz podwyższone RBC, hematokryt, hemoglobinę, płytki krwi, ALP, amylazę, kreatyninę, BUN, magnez, potas i bilirubinę całkowitą. Profil krzepnięcia wykazał obniżony PT i podwyższony PTT u obu psów. Psy te wykazywały zubożenie limfoidalne w węzłach chłonnych, grasicy i tkankach limfatycznych związanych z jelitami oraz łagodne do wyraźnych zmiany w przewodzie pokarmowym jako dodatek do wyników mikroskopowych opisanych u zwierząt, które przeżyły do końca badania. Te dwa psy miały również zmiany w przewodzie pokarmowym, nerkach, trzustce, przysadce mózgowej i nadnerczach.
Warunki przechowywania: Przechowywać w kontrolowanej temperaturze pokojowej 20° do 25° C (68° do 77° F).
Jak dostarczać
Tabletki PALLADIA zawierają 10 mg, 15 mg lub 50 mg toceranibu w postaci fosforanu toceranibu na tabletkę. Tabletki są pakowane w butelki po 30 sztuk.
1 London CA, Hannah AL, Zadovoskaya R, et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Approved by FDA
Manufactured by: Pfizer Inc, Ascoli, Włochy
Dystrybuowany przez: Zoetis Inc, Kalamazoo, MI 49007
Revised: Sierpień 2015
.