Definição: A bateria que usa chumbo esponja e peróxido de chumbo para a conversão da energia química em energia elétrica, tal tipo de bateria é chamado de bateria de chumbo ácido. A bateria de chumbo-ácido é mais comumente usada nas estações de energia e subestações porque tem maior tensão de célula e menor custo.
Construção da bateria de chumbo-ácido
As várias partes da bateria de chumbo-ácido são mostradas abaixo. O recipiente e as placas são a parte principal da bateria de chumbo-ácido. O contentor armazena energia química que é convertida em energia eléctrica pela ajuda das placas.
1. Recipiente – O recipiente da bateria de chumbo ácido é feito de vidro, madeira revestida de chumbo, ebonite, borracha dura de composto betuminoso, materiais cerâmicos ou plásticos moldados e são assentados na parte superior para evitar a descarga do eletrólito. Na parte inferior do recipiente há quatro costelas, em duas delas repousa a placa positiva e as outras suportam as placas negativas.
O prisma serve de suporte para as placas e ao mesmo tempo protege-as de um curto-circuito.O material de que são feitos os recipientes das baterias deve ser resistente ao ácido sulfúrico, não deve deformar ou ser poroso, ou conter impurezas que danifiquem o eletrólito.
2. Placa – A placa da célula chumbo-ácido é de design diverso e todas elas consistem em alguma forma de grade que é feita de chumbo e do material ativo. A rede é essencial para conduzir a corrente elétrica e para distribuir a corrente igualmente sobre o material ativo. Se a corrente não for distribuída uniformemente, então o material ativo se solta e cai.
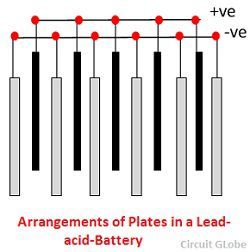 As grades são constituídas por uma liga de chumbo e antimônio. Estas são geralmente feitas com a costela transversal que atravessa os lugares em ângulo reto ou diagonalmente. As grelhas para as placas positivas e negativas são do mesmo desenho, mas as grelhas para as placas negativas são feitas mais leves porque não são tão essenciais para a condução uniforme da corrente.
As grades são constituídas por uma liga de chumbo e antimônio. Estas são geralmente feitas com a costela transversal que atravessa os lugares em ângulo reto ou diagonalmente. As grelhas para as placas positivas e negativas são do mesmo desenho, mas as grelhas para as placas negativas são feitas mais leves porque não são tão essenciais para a condução uniforme da corrente.
As placas da bateria são de dois tipos. São as placas formadas ou placas plante e placas coladas ou faure.
As placas plante são usadas em grande parte para baterias estacionárias, pois são mais pesadas e mais caras do que as placas coladas. Mas as placas são mais duráveis e menos susceptíveis de perder material activo ao carregar e descarregar rapidamente. A placa plante tem baixa capacidade de relação de peso.
O processo Plante é muito mais adequado para a fabricação de placas negativas do que de placas positivas. O material ativo negativo é bastante resistente, e sofre uma mudança comparativamente baixa de carga e descarga.
3. Material ativo – O material em uma célula que toma participação ativa em uma reação química (absorção ou evolução de energia elétrica) durante a carga ou descarga é chamado de material ativo da célula. Os elementos ativos do ácido de chumbo são
- Peróxido de chumbo (PbO2) – Ele forma o material ativo positivo. Os PbO2 são vassouras de chocolate de cor escura.
- Chumbo esponjoso – Forma o material activo negativo. É de cor cinza.
- Ácido Sulfúrico Diluído (H2SO4) – É usado como eletrólito. Contém 31% de ácido sulfúrico.
O peróxido de chumbo e o chumbo esponja, que formam os materiais ativos negativos e positivos têm a pouca resistência mecânica e, portanto, podem ser usados sozinhos.
4. Separadores – Os separadores são folhas finas de material não condutor composto de madeira de chumbo tratada quimicamente, borrachas porosas ou tapetes de fibra de vidro e são colocados entre o positivo e o negativo para isolá-los uns dos outros. Os separadores são ranhurados verticalmente de um lado e são lisos do outro lado.
5. Terminais de Bateria – Uma bateria tem dois terminais, o positivo e o negativo. O terminal positivo com um diâmetro de 17,5 mm no topo é ligeiramente maior do que o terminal negativo que tem 16 mm de diâmetro.
Princípio de Funcionamento da Bateria de Ácido Chumbo
Quando o ácido sulfúrico se dissolve, as suas moléculas dividem-se em iões de hidrogénio positivos (2H+) e iões negativos de sulfato (SO4-) e movem-se livremente. Se os dois eléctrodos estiverem imersos em soluções e ligados à alimentação DC, então os iões de hidrogénio são carregados positivamente e movem-se em direcção aos eléctrodos e ligados ao terminal negativo da alimentação. Os íons SO4- que estão sendo carregados negativamente movem-se em direção aos eletrodos conectados ao terminal positivo da fonte de alimentação (ou seja, os íons SO4-), anodo).
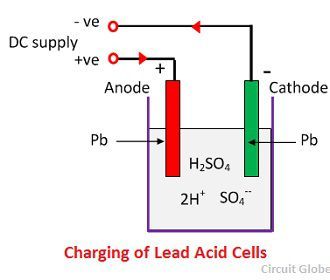 Cada íon de hidrogénio retira um electrão do cátodo, e cada ião sulfato retira os dois iões negativos dos anodos e reage com água e forma ácido sulfúrico e ácido hidrogénio.
Cada íon de hidrogénio retira um electrão do cátodo, e cada ião sulfato retira os dois iões negativos dos anodos e reage com água e forma ácido sulfúrico e ácido hidrogénio.
>
O oxigénio, que produzido a partir da equação acima reage com óxido de chumbo e forma peróxido de chumbo (PbO2.) Assim, durante a carga o cátodo de chumbo permanece como chumbo, mas o ânodo de chumbo é convertido em peróxido de chumbo, chocolate na cor.
Se a fonte de alimentação DC for desconectada e se o voltímetro se conectar entre os eletrodos, ele mostrará a diferença potencial entre eles. Se o fio ligar os eléctrodos, então a corrente fluirá da placa positiva para a placa negativa através do circuito externo, ou seja, a célula é capaz de fornecer energia eléctrica.
Acção química durante a descarga
Quando a célula está em descarga total, então o anodo é de peróxido de chumbo (PbO2) e um cátodo é de chumbo esponjoso metálico (Pb). Quando os eléctrodos são ligados através de uma resistência, a descarga da célula e os eléctrodos fluem numa direcção oposta à que se verifica durante a carga.
Os iões de hidrogénio deslocam-se para o ânodo e atingindo os ânodos recebem um electrão do ânodo e tornam-se átomo de hidrogénio. O átomo de hidrogénio entra em contacto com um PbO2, pelo que ataca e forma sulfato de chumbo (PbSO4), de cor esbranquiçada e água de acordo com a equação química.
>
>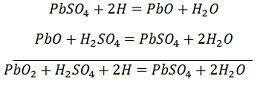
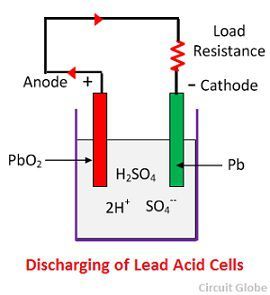 O ião sulfato (SO4-) move-se em direcção ao cátodo e chegando lá, dois electrões tornam-se SO4 radicais, atacam o cátodo metálico de chumbo e formam sulfato de chumbo de cor esbranquiçada de acordo com a equação química.
O ião sulfato (SO4-) move-se em direcção ao cátodo e chegando lá, dois electrões tornam-se SO4 radicais, atacam o cátodo metálico de chumbo e formam sulfato de chumbo de cor esbranquiçada de acordo com a equação química.
Acção química durante a recarga
Para recarregar, o ânodo e o cátodo estão ligados ao terminal positivo e ao terminal negativo da rede de alimentação DC. As moléculas do ácido sulfúrico dividem-se em íons de 2H+ e SO4-. Os íons de hidrogênio carregados positivamente se movem em direção aos cátodos e recebem dois elétrons de lá e formam um átomo de hidrogênio. O átomo de hidrogênio reage com o catodo sulfato de chumbo formando chumbo e ácido sulfúrico de acordo com a equação química.
>![]()
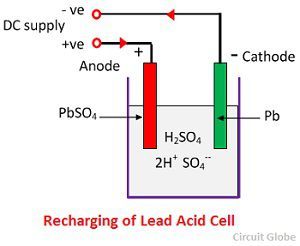 SO4-ion se move para o ânodo, desiste de seus dois elétrons adicionais e se torna SO4 radical, reage com o ânodo sulfato de chumbo e forma peróxido de chumbo e ácido sulfúrico de acordo com a equação química.
SO4-ion se move para o ânodo, desiste de seus dois elétrons adicionais e se torna SO4 radical, reage com o ânodo sulfato de chumbo e forma peróxido de chumbo e ácido sulfúrico de acordo com a equação química.![]() A carga e a descarga são representadas por uma única equação reversível dada abaixo.
A carga e a descarga são representadas por uma única equação reversível dada abaixo.
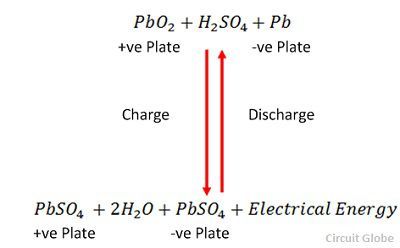 A equação deve ler-se para baixo para a descarga e para cima para a recarga.
A equação deve ler-se para baixo para a descarga e para cima para a recarga.