Lärandemål
- Beskriv hur elektroner beter sig och var de är placerade, och hur dessa faktorer påverkar bindningsbildningen mellan atomer
Elektronskålar och Bohrmodellen

Figur 1. Bohrmodellen.
Det bör betonas att det finns ett samband mellan antalet protoner i ett grundämne, atomnumret som skiljer ett grundämne från ett annat, och antalet elektroner det har. I alla elektriskt neutrala atomer är antalet elektroner detsamma som antalet protoner. Således har varje grundämne, åtminstone när det är elektriskt neutralt, ett karakteristiskt antal elektroner som är lika med dess atomnummer.
En tidig modell av atomen utvecklades 1913 av den danske forskaren Niels Bohr (1885-1962). I denna modell existerar elektronerna i huvudskal. En elektron befinner sig normalt i det skal med lägst energi som finns tillgängligt, vilket är det som ligger närmast kärnan. Energi från en ljusfoton kan föra upp den till ett skal med högre energi, men denna situation är instabil och elektronen sönderfaller snabbt tillbaka till grundtillståndet. I processen frigörs en ljusfoton.
Berrs modell visar atomen som en central kärna som innehåller protoner och neutroner, med elektronerna i cirkulära banor på specifika avstånd från kärnan, vilket illustreras i figur 1. Dessa banor bildar elektronskal eller energinivåer, som är ett sätt att visualisera antalet elektroner i de yttersta skalen. Dessa energinivåer betecknas med ett nummer och symbolen ”n”. Till exempel representerar 1n den första energinivån som ligger närmast kärnan.
Elektronerna fyller banor i en konsekvent ordning: de fyller först de banor som ligger närmast kärnan, sedan fortsätter de att fylla banor med ökande energi längre bort från kärnan. Om det finns flera orbitaler med samma energi kommer de att fyllas med en elektron i varje energinivå innan en andra elektron läggs till. Elektronerna i den yttersta energinivån bestämmer atomens energistabilitet och dess tendens att bilda kemiska bindningar med andra atomer för att bilda molekyler.
Under standardförhållanden fyller atomerna de inre skalen först, vilket ofta resulterar i ett varierande antal elektroner i det yttersta skalet. Det innersta skalet har högst två elektroner, men de två följande elektronskalen kan vardera ha högst åtta elektroner. Detta är känt som oktettregeln, som säger, med undantag för det innersta skalet, att atomer är mer stabila energimässigt när de har åtta elektroner i sitt valensskal, det yttersta elektronskalet. Exempel på några neutrala atomer och deras elektronkonfigurationer visas i figur 2. Lägg märke till att helium i denna figur har ett komplett yttre elektronskal, med två elektroner som fyller det första och enda skalet. På samma sätt har neon ett fullständigt yttre 2n-skal som innehåller åtta elektroner. Däremot har klor och natrium sju respektive en i sina yttre skal, men teoretiskt sett skulle de vara mer energimässigt stabila om de följde oktettregeln och hade åtta.
Praktikfråga
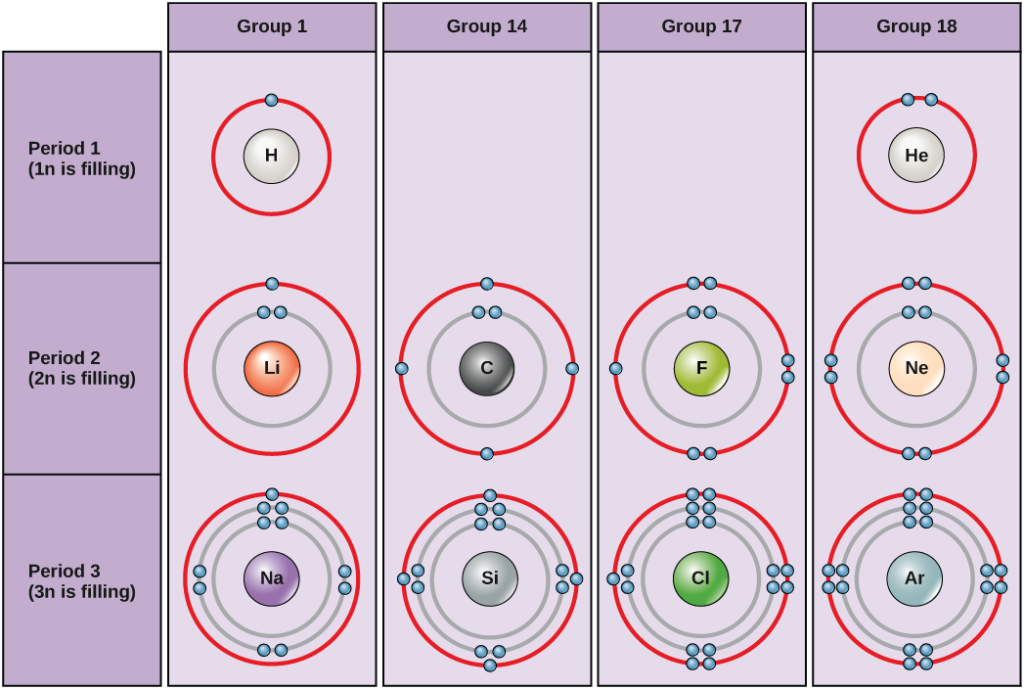
Figur 2. Bohrdiagram för väte, helium, litium, kol, fluor, neon, natrium, kisel, klor och argon.
Bohrdiagrammen anger hur många elektroner som fyller varje huvudskal. Elementen i grupp 18 (helium, neon och argon visas i figur 2) har ett fullständigt yttre skal, eller valensskal. Ett fullt valensskal är den mest stabila elektronkonfigurationen. Element i andra grupper har delvis fyllda valensskal och får eller förlorar elektroner för att uppnå en stabil elektronkonfiguration.
En atom kan ge, ta eller dela elektroner med en annan atom för att uppnå ett fullt valensskal, den mest stabila elektronkonfigurationen. Om du tittar på figuren, hur många elektroner måste grundämnena i grupp 1 förlora för att uppnå en stabil elektronkonfiguration? Hur många elektroner måste grundämnena i grupperna 14 och 17 ta till sig för att uppnå en stabil konfiguration?
Om vi förstår att det periodiska systemets organisation bygger på det totala antalet protoner (och elektroner) kan vi lättare förstå hur elektronerna fördelas i det yttre skalet. Det periodiska systemet är ordnat i kolumner och rader baserat på antalet elektroner och var dessa elektroner är placerade. Titta närmare på några av grundämnena i det periodiska systemets kolumn längst till höger i figur 3.

Figur 3. Det periodiska systemet visar varje grundämnes atommassa och atomnummer. Atomnumret visas ovanför symbolen för grundämnet och den ungefärliga atommassan visas nedanför.
Atomerna i grupp 18 helium (He), neon (Ne) och argon (Ar) har alla fyllda yttre elektronskal, vilket gör att de inte behöver dela elektroner med andra atomer för att uppnå stabilitet; de är mycket stabila som enskilda atomer. Deras icke-reaktivitet har resulterat i att de kallas inerta gaser (eller ädelgaser). Jämför detta med grundämnena i grupp 1 i den vänstra kolumnen. Dessa grundämnen, inklusive väte (H), litium (Li) och natrium (Na), har alla en elektron i sina yttersta skal. Det innebär att de kan uppnå en stabil konfiguration och ett fyllt yttre skal genom att donera eller dela en elektron med en annan atom eller en molekyl som t.ex. vatten. Vätgas kommer att donera eller dela sin elektron för att uppnå denna konfiguration, medan litium och natrium kommer att donera sin elektron för att bli stabila. När de förlorar en negativt laddad elektron blir de positivt laddade joner. Grundämnen i grupp 17, däribland fluor och klor, har sju elektroner i sina yttersta skal, så de tenderar att fylla detta skal med en elektron från andra atomer eller molekyler, vilket gör dem till negativt laddade joner. Elementen i grupp 14, av vilka kol är det viktigaste för levande system, har fyra elektroner i sitt yttersta skal, vilket gör att de kan göra flera kovalenta bindningar (som diskuteras nedan) med andra atomer. Kolumnerna i det periodiska systemet representerar således det potentiella delade tillståndet i dessa grundämnenas yttre elektronskal som är ansvarigt för deras liknande kemiska egenskaper.
Elektronorbitaler
Och även om den är användbar för att förklara vissa grundämnenas reaktivitet och kemiska bindningar, så återspeglar Bohrmodellen av atomen inte exakt hur elektronerna är rumsligt fördelade runt kärnan. De kretsar inte runt kärnan som jorden kretsar runt solen, utan befinner sig i elektronorbitaler. Dessa relativt komplexa former beror på att elektroner inte bara beter sig som partiklar utan också som vågor. Matematiska ekvationer från kvantmekaniken, så kallade vågfunktioner, kan med en viss grad av sannolikhet förutsäga var en elektron kan befinna sig vid en viss tidpunkt. Det område där en elektron med största sannolikhet befinner sig kallas för dess omloppsbana.

Figur 4. Klicka för en större bild. S-delskalen är formade som sfärer. Både 1n- och 2n-huvudskalet har ett s-orbital, men sfärens storlek är större i 2n-orbitalet. Varje sfär är en enda orbital. p-subskal består av tre hantelformade orbitaler. Huvudskal 2n har ett p-subskal, men skal 1 har inte det.
Håll dig i minnet att Bohrmodellen avbildar en atoms elektronskalkonfiguration. Inom varje elektronskal finns underskal, och varje underskal har ett specificerat antal orbitaler som innehåller elektroner. Även om det är omöjligt att beräkna exakt var en elektron befinner sig vet forskarna att den med största sannolikhet befinner sig inom sin banbana. Delskal betecknas med bokstäverna s, p, d och f. Delskalet s är sfäriskt till formen och har en orbital. Huvudskalet 1n har endast en enda s-orbital, som kan rymma två elektroner. Huvudskal 2n har ett s- och ett p-subskal och kan innehålla totalt åtta elektroner. P-subskalet har tre hantelformade orbitaler, vilket illustreras i figur 4. Underskal d och f har mer komplexa former och innehåller fem respektive sju orbitaler. Dessa visas inte i illustrationen. Huvudskal 3n har s-, p- och d-underskal och kan innehålla 18 elektroner. Huvudskal 4n har s-, p-, d- och f-orbitaler och kan innehålla 32 elektroner. När man rör sig bort från kärnan ökar antalet elektroner och orbitaler som finns i energinivåerna. Om man går från en atom till nästa i det periodiska systemet kan elektronstrukturen utarbetas genom att passa in en extra elektron i nästa tillgängliga orbital.
Den närmaste orbitalen till kärnan, kallad 1s orbital, kan rymma upp till två elektroner. Denna orbital motsvarar det innersta elektronskalet i Bohrs modell av atomen. Den kallas 1s orbital eftersom den är sfärisk runt kärnan. 1s-blocket är det som ligger närmast kärnan, och det fylls alltid först, innan något annat bälte kan fyllas. Vätgas har en elektron; därför har den bara en plats i 1s-borgitalet som är upptagen. Detta betecknas som 1s1, där den översatta 1:an hänvisar till den enda elektronen i 1s-boplatsen. Helium har två elektroner och kan därför helt fylla 1s-bitalet med sina två elektroner. Detta betecknas som 1s2, vilket hänvisar till heliums två elektroner i 1s-bitalet. I det periodiska systemet figur 4 är väte och helium de enda två grundämnena i den första raden (perioden); detta beror på att de endast har elektroner i sitt första skal, 1s-bitalet. Väte och helium är de enda två grundämnena som har 1s och inga andra elektronorbitaler i det elektriskt neutrala tillståndet.
Det andra elektronskalet kan innehålla åtta elektroner. Detta skal innehåller ytterligare en s-orbital i sfärisk form och tre ”hantelformade” p-orbitaler, som var och en kan innehålla två elektroner, vilket visas i figur 4. Efter det att 1s-bobitalen är fylld fylls det andra elektronhöljet genom att först fylla dess 2s-bobital och sedan dess tre p-orbitaler. När p-orbitalerna fylls tar var och en av dem en enda elektron; när varje p-orbital har en elektron kan en andra läggas till. Litium (Li) innehåller tre elektroner som upptar det första och andra skalet. Två elektroner fyller 1s-bokalen, och den tredje elektronen fyller sedan 2s-bokalen. Dess elektronkonfiguration är 1s22s1. Neon (Ne), å andra sidan, har totalt tio elektroner: två finns i dess innersta 1s-orbital och åtta fyller det andra skalet (två vardera i 2s- och tre p-orbitaler); det är alltså en inert gas och energimässigt stabil som en enskild atom som sällan kommer att bilda en kemisk bindning med andra atomer. Större grundämnen har ytterligare orbitaler som utgör det tredje elektronskalet. Även om begreppen elektronskal och orbitaler är nära besläktade ger orbitaler en mer exakt skildring av en atoms elektronkonfiguration eftersom orbitalmodellen specificerar de olika formerna och de speciella orienteringarna för alla platser som elektroner kan ta upp.
Se den här visuella animationen för att se det rumsliga arrangemanget av p- och s-orbitalerna. Observera att denna video inte har något ljud.
Du kan se ljudbeskrivningstexten för ”Atomic Orbitals – Electron Configuration of Scandium” här (öppnas i nytt fönster).
Videoöversikt
Denna video ger en annan översikt över elektronen:
Try It
Bidraga!
Förbättra den här sidanLär dig mer