A molekuláris klónozás – ez a kifejezés a rekombináns DNS-molekulák létrehozását jelenti – az élettudományok fejlődését ösztönözte. Az 1970-es években, a restrikciós endonukleázok – a DNS-molekulákat szelektíven és specifikusan elvágó enzimek – felfedezésével kezdődően a rekombináns DNS-technológia exponenciálisan növekedett mind az alkalmazás, mind a kifinomultság tekintetében, és egyre hatékonyabb eszközöket eredményezett a DNS-manipulációhoz. A gének klónozása ma már olyan egyszerű és hatékony, hogy standard laboratóriumi technikává vált. Ez a génműködés megértésének robbanásszerű fejlődéséhez vezetett az elmúlt évtizedekben. A feltörekvő technológiák még nagyobb lehetőségeket ígérnek, például lehetővé teszik a kutatók számára, hogy több DNS-fragmentumot zökkenőmentesen, kevesebb mint két óra alatt összefűzzenek és az így kapott plazmidokat baktériumokba transzformálják, vagy a sebesség és rugalmasság maximalizálása érdekében cserélhető génkazettákat használjanak, amelyek könnyen mozgathatók a különböző konstrukciók között. A közeljövőben a molekuláris klónozásban valószínűleg egy új paradigma fog megjelenni a szintetikus biológiai technikákkal, amelyek lehetővé teszik bármely in vitro kémiai szintézisét a szilíciumban meghatározott DNS-konstrukciónak. Ezek az előrelépések lehetővé teszik a DNS-klónok gyorsabb felépítését és iterációját, felgyorsítva a génterápiás vektorok, rekombináns fehérje előállítási eljárások és új vakcinák fejlesztését.
Rebecca Tirabassi, Bitesize Bio.
Bevezetés
A molekuláris klónozás egy DNS-szekvencia izolálását jelenti bármely fajból (gyakran egy gén), és annak beillesztését egy vektorba szaporítás céljából, az eredeti DNS-szekvencia megváltoztatása nélkül. Az izolálás után a molekuláris klónok felhasználhatók a DNS számos példányának előállítására a génszekvencia elemzésére és/vagy a keletkező fehérje expressziójára a fehérje funkciójának tanulmányozása vagy hasznosítása céljából. A klónok in vitro is manipulálhatók és mutálhatók a fehérje expressziójának és funkciójának megváltoztatása érdekében.
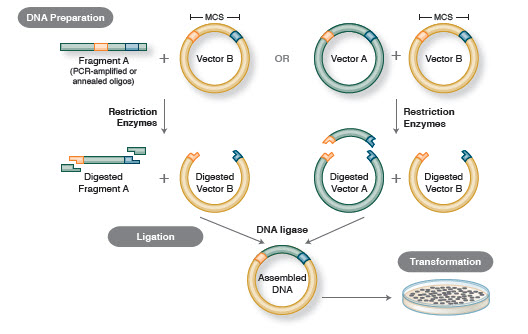
A klónozás alapvető munkafolyamata négy lépést tartalmaz:
- Cél DNS-töredékek izolálása (gyakran inzerteknek nevezik)
- Az inzertek megfelelő klónozó vektorba történő ligálása, rekombináns molekulák létrehozása (pl., plazmidok)
- A rekombináns plazmidok transzformációja baktériumokba vagy más, szaporításra alkalmas gazdaszervezetbe
- A tervezett rekombináns plazmidot tartalmazó gazdaszervezetek szűrése/kiválasztása
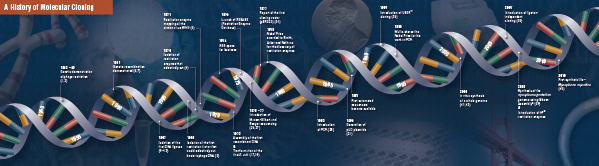
Ezt a négy úttörő lépést az 1960-as évek végén és az 1970-es évek elején kezdődően több laboratórium gondosan összerakta és elvégezte. A hagyományos molekuláris klónozást alkotó felfedezések összefoglalása a következő oldalakon olvasható.
A klónozás története
A molekuláris klónozás alapjai
Vágás (emésztés). A rekombináns DNS-technológia először az 1960-as évek végén jelent meg, amikor felfedezték azokat az enzimeket, amelyek képesek voltak a kettős szálú DNS-molekulák specifikus elvágására és összekapcsolására. Valójában már 1952-ben két csoport egymástól függetlenül megfigyelte, hogy a baktériumok kódolnak egy “restrikciós faktort”, amely megakadályozza a bakteriofágok növekedését bizonyos gazdaszervezetekben (1,2). A faktor természetét azonban csak 1968-ban fedezték fel, amikor Arbernek és Linn-nek sikerült izolálnia egy olyan, restrikciós faktornak nevezett enzimet, amely szelektíven vágja az exogén DNS-t, de a bakteriális DNS-t nem (3). Ezek a vizsgálatok egy metiláz enzimet is azonosítottak, amely megvédte a bakteriális DNS-t a restrikciós enzimektől.
Röviddel Arber és Linn felfedezése után Smith kiterjesztette és megerősítette ezeket a vizsgálatokat egy Haemophilus influenzából származó restrikciós enzim izolálásával. Kimutatta, hogy az enzim szelektíven vágja a DNS-t egy meghatározott 6 bázispárnyi DNS-szakasz közepén; bizonyos restrikciós enzimek egyik jellemzője, hogy hajlamosak a DNS-szubsztrátot meghatározott, gyakran palindromos “felismerő” szekvenciákban vagy azok közelében elvágni (4).
A restrikciós enzimek teljes erejét csak akkor ismerték fel, amikor a restrikciós enzimeket és a gélelektroforézist a Simian Virus 40 (SV40) genom feltérképezésére használták (5). Ezekért a korszakalkotó eredményekért Werner Arber, Hamilton Smith és Daniel Nathans megosztva kapta az 1978-as orvosi Nobel-díjat.
1. ábra. Hagyományos klónozási munkafolyamat
Assembling (Ligation). A DNS-t vágó enzimek felfedezéséhez hasonlóan a DNS-t összeilleszteni képes enzim felfedezését is korábbi, kiemelkedő megfigyelések előzték meg. Az 1960-as évek elején két csoport fedezte fel, hogy a genetikai rekombináció a DNS-molekulák törése és ligálása révén történhet (6,7), amit szorosan követett az a megfigyelés, hogy a lineáris bakteriofág DNS a gazdaszervezet megfertőzése után gyorsan kovalensen zárt körré alakul (8). Alig két évvel később öt csoport egymástól függetlenül izolálta a DNS-ligázokat, és kimutatta, hogy képesek két DNS-darabot összerakni (9-13).
Nem sokkal a restrikciós enzimek és a DNS-ligázok felfedezése után elkészült az első rekombináns DNS-molekula. 1972-ben Berg külön-külön vágott és ligált egy darab lambda bakteriofág DNS-t vagy az E. coli galaktóz operonját SV40 DNS-sel, hogy létrehozza az első rekombináns DNS-molekulákat (14). Ezek a vizsgálatok úttörő szerepet játszottak abban a koncepcióban, hogy a DNS univerzális természete miatt bármely fajból származó DNS összekapcsolható. 1980-ban Paul Berg megosztva kapta meg a kémiai Nobel-díjat Walter Gilberttel és Frederick Sangerrel (a DNS-szekvenálás kifejlesztőivel), “a nukleinsavak biokémiájával kapcsolatos alapvető tanulmányaiért, különös tekintettel a rekombináns DNS-re”.
Transzformáció. A rekombináns DNS-technológia erősen korlátozott lenne, és a molekuláris klónozás lehetetlen lenne az újonnan létrehozott DNS-molekula szaporításának és izolálásának eszközei nélkül. A baktériumok transzformálásának képességét, vagyis az idegen genetikai anyag felvételének, beépülésének és kifejeződésének előidézését Griffith mutatta be először, amikor egy nem halálos baktériumtörzset egy halálos törzzsé transzformált úgy, hogy a nem halálos törzset hővel inaktivált halálos baktériumokkal keverte (15). A letalitást eredményező “transzformációs elv” természetét azonban csak 1944-ben értették meg. Ugyanebben az évben Avery, Macleod és McCarty kimutatta, hogy a DNS, és nem a fehérje felelős a letális fenotípus kiváltásáért (16).
Eredetileg úgy gondolták, hogy a gyakori laboratóriumi baktériumtörzs, az E. coli, ellenáll az átalakulásnak, amíg Mandel és Higa be nem mutatta, hogy az E. coli kalcium-kloriddal való kezelése a bakteriofág DNS felvételét indukálja (17). Cohen 1972-ben alkalmazta ezt az elvet, amikor úttörő szerepet játszott a baktériumok plazmidokkal való transzformálásában, hogy a baktériumokat antibiotikum-rezisztenciával ruházza fel (18).
A végső kísérletet: egy rekombináns DNS-molekula emésztését, ligálását és transzformációját Boyer, Cohen és Chang hajtotta végre 1973-ban, amikor a pSC101 plazmidot EcoRI-vel emésztették, a linearizált fragmentumot egy másik enzimre korlátozott plazmidhoz ligálták, és az így kapott rekombináns molekulát transzformálták E. coliba, tetraciklin-rezisztenciát kölcsönözve a baktériumnak (19), ezzel megalapozva az azóta végzett legtöbb rekombináns DNS-munkát.
Az alapokra építve
Míg a tudósok felfedezték és alkalmazták a rekombináns DNS baktériumokban történő létrehozásának és szaporításának összes alapelvét, a folyamat nem volt hatékony. A restrikciós enzimkészítmények a nem szabványosított tisztítási eljárások miatt megbízhatatlanok voltak, a klónozáshoz használt plazmidok nehézkesek, nehezen feldolgozhatók és korlátozott számúak voltak, a kísérleteket pedig az izolálható inzert DNS mennyisége korlátozta. A következő évtizedek kutatásai a molekuláris klónozáshoz rendelkezésre álló technikák és eszközök fejlesztéséhez vezettek.
Kora vektortervezés.
Az első szabványosított vektor kifejlesztése. A Boyer laboratóriumában dolgozó tudósok felismerték, hogy szükség van egy általános klónozó plazmidra, egy olyan kompakt plazmidra, amely egyedi restrikciós helyekkel rendelkezik az idegen DNS klónozásához és az antibiotikum-rezisztencia gének kifejezésére a transzformált baktériumok szelekciójához. 1977-ben leírták az első klónozási célokra tervezett vektort, a pBR322-t (20). Ez a vektor kicsi, ~4 kilobázis méretű volt, és két antibiotikum-rezisztencia gént tartalmazott a szelekcióhoz.
Vektorok fedélzeti szűréssel és nagyobb hozammal. Bár az antibiotikum-szelekció megakadályozta a nem transzformált baktériumok növekedését, az inzert DNS-fragmentumok nélkül religált plazmidok (önligálás) mégis képesek voltak antibiotikum-rezisztenciát kölcsönözni a baktériumoknak. Ezért a megfelelő, a kívánt rekombináns DNS-molekulát tartalmazó baktériumklónok megtalálása időigényes lehetett.
Vieira és Messing kidolgozott egy szűrőeszközt a DNS-inszerttel rendelkező plazmidokat tartalmazó baktériumtelepek azonosítására. A pBR322 plazmid alapján létrehozták a pUC plazmidok sorozatát, amely egy “kék-fehér szűrőrendszert” tartalmazott (21). A LacZ´ génen belül több egyedi restrikciós helyet tartalmazó többszörös klónozási hely (MCS) elhelyezése lehetővé tette a kutatók számára az idegen DNS-beillesztést tartalmazó plazmidokat tartalmazó baktériumtelepek szűrését. Amikor a baktériumokat a megfelelő táptalajra ültették, a fehér telepek inszerttel rendelkező plazmidokat, míg a kék telepek inszerttel nem rendelkező plazmidokat tartalmaztak. A pUC plazmidok további előnnyel rendelkeztek a meglévő vektorokkal szemben; olyan mutációt tartalmaztak, amely nagyobb kópiaszámot eredményezett, így növelve a plazmidhozamot.
A restrikciós emésztések javítása. A restrikciós enzimekkel végzett korai munkát hátráltatta az enzimkészítmény tisztasága és az egyes enzimek pufferigényének ismeretének hiánya. 1975-ben a New England Biolabs (NEB) lett az első cég, amely rekombináns forrásból előállított restrikciós enzimeket hozott forgalomba. Ez nagyobb hozamot, nagyobb tisztaságot, tételenkénti konzisztenciát és alacsonyabb árakat tett lehetővé. Jelenleg több mint 4000 restrikciós enzimet fedeztek fel a tudósok világszerte, amelyek több mint 300 különböző szekvenciát ismernek fel. A NEB jelenleg több mint 230 ilyen specifikumot szállít.
A NEB volt az egyik első vállalat, amely kifejlesztett egy szabványosított négy pufferrendszert, és az összes enzimaktivitását ebben a pufferrendszerben jellemezte. Ez vezetett a kettős emésztés, vagyis a DNS egyidejűleg két enzimmel történő emésztésének jobb megértéséhez. A későbbi kutatások az egy pufferes rendszerek kifejlesztéséhez vezettek, amelyek kompatibilisek a leggyakoribb restrikciós enzimekkel (például a NEB CutSmart™ pufferével).
A kereskedelmi forgalomban kapható, ismert szekvenciaspecifitású restrikciós enzimkönyvtárak megjelenésével a restrikciós enzimek hatékony eszközzé váltak a potenciális rekombináns DNS-klónok szűrésére. A “diagnosztikus emésztés” volt és ma is az egyik legelterjedtebb technika a molekuláris klónozásban.
Vektorok és inzertek előkészítése. A klónozás hatékonyságát és sokoldalúságát a vektorok ligálás előtti előkészítésére szolgáló különböző technikák kifejlesztése is javította. Izolálták az alkalikus foszfatázokat, amelyek képesek eltávolítani a 3´ és 5´ foszfátcsoportokat a DNS végeiről . Hamarosan felfedezték, hogy a vektorok Calf-Intestinal Phosphatase (CIP) kezelésével a DNS végei foszforilálódtak, és megakadályozták a vektor önligálódását, növelve az inszertet tartalmazó plazmidok visszanyerését (24).
A CIP enzimet nehéznek bizonyult inaktiválni, és minden maradék aktivitás az inszert DNS defoszforilációjához és a ligációs reakció gátlásához vezetett. A hőlabilis alkalikus foszfatázok, például a rekombináns garnélarák alkalikus foszfatáz (rSAP) és az antarktikus foszfatáz (AP) (mindkettőt a NEB forgalmazza) felfedezése csökkentette a szükséges lépéseket és időt, mivel a hőmérséklet egyszerű megváltoztatása inaktiválja az enzimet a ligációs lépés előtt (25).
A DNS-szekvenálás megérkezik. A DNS-szekvenálást az 1970-es évek végén fejlesztették ki, amikor két konkurens módszert dolgoztak ki. Maxam és Gilbert kifejlesztette a “kémiai szekvenálási módszert”, amely a DNS kémiai módosítására és az azt követő hasításra támaszkodott bizonyos bázisoknál (26). Ugyanebben az időben Sanger és munkatársai publikálták a “láncvégződéses módszert”, amely a legtöbb kutató által használt módszerré vált (27). A Sanger-módszer gyorsan automatizálttá vált, és az első automata szekvenálógépeket 1987-ben kezdték el forgalmazni.
A DNS egy szakaszának szekvenciájának meghatározására való képesség növelte a molekuláris klónozás megbízhatóságát és sokoldalúságát. A klónozást követően a tudósok szekvenálhatták a klónokat a megfelelő rekombináns molekula végleges azonosítása, új gének vagy génmutációk azonosítása, valamint az ismert szekvencia alapján könnyen tervezhettek oligonukleotidokat további kísérletekhez.
A polimeráz láncreakció hatása. A molekuláris klónozás egyik problémája a kezdeti években az volt, hogy elegendő inzert DNS-t szerezzenek a vektorba történő klónozáshoz. Mullis 1983-ban kidolgozott egy olyan technikát, amely megoldotta ezt a problémát, és forradalmasította a molekuláris klónozást (28). A cél-DNS egy szakaszát úgy amplifikálta, hogy ellentétes primereket használt a DNS mindkét komplementer szálának egyidejű amplifikálásához. Denaturálási, lágyítási és polimerizációs ciklusok segítségével kimutatta, hogy exponenciálisan tudta felerősíteni a DNS egyetlen példányát. A polimeráz láncreakció vagy PCR lehetővé tette a gének felerősítését és klónozását korábban nem megfelelő mennyiségű DNS-ből. Ezért a felfedezésért Kary Mullis 1993-ban megosztva kapta meg a kémiai Nobel-díjat “a DNS-alapú kémián belüli módszerek fejlesztéséhez való hozzájárulásáért”.
1970-ben Temin és Baltimore egymástól függetlenül felfedezte a vírusokban a reverz transzkriptázt, egy olyan enzimet, amely az RNS-t DNS-é alakítja át (29,30). Röviddel a PCR kifejlesztése után a reverz transzkripciót összekapcsolták a PCR-rel (RT-PCR), hogy lehetővé tegyék a hírvivő RNS (mRNS) klónozását. A reverz transzkripciót az mRNS DNS-kópiájának (cDNS) létrehozására használták, amelyet ezt követően PCR-rel felerősítettek, hogy létrehozzák a ligáláshoz szükséges inszertet. Az enzim felfedezéséért Howard Temin és David Baltimore 1975-ben megkapta az orvosi és élettani Nobel-díjat, amelyet Renato Dulbeccóval megosztva kaptak.
PCR-termékek klónozása. A PCR megjelenése azt jelentette, hogy a kutatók immár az amplikonok szekvenciájának korlátozott ismerete mellett is klónozhattak géneket és DNS-szakaszokat. A klónozási vektorokba történő hatékony ligáláshoz szükséges PCR-termék-előkészítés optimális módszerét illetően azonban nem volt egyetértés.
A PCR-termékek klónozására kezdetben többféle módszert is alkalmaztak. A PCR-termékek klónozásának legegyszerűbb és még mindig legelterjedtebb módszere a restrikciós helyek bevezetése a PCR-termék végére (31). Ez lehetővé teszi az inszert közvetlen, irányított klónozását a vektorba a restrikciós emésztés után. A tompa végű klónozást olyan PCR-termékek közvetlen ligálására fejlesztették ki, amelyeket tompa végű polimerázok hoztak létre, vagy olyan restrikciós helyeket tartalmazó inzertek előállítására, amelyek az inzert emésztése után tompa végűek maradtak. Ez olyan DNS-töredékek klónozásánál volt hasznos, amelyek nem tartalmaztak a vektorral kompatibilis restrikciós helyeket (32).
Röviddel a PCR bevezetése után bevezették az átfedéses hosszabbító PCR-t, mint a PCR-termékek egyetlen összefüggő DNS-szekvenciává történő összeállításának módszerét (33). Ennél a módszernél a DNS-inzertet PCR segítségével olyan primerekkel amplifikálják, amelyek a vektorral átfedő régiókat tartalmazó PCR-terméket hoznak létre. A vektort és az inszertet ezután összekeverik, denaturálják és lágyítják, lehetővé téve az inszert hibridizációját a vektorral. A PCR második fordulója rekombináns DNS-molekulákat hoz létre az inszertet tartalmazó vektorból. Az overlap extension PCR lehetővé tette a kutatók számára, hogy olyan nagyméretű géneket rakjanak össze, amelyeket a hagyományos PCR-módszerekkel nem lehetett volna könnyen felerősíteni. Az overlap extension PCR-t használták arra is, hogy mutációkat vezessenek be génszekvenciákba (34).
2. ábra. A PCR áttekintése

A speciális klónozási technikák kifejlesztése.
A molekuláris klónozás hatékonyságának további javítására törekedve számos speciális eszközt és technikát fejlesztettek ki, amelyek egyedi enzimek tulajdonságait használták ki.
TA klónozás. Az egyik megközelítés a Taq DNS-polimeráz, az első PCR-hez használt hőstabil polimeráz egyik tulajdonságát használta ki. Az amplifikáció során a Taq minden PCR-termék végéhez egyetlen 3´ dA nukleotidot ad hozzá. A PCR-termék könnyen ligálható egy olyan vektorba, amelyet úgy vágtak és alakítottak át, hogy mindkét szálon egyetlen T-maradékot tartalmazzon. Több cég is forgalmazza ezt a technikát, és olyan klónozó vektorokat tartalmazó készleteket árusít, amelyek már linearizáltak és “farokkal” vannak ellátva.
LIC. A ligációtól független klónozás (LIC), ahogy a neve is mutatja, lehetővé teszi a DNS-molekulák összekapcsolását DNS-ligáz hiányában. A LIC-et általában T4 DNS-polimerázzal végzik, amelyet arra használnak, hogy egyszálú, >12 nukleotid hosszúságú DNS-nyúlványokat hozzanak létre mind a linearizált vektor-DNS-re, mind a klónozandó inzertre (35). Összekeveredve a vektor és az inzert a hosszú, kompatibilis végeken keresztül annealizálódik. A kompatibilis végek hossza elegendő ahhoz, hogy ligáz hiányában is összetartsa a molekulát, még a transzformáció során is. A transzformációt követően a hézagok in vivo javulnak. A LIC.USER-klónozáshoz több különböző kereskedelmi forgalomban kapható termék létezik.
Az 1990-es évek elején fejlesztették ki a USER-klónozást, mint restrikciós enzim- és ligázfüggetlen klónozási módszert (36). Az első elképzelésekor a módszer olyan PCR-primerek használatán alapult, amelyek ~12 nukleotid 5´ farkat tartalmaztak, amelyben legalább négy dezoxitimidin bázist dezoxiridinnel helyettesítettek. A PCR-terméket uracil DNS-glikozidázzal (UDG) és VIII-as endonukleázzal kezelték, amely eltávolítja az uracil bázisokat, és egy 3´-os átfedést hagy, amelyet egy hasonlóan kezelt vektorhoz lehet láncolni. A NEB forgalmazza az USER enzimet ligáz- és restrikciós enzimektől független klónozási reakciókhoz.
Jövőbeli tendenciák
A molekuláris klónozás az egyetlen DNS-fragmentum klónozásától eljutott több DNS-komponens egyetlen összefüggő DNS-szakaszba történő összeszereléséig. Az új és kialakulóban lévő technológiák arra törekszenek, hogy a klónozást olyan folyamattá alakítsák át, amely olyan egyszerű, mint a DNS “blokkjainak” egymás mellé rendezése.
DNS-összeszerelési módszerek. Számos új, elegáns technológia lehetővé teszi több DNS-töredék egycsöves reakcióban történő összeszerelését. E technológiák előnye, hogy standardizáltak, zökkenőmentesek és többnyire szekvenciafüggetlenek. Ezenkívül a több DNS-fragmentum egy csőben történő összerakásának képessége a korábban egymástól független restrikciós/ligációs reakciók sorozatát egy racionalizált, hatékony eljárássá alakítja.
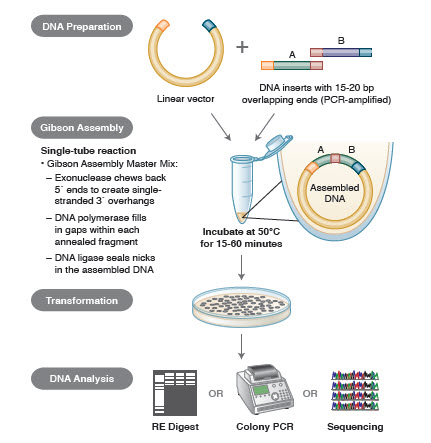
A génösszeszerelés különböző technikái és termékei közé tartozik a SLIC (Sequence and Ligase Independent Cloning), a Gibson Assembly (NEB), a GeneArt® Seamless Cloning (Life Technologies) és a Gateway® Cloning (Invitrogen) (35,37,38).
A DNS-összeszerelés során az összeszerelendő DNS-blokkokat PCR-amplifikálják. Ezután az egymás mellett összeillesztendő DNS-töredékeket úgy alakítják ki, hogy azok komplementer szekvenciákból álló blokkokat tartalmazzanak, amelyeket össze fognak ligálni. Ezek lehetnek kompatibilis kohéziós végek, mint például a Gibson-összeszereléshez használtak, vagy a helyspecifikus rekombinázok (Gateway) felismerőhelyeit tartalmazó régiók. A DNS-ligációhoz használt enzim felismeri és összerakja a kompatibilis régiók mindegyikét, így egyetlen reakcióban egyetlen, összefüggő DNS-molekulát hoz létre.
3. ábra. A Gibson assembly klónozási módszer áttekintése
Szintetikus biológia. A DNS-szintézis a szintetikus biológia egyik területe, amely jelenleg forradalmasítja a rekombináns DNS-technológiát. Bár 1972-ben szintetizáltak először teljes gént in vitro (40), a nagy DNS-molekulák DNS-szintézise csak a 2000-es évek elején vált valósággá, amikor a kutatók elkezdtek teljes genomokat in vitro szintetizálni (41,42). Ezek a korai kísérletek évekig tartottak, de a technológia felgyorsítja a nagy DNS-molekulák szintézisének képességét.
Következtetés
Az elmúlt 40 évben a molekuláris klónozás a két DNS-darab fáradságos izolálásától és összerakásától, majd a potenciális klónok intenzív szűrésétől a néhány óra alatt akár 10 DNS-fragmentum figyelemre méltó hatékonysággal történő zökkenőmentes összeállításáig, vagy a DNS-molekulák in silico tervezéséig és in vitro szintéziséig jutott el. Mindezek a technológiák együttesen a molekuláris biológusok számára a DNS feltárásához, manipulálásához és hasznosításához elképesztően hatékony eszköztárat biztosítanak, amely tovább szélesíti a tudomány horizontjait. A lehetőségek között szerepel a biztonságosabb rekombináns fehérjék kifejlesztése a betegségek kezelésére, a génterápia javítása (43), valamint az új vakcinák gyorsabb előállítása, validálása és forgalomba hozatala (44). De végső soron a lehetőségeknek csak a képzeletünk szab határt.
Rebecca Tirabassi a Bitesizebio.com segédszerkesztője.
Molekuláris klónozás technikai útmutató
megtekintése