Definición: La batería que utiliza plomo esponjoso y peróxido de plomo para la conversión de la energía química en energía eléctrica, tal tipo de batería se llama batería de plomo-ácido. La batería de plomo-ácido es la más utilizada en las centrales eléctricas y subestaciones porque tiene un mayor voltaje de celda y un menor coste.
Construcción de la batería de plomo-ácido
A continuación se muestran las distintas partes de la batería de plomo-ácido. El contenedor y las placas son la parte principal de la batería de plomo-ácido. El recipiente almacena energía química que se convierte en energía eléctrica con la ayuda de las placas.
1. Contenedor – El contenedor de la batería de plomo-ácido está hecho de vidrio, madera revestida de plomo, ebonita, goma dura de compuesto bituminoso, materiales cerámicos o plásticos moldeados y se asientan en la parte superior para evitar la descarga del electrolito. En la parte inferior del contenedor hay cuatro costillas, sobre dos de ellas descansa la placa positiva y las otras soportan las placas negativas.
El prisma sirve de soporte para las placas y al mismo tiempo las protege de un cortocircuito.El material del que están hechos los contenedores de las baterías debe ser resistente al ácido sulfúrico, no debe deformarse ni ser poroso, ni contener impurezas que dañen el electrolito.
2. Placa – La placa de la célula de plomo-ácido es de diseño diverso y todas constan de alguna forma de una rejilla que está formada por plomo y el material activo. La rejilla es esencial para conducir la corriente eléctrica y para distribuir la corriente de manera uniforme en el material activo. Si la corriente no se distribuye uniformemente, el material activo se aflojará y se caerá.
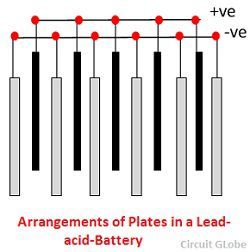 Las rejillas están hechas de una aleación de plomo y antimonio. Suelen estar hechas con el nervio transversal que cruza los lugares en ángulo recto o en diagonal. La rejilla para las placas positivas y negativas son del mismo diseño, pero las rejillas para las placas negativas se hacen más ligeras porque no son tan esenciales para la conducción uniforme de la corriente.
Las rejillas están hechas de una aleación de plomo y antimonio. Suelen estar hechas con el nervio transversal que cruza los lugares en ángulo recto o en diagonal. La rejilla para las placas positivas y negativas son del mismo diseño, pero las rejillas para las placas negativas se hacen más ligeras porque no son tan esenciales para la conducción uniforme de la corriente.
Las placas de la batería son de dos tipos. Son las placas formadas o placas de plante y las placas pegadas o de faure.
Las placas de plante se utilizan principalmente para las baterías estacionarias, ya que son más pesadas y más costosas que las placas pegadas. Pero las placas son más duraderas y menos propensas a perder material activo por la carga y descarga rápida. La placa de plantes tiene una relación peso-capacidad baja.
El proceso de Faure es mucho más adecuado para la fabricación de placas negativas que de placas positivas. El material activo negativo es bastante resistente y sufre un cambio comparativamente bajo de la carga y la descarga.
3. Material activo – El material de una célula que toma parte activa en una reacción química (absorción o evolución de la energía eléctrica) durante la carga o la descarga se llama el material activo de la célula. Los elementos activos del ácido de plomo son
- Peróxido de plomo (PbO2) – Forma el material activo positivo. El PbO2 es de color chocolate oscuro.
- Plomo esponjoso – Forma el material activo negativo. Es de color gris.
- Ácido sulfúrico diluido (H2SO4) – Se utiliza como electrolito. Contiene un 31% de ácido sulfúrico.
El peróxido de plomo y el plomo esponjoso, que forman los materiales activos negativo y positivo, tienen la poca resistencia mecánica y, por lo tanto, pueden utilizarse solos.
4. Separadores – Los separadores son finas láminas de material no conductor compuestas por madera de plomo tratada químicamente, gomas porosas o esteras de fibra de vidrio y se colocan entre el positivo y el negativo para aislarlos entre sí. Los separadores están ranurados verticalmente en un lado y son lisos en el otro.
5. Terminales de la batería – Una batería tiene dos terminales el positivo y el negativo. El terminal positivo, con un diámetro de 17,5 mm en la parte superior, es ligeramente mayor que el terminal negativo, que tiene un diámetro de 16 mm.
Principio de funcionamiento de la batería de plomo
Cuando el ácido sulfúrico se disuelve, sus moléculas se rompen en iones positivos de hidrógeno (2H+) e iones negativos de sulfato (SO4-) y se mueven libremente. Si los dos electrodos se sumergen en las soluciones y se conectan a la alimentación de corriente continua, los iones de hidrógeno, al estar cargados positivamente, se desplazan hacia los electrodos y se conectan al terminal negativo de la alimentación. Los iones SO4- que están cargados negativamente se mueven hacia los electrodos conectados al terminal positivo de la red de alimentación (es decir, ánodo).
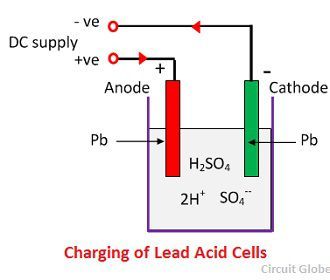 Cada ion de hidrógeno toma un electrón del cátodo, y cada ión de sulfato toma los dos iones negativos de los ánodos y reacciona con el agua y forma ácido sulfúrico y ácido de hidrógeno.
Cada ion de hidrógeno toma un electrón del cátodo, y cada ión de sulfato toma los dos iones negativos de los ánodos y reacciona con el agua y forma ácido sulfúrico y ácido de hidrógeno.
El oxígeno, que se produce a partir de la ecuación anterior reacciona con el óxido de plomo y forma peróxido de plomo (PbO2.) Así, durante la carga, el cátodo de plomo permanece como plomo, pero el ánodo de plomo se convierte en peróxido de plomo, de color chocolate.
Si la fuente de alimentación de corriente continua se desconecta y si el voltímetro se conecta entre los electrodos, mostrará la diferencia de potencial entre ellos. Si el cable conecta los electrodos, entonces la corriente fluirá desde la placa positiva a la negativa a través del circuito externo, es decir, la célula es capaz de suministrar energía eléctrica.
Acción química durante la descarga
Cuando la célula está totalmente descargada, entonces el ánodo es de peróxido de plomo (PbO2) y el cátodo es de plomo esponjoso metálico (Pb). Cuando los electrodos se conectan a través de una resistencia, la célula se descarga y los electrones fluyen en una dirección opuesta a la de la carga.
Los iones de hidrógeno se mueven hacia el ánodo y al llegar a él reciben un electrón del ánodo y se convierten en átomo de hidrógeno. El átomo de hidrógeno entra en contacto con un PbO2, por lo que ataca y forma sulfato de plomo (PbSO4), de color blanquecino y agua según la ecuación química.
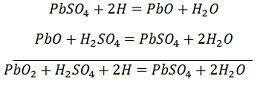
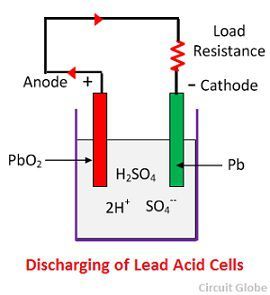 Cada ion sulfato (SO4-) se desplaza hacia el cátodo y al llegar allí cede dos electrones se convierte en radical SO4, ataca al cátodo de plomo metálico y forma sulfato de plomo de color blanquecino según la ecuación química.
Cada ion sulfato (SO4-) se desplaza hacia el cátodo y al llegar allí cede dos electrones se convierte en radical SO4, ataca al cátodo de plomo metálico y forma sulfato de plomo de color blanquecino según la ecuación química.
Acción química durante la recarga
Para la recarga, el ánodo y el cátodo se conectan al terminal positivo y al negativo de la red de alimentación de corriente continua. Las moléculas del ácido sulfúrico se rompen en iones de 2H+ y SO4-. Los iones de hidrógeno, al estar cargados positivamente, se desplazan hacia los cátodos y reciben de ellos dos electrones y forman un átomo de hidrógeno. El átomo de hidrógeno reacciona con el cátodo de sulfato de plomo formando plomo y ácido sulfúrico según la ecuación química.
![]()
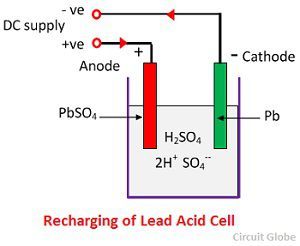 El ion SO4- se desplaza hacia el ánodo, cede sus dos electrones adicionales se convierte en radical SO4, reacciona con el ánodo de sulfato de plomo y forma peróxido de plomo y ácido sulfúrico de plomo según la ecuación química.
El ion SO4- se desplaza hacia el ánodo, cede sus dos electrones adicionales se convierte en radical SO4, reacciona con el ánodo de sulfato de plomo y forma peróxido de plomo y ácido sulfúrico de plomo según la ecuación química.![]() La carga y la descarga están representadas por una única ecuación reversible dada a continuación.
La carga y la descarga están representadas por una única ecuación reversible dada a continuación.
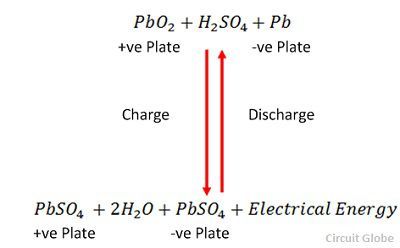 La ecuación debe leerse hacia abajo para la descarga y hacia arriba para la recarga.
La ecuación debe leerse hacia abajo para la descarga y hacia arriba para la recarga.