Et molekyls form afhænger af antallet af elektronpar i den yderste skal, der omgiver et centralt atom. Når du først har fundet ud af, hvor mange bindingspar og ikke-bindingspar der er, er resten let
Snakkemærkning om bindingspar!
Ignorer dobbeltbindinger, de tæller som ét bindingspar!

dvs. CO2 til dette formål har kun to bindingspar (selv om vi ved, at det i virkeligheden har 4, 2 par mellem hvert ilt og brintet)
Den form, som molekylerne danner, har alt at gøre med Valence shell electron pair repulsion theory (VSEPR). Hvilket lyder kompliceret, men den generelle regel er, at alle parene vil frastøde hinanden, således at alle elektronpar vil sprede sig i alle tre dimensioner for at komme så langt væk som muligt. De former, der dannes ved denne spredning, er meget vigtige og kan påvirke molekylets kemi i meget høj grad.
| Ingen par af e- |
Ingen par af bindinger e- | Ingen ikke bindingsfri par af e- | Navn på form | Binding i rummet | Bindingsvinkler | Eksempler | |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linær | 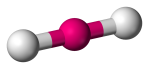 |
180o | CO2 | |
| 3 | 3 | 0 | Trigonalt planar | 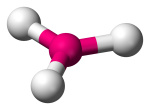 |
120o | BF3 | |
| 3 | 2 | 1 | Angulær, V-formet eller bøjet |  |
120o | SO2 | |
| 4 | 4 | 4 | 0 | Tetraedrisk | 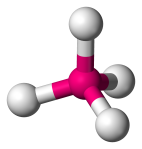 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonalt pyramidalt | 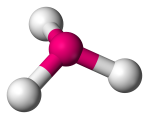 |
107o | NH3 | |
| 4 | 4 | 2 | 2 | Angular, V-formet eller bøjet |  |
104.5o | H2O |
| 6 | 6 | 0 | Oktaedrisk | 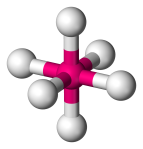 |
90o | SF6 |