Kształt molekuły zależy od liczby par elektronów w zewnętrznej powłoce otaczającej atom centralny. Kiedy już dowiesz się, ile jest par wiążących i niewiążących, reszta jest prosta
Krótka uwaga o parach wiążących!
Nie zwracaj uwagi na wiązania podwójne, liczą się one jako jedna para wiążąca!

i.e. CO2 w tym celu ma tylko dwie pary wiązań (chociaż wiemy, że w rzeczywistości ma 4, 2 pary między każdym tlenu i wodoru)
Kształty cząsteczki tworzą jest wszystko do czynienia z teorią odpychania par elektronów powłoki walencyjnej (VSEPR). Co brzmi skomplikowanie, ale ogólna zasada jest taka, że wszystkie pary będą odpychać się nawzajem, tak że wszystkie pary elektronów będzie rozprzestrzeniać się we wszystkich trzech wymiarach, tak aby dostać się tak daleko, jak to możliwe. Kształty, które są tworzone przez to rozprzestrzenianie się są bardzo ważne i mogą mieć ogromny wpływ na chemię cząsteczki.
| No pairs of e- |
No pairs of bonding e- | No non- wiążących par e- | Nazwa kształtu | Umieszczenie w przestrzeni | Kąty wiązania | Przykłady | |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Liniowe | 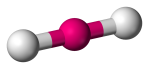 |
180o | CO2 | |
| 3 | 3 | 0 | Trójkątny planarny | Planarny | 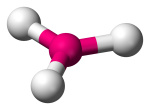 |
120o | BF3 |
| 3 | 2 | 1 | Kątowa, V-kształtne lub wygięte |  |
120o | SO2 | |
| 4 | 4 | 0 | Tetraedryczne | 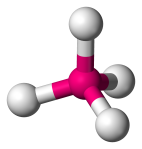 |
109.5o | CH4 | |
| 4 | 3 | 1 | Piramida trygonalna | 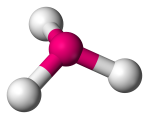 |
107o | NH3 | |
| 4 | 2 | 2 | Kątowy, V-kształtny lub wygięty |  |
104.5o | H2O | |
| 6 | 6 | 0 | Oktaedryczny | 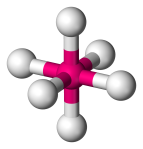 |
90o | SF6 |
.