La forme d’une molécule dépend du nombre de paires d’électrons dans la coquille la plus externe entourant un atome central. Une fois que vous avez trouvé combien de paires de liaison et de paires non liantes il y a, le reste est facile
Note rapide sur les paires de liaison!
Ne tenez pas compte des doubles liaisons, elles comptent pour une paire de liaison!

si par exemple. Le CO2 à cet effet n’a que deux paires de liaison (bien que nous sachions qu’en réalité il en a 4, 2 paires entre chaque oxygène et l’hydrogène)
Les formes que forment les molécules sont toutes liées à la théorie de la répulsion des paires d’électrons de la coquille de Valence (VSEPR). Ce qui semble compliqué mais la règle générale est que toutes les paires vont se repousser les unes les autres de sorte que toutes les paires d’électrons vont s’étaler dans les trois dimensions afin de s’éloigner le plus possible. Les formes qui sont formées par cet étalement sont très importantes et peuvent influencer énormément la chimie de la molécule.
| Pas de paires de e- |
Pas de paires de e- | non liantes. liants de e- | Nom de la forme | Arrangement dans l’espace | Angles de liaison | Exemples | |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linéaire | 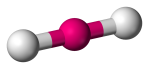 |
180o | CO2 | |
| 3 | 3 | 0 | Trigonal Planaire | 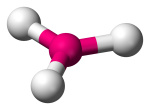 |
120o | BF3 | |
| 3 | 2 | 1 | Angulaire, en V ou coudée |  |
120o | SO2 | |
| 4 | 4 | 0 | Tétraédrique | 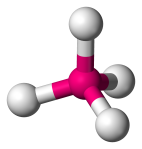 |
109.5o | CH4 | |
| 4 | 3 | 1 | Pyramide trigonale | 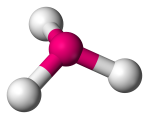 |
107o | NH3 | |
| 4 | 2 | 2 | Angulaire, en V ou coudée |  |
104.5o | H2O | |
| 6 | 6 | 0 | Octaédrique | 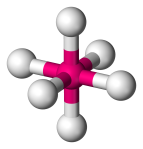 |
90o | SF6 |
.