Tvar molekuly závisí na počtu párů elektronů ve vnějším obalu obklopujícím centrální atom. Jakmile zjistíte, kolik je vazebných a nevazebných párů, zbytek už je snadný
Rychlá poznámka k vazebným párům!
Dvojné vazby ignorujte, počítají se jako jeden vazebný pár!

tj. CO2 má pro tento účel pouze dva vazebné páry (i když víme, že ve skutečnosti má 4, 2 páry mezi každým kyslíkem a vodíkem)
Tvary, které molekuly tvoří, souvisí s teorií odpuzování elektronových párů ve valenčním obalu (VSEPR). Což zní složitě, ale obecným pravidlem je, že se všechny páry navzájem odpuzují, takže se všechny elektronové páry rozprostřou do všech tří rozměrů tak, aby se dostaly co nejdále. Tvary, které tímto rozprostřením vznikají, jsou velmi důležité a mohou velmi ovlivnit chemii molekuly.
| Žádné páry z e- |
Žádné vazebné páry e- | Žádné ne. vazebných dvojic e- | Název tvaru | Uspořádání v prostoru | Vazbové úhly | Příklady |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Lineární | 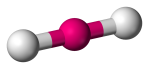 |
180o | CO2 |
| 3 | 3 | 0 | Trigonální rovinný | 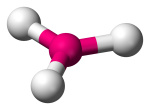 |
120o | BF3 |
| 3 | 2 | 1 | Angulární, V-tvarovaný nebo ohnutý |  |
120o | SO2 |
| 4 | 4 | 0 | Tetraedrický | 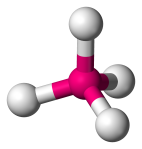 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonální pyramidální | 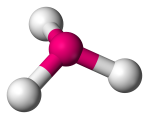 |
107o | NH3 |
| 4 | 2 | 2 | Angulární, V nebo ohnuté |  |
104.5o | H2O |
| 6 | 6 | 0 | Oktaedrický | 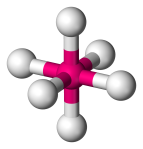 |
90o | SF6 |
.