分子の形は、中心原子を取り巻く最外殻にある電子の対の数によって決まります。 結合対と非結合対の数がわかれば、あとは簡単です
結合対についての簡単なメモ!
二重結合は無視し、1つの結合対として数える!

i.e.. この目的のために、CO2はちょうど2つの結合対を持っています(実際には、各酸素と水素の間に2対、合計4つの結合対を持っていることが分かっていますが)
分子が形成する形は、すべて価電子帯電子対反発理論(VSEPR)と関係があります。 複雑に聞こえますが、一般的には、すべての電子対が互いに反発し合うので、すべての電子対はできるだけ遠くへ行くように三次元的に広がるというものです。 この拡散によって形成される形状は非常に重要で、分子の化学的性質に多大な影響を与えることができます。
| No pairs of e- |
No pairs of bonding e- | No non-therapeutic e- | 形状名 | 空間配置 | 結合角 | 例 | |||
|---|---|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linear | 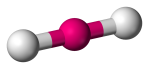 |
180o | CO2 | |||
| 3 | 0 | Trigonal Planar | 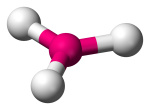 |
120o | BF3 | ||||
| 3 | 2 | 1 | Angular.BF1 | 1 | BF2 | 120o | BF3 |  |
120o | SO2 |
| 4 | 0 | Tetrahedral | 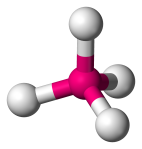 |
109.1 | CH4 | ||||
| 4 | 3 | 1 | Trigonal Pyramidal | 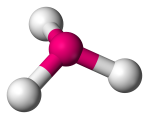 |
107o | NH3 | |||
| 4 | 2 | Angular(角状)です。 V字型または曲げ型 |  |
104.5o | H2O | ||||
| 6 | 0 | Octahedral | 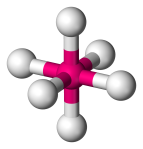 |
90o | SF6 |