Forma unei molecule depinde de numărul de perechi de electroni din învelișul cel mai exterior care înconjoară un atom central. Odată ce ați aflat câte perechi de legături și câte perechi nelegate există, restul este ușor
Observație rapidă despre perechile de legături!
Ignorați legăturile duble, ele contează ca o pereche de legături!

i.e. CO2 în acest scop are doar două perechi de legături (deși știm că în realitate are 4, 2 perechi între fiecare oxigen și hidrogen)
Formele pe care le formează moleculele țin de teoria repulsiei perechilor de electroni din învelișul de valență (VSEPR). Care sună complicat, dar regula generală este că toate perechile se vor respinge reciproc, astfel încât toate perechile de electroni se vor împrăștia în toate cele trei dimensiuni, astfel încât să se îndepărteze cât mai mult posibil. Formele care se formează prin această împrăștiere sunt foarte importante și pot influența foarte mult chimia moleculei.
| Nu există perechi de e- |
Nu există perechi de e- de legătură | Nu există perechi de e- de legătură | Nu există non- perechi de e- | Numele formei | Aranjament în spațiu | Unghiuri de legătură | Exemple |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Liniar | 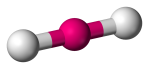 |
180o | CO2 | |
| 3 | 3 | 0 | Trigonal Planar | 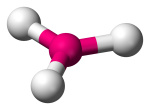 |
120o | BF3 | |
| 3 | 2 | 1 | Angular, în formă de V sau curbat |  |
120o | SO2 | |
| 4 | 4 | 4 | 0 | Tetraedral | 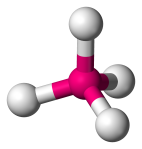 |
109.5o | CH4 |
| 4 | 3 | 1 | Piramidă trigonală | Trigonală piramidală | 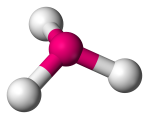 |
107o | NH3 |
| 4 | 2 | 2 | 2 | Angular, în formă de V sau încovoiat |  |
104.5o | H2O |
| 6 | 6 | 0 | Octaedru | 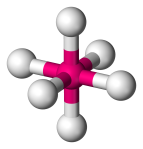 |
90o | SF6 |
.