En molekyls form beror på antalet elektronpar i det yttersta skalet som omger en central atom. När du väl har tagit reda på hur många bindningspar och icke-bindningspar det finns är resten enkelt
Snabb notering om bindningspar!
Ignorera dubbelbindningar, de räknas som ett bindningspar!

Det vill säga. CO2 har för detta ändamål bara två bindningspar (även om vi vet att den i verkligheten har 4, 2 par mellan varje syre och väte)
De former som molekylerna bildar har allt att göra med teorin om valensskalets elektronpars avstötning (VSEPR). Vilket låter komplicerat men den allmänna regeln är att alla par stöter bort varandra så att alla elektronpar sprids ut i alla tre dimensioner för att komma så långt bort som möjligt. De former som bildas av denna spridning är mycket viktiga och kan påverka molekylens kemi enormt mycket.
| Ingen par av e- |
Ingen par av bindande e- | Ingen icke-. | Namn på form | Förhållande i rummet | Bindningsvinklar | Exempel | |
|---|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linjärt | 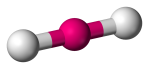 |
180o | CO2 | |
| 3 | 3 | 0 | Trigonal Planar | 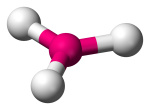 |
120o | BF3 | |
| 3 | 2 | 1 | Angular, V-formad eller böjd |  |
120o | SO2 | |
| 4 | 4 | 4 | 0 | Tetraederal | 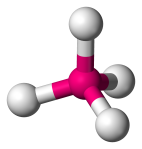 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonal pyramidal | 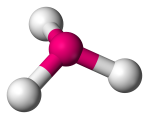 |
107o | NH3 | |
| 4 | 2 | 2 | Angular, V-formad eller böjd |  |
104.5o | H2O | |
| 6 | 6 | 0 | Oktaeder | 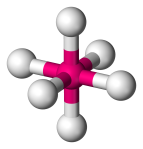 |
90o | SF6 |