A forma de uma molécula depende do número de pares de electrões no exterior mais exterior da concha que rodeia um átomo central. Uma vez que você descobre quantos pares de ligação e pares sem ligação existem, o resto é fácil
Nota rápida sobre a ligação de pares!
Ignorar ligações duplas, elas contam como um par de ligação!

i.e. O CO2 para este fim tem apenas dois pares de ligação (embora saibamos que na realidade tem 4, 2 pares entre cada oxigénio e o hidrogénio)
A forma das moléculas tem tudo a ver com a teoria da repulsão de pares de electrões do casco de Valence (VSEPR). O que parece complicado mas a regra geral é que todos os pares se repelirão uns aos outros para que todos os pares de electrões se espalhem nas três dimensões de forma a chegarem o mais longe possível. As formas que são formadas por esta propagação são muito importantes e podem influenciar a química da molécula em grande quantidade.
| Sem pares de e- |
Sem pares de ligação e- | Sem não pares de ligação de e- | Nome da forma | Arranjo no espaço | Angulos de ligação | Exemplos |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linear | 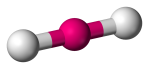 |
180o | CO2 |
| 3 | 3 | 0 | Planar Trigonal | 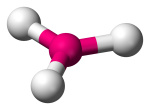 |
120o | BF3 |
| 3 | 2 | 1 | Angular, Em forma de V ou dobrado |  |
120o | SO2 |
| 4 | 4 | 0 | Tetraédrico | 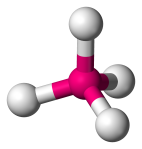 |
109.5o | CH4 |
| 4 | 3 | 1 | >Piramidal Trigonal | 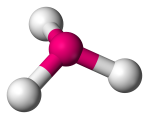 |
107o | NH3 |
| 4 | 2 | 2 | Angular, Em forma de V ou Bent |  |
104.5o | H2O |
| 6 | 6 | 0 | Octaédrico | 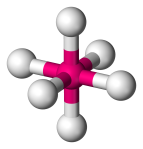 |
90o | SF6 |